Химия итог. Утверждаю Зав кафедрой общей и биологической химии, д б. н., профессор К. С. Эльбекьян 2015г. Итоговое тестирование по дисциплине Общая и неорганическая химия для студентов 190 группы
 Скачать 214.5 Kb. Скачать 214.5 Kb.
|
|
ГБОУ ВПО Ставропольский государственный медицинский университет Министерства здравоохранения Российской Федерации Кафедра общей и биологической химии «Утверждаю» Зав. кафедрой общей и биологической химии, д.б.н., профессор ________________К.С.Эльбекьян «_____»________________2015г. ИТОГОВОЕ ТЕСТИРОВАНИЕ по дисциплине «Общая и неорганическая химия» для студентов 190 группы (направление подготовки - Биотехнология) очная форма обучения 2 семестр Комплексные соединения 1.Комплексные соединения — это: 1)сложные устойчивые химические образования; 2)вещества, состоящие из комплексообразователя и лигандов; 3)соединения, состоящие из внутренней и внешней сферы; 4)сложные устойчивые химические соединения, в которых обязательно присутствует связь, образованная по донорно-акцепторному механизму. 2.Комплексообразователи — это: 1)только атомы, доноры электронных пар; 2)только ионы, акцепторы электронных пар; 3)только d-элементы, доноры электронных пар; 4)атомы или ионы, акцепторы электронных пар. 3.Назовите комплексообразователь в гемоглобине: 1)Сu0; 2)Fe3+; 3)Fe2+ 4)Fe0. 4.Лиганды — это: 1)молекулы, доноры электронных пар; 2)ионы, акцепторы электронных пар; 3)молекулы и ионы — акцепторы электронных пар; 4)молекулы и ионы — доноры электронных пар. 5.При образовании комплекса лиганды являются: 1)донором электронной пары; 2)акцептором электронной пары; 3)и донором, и акцептором электронной пары; 4)ковалентная связь в комплексе образуется по обменному механизму. 6.Какая связь между комплексообразователем и лигандами? 1)ковалентная по донорно-акцепторному механизму; 2)ковалентная по обменному механизму; 3)ионная; 4)водородная. 7.Дентатность — это: 1)число связей между комплексообразователем и лигандами; 2)число электронодонорных атомов в лиганде; 3)число электронодонорных атомов в комплексообразователе; 4)число электроноакцепторных атомов в комплексообразователе. 8.В хелатные соединения входят: 1)монодентатные лиганды; 2)полидентатные лиганды; 3)бидентатные лиганды; 4)би- и полидентатные лиганды. 9.По дентатности этилендиаминтетраацетат является лигандом: 1)монодентатным; 2)полидентатным; 3)бидентатным; 4)тетрадентатным. 10.Какова дентатность лиганда ОН-? 1)моно-; 2)би-; 3)поли-; 4)тетра-. 11.Какой лиганд является бидентатным? 1)СО32-; 2)ОН-; 3)Н2О; 4)NH3. 12.Выберите ряд монодентатных лигандов: 1) Cl-, СО32-,NH3, СО; 2)F-, NO2-, CNS-, С2О42-; 3) Н2О, NO2-, ОН-, CN-; 4)Н2О, СО32-, CN-, NH3. 13.Комплексоны — это: 1)любые лиганды; 2)би- и полидентатные лиганды; 3)любые комплексообразователи; 4)только полидентатные лиганды. 14.Комплексонами являются: 1)хелатообразующие би- и полидентатные лиганды — доноры электронных пар; 2)органические соединения, способные к образованию комплексных соединений; 3)полидентатные лиганды-акцепторы электронных пар; 4)моно- и бидентатные лиганды. 15.Через атомы каких элементов, как правило, идет координация лигандов с металлами в биокомплексах? 1)O, N; 2)O, S, N; 3)Н, О, Р; 4)H, P, S. 16.Что такое координационное число? 1)число связей комплексообразователя; 2)число центральных атомов; 3)число лигандов; 4)заряд внутренней сферы. 17.Укажите координационное число центрального атома и его заряд в соединении [Сr(NH3)4Cl2]. 1)4, +2; 2)6, -3; 3)2, +2; 4)6, +2. 18.Укажите координационное число центрального атома и его заряд в соединении [Со(NH3)3Cl3] 1)6, +3; 2)4, +3; 3)6, +2; 4)4, +3. 19.Чем меньше Кн, тем комплекс более: 1)устойчивый; 2)устойчивость не определяется величиной Кн; 3)неустойчивый; 4)растворимый. 20.Чему равна степень окисления центра атома в молекуле K3[Fe(CN)6]? 1)+3; 2)+4; 3)+2; 4)0. 21.Определите заряд внутренней сферы в соединении K4[Fe(CN)6]: 1)+4; 2)-4; 3)-3; 4)-2. 22.Какое комплексное соединение не имеет первичной диссоциации? 1)K2[PtCl6]; 2)[Co(NH3)6]Cl3; 3)[Pt(NH3)2Cl2]; 4)[Ag(NH3)2]OH. 23.Определите степень окисления центрального атома в соединении [Pt(NH3)2Cl2]: 1)+4; 2)+2; 3)0; 4)+6. 24.Определите степень окисления центрального атома в соединении [Со(NH3)6]Cl3: 1)+2; 2)+3; 3)+6; 4)0. 25.Определите заряд внутренней сферы в комплексном соединении К3[Al(ОН)6]. 1)-3; 2)+3; 3)+4; 4)-6. 26.Каков заряд внутренней сферы и комплексообразователя в соединении K4[FeF6]? 1)-4, +3; 2)-4, +2; 3)+3, -2; 4)-2, +6. 27. В соединении [Ag(NH3)2]Cl степень окисления и тип гибридизации центрального атома: 1)+1, sp; 2)+1, sp2; 3)+2, sp; 4)0, sp. 28.Какой элемент является комплексообразователем в хлорофилле? 1)Со; 2)Fe; 3)Mg; 4)Mn. 29.Назовите элемент — комплексообразователь в молекуле витамина В12: l)Fe; 2)Со; 3)Ni; 4)Mg. 30.В состав полости биокластера металлоферментов цитохромов входит катион металла: 1)Мо; 2)Zn; 3)Fe; 4)Сu. 31.Каков механизм образования связи между внутренней и внешней сферой в комплексном соединении? 1)ионный; 2)ковалентный; 3)донорно-акцепторный; 4)металлическая связь; 32.Какова максимальная дентатность в трилоне Б? 1)4; 2)2; 3)6; 4)8; 33.Константы нестойкости комплексных ионов [Co(CN)4]2- (A), [Hg(CN)4]2- (В), [Cd(CN)4]2- (С) соответственно равны 8·10-20, 4·10-41, 1,4·10-17. В каком растворе, содержащем эти ионы, при равной молярной концентрации ионов CN- больше? 1)А; 2)В; 3)С. 34.Для комплексных ионов [Ag(CN)2]- (A), [Ag(NH3)2]+ (В), [Ag(SCN)2]- (С) константы нестойкости соответственно равны 1,0·10-21, 6,8·10-8, 2,0·10-11, укажите, в каком растворе, содержащем эти ионы, при равной молярной концентрации больше ионов Ag+? 1)А; 2)В; 3)С. 35.Константы нестойкости комплексных ионов [Co(NH3)6]3+ (A), [Fe(CN)6]4- (В), [Fe(CN)6]3- (С) соответственно равны 6,2·10-36, 1,0·10-37, 1,0·10-44. Какой из этих ионов является более прочным? 1)А; 2)В; 3)С. ОТВЕТЫ 1 – 4; 2 – 4; 3 – 3; 4 – 4; 5 – 1; 6 – 1; 7 – 1; 8 – 4; 9 – 2; 10 – 1;11 – 1; 12 – 3; 13 – 2; 14 – 1; 15 – 1; 16 – 1; 17 – 4; 18 – 1; 19 – 1; 20 – 1;21 – 2; 22 – 3; 23 – 2; 24 – 2; 25 – 1; 26 – 2; 27 – 3; 28 – 2; 29 – 2; 30 – 3; 31 – 1; 32 – 3; 33 – 2; 34 – 2; 35-3. Коллигативные свойства растворов 1.Коллигативные свойства растворов зависят от: 1)природы растворителя; 2)температуры; 3)числа частиц растворенного вещества; 4)природы растворенного вещества. 2.Осмос — это: 1)направленный самопроизвольный переход молекул растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией; 2)направленный самопроизвольный переход молекул растворителя через полупроницаемую мембрану из раствора с большей концентрацией в раствор с меньшей концентрацией; 3)направленный самопроизвольный переход молекул растворенного вещества через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией; 4)направленный самопроизвольный переход молекул растворенного вещества через полупроницаемую мембрану из раствора с большей концентрацией в раствор с меньшей концентрацией. 3.Будут ли изотоническими 10%-ные растворы глюкозы и фруктозы? 1)будут, т. к. равны их массовые доли в растворе; 2)будут, т. к. равны их молярные концентрации вследствие равенства молярных масс; 3)будут, т. к. являются неэлектролитами. 4.Будут ли изотоническими 10%-ные растворы глюкозы и сахарозы? 1)будут, т. к. равны их массовые доли в растворе; 2)не будут, т. к. различны их молярные концентрации в растворе вследствие отличия молярных масс; 3)будут, т. к, являются неэлектролитами. 5.В 2%-ном растворе глюкозы эритроциты будут подвергаться: 1)плазмолизу вследствие эндоосмоса; 2)гемолизу вследствие экзоосмоса; 3)плазмолизу вследствие экзоосмоса; 4)гемолизу вследствие эндоосмоса 6.В 5%-ном растворе глюкозы эритроциты будут: 1)находиться в равновесном состоянии; 2)подвергаться гемолизу вследствие экзоосмоса; 3)подвергаться плазмолизу вследствие эндоосмоса; 4)подвергаться плазмолизу вследствие экзоосмоса. 7.В 20%-ном растворе глюкозы эритроциты будут подвергаться: 1)плазмолизу вследствие эндоосмоса; 2)гемолизу вследствие экзоосмоса; 3)плазмолизу вследствие экзоосмоса; 4)гемолизу вследствие эндоосмоса. 8. 0,5%-ный раствор NaCl является по отношению к плазме крови: 1)гипотоническим; 2)гипертоническим; 3)изотоническим. 9. 5%-ный раствор NaCl является по отношению к плазме крови: 1)гипотоническим; 2)гипертоническим; 3)изотоническим. 10.Онкотические отеки («почечные» или «голодные») возникают: 1)за счет уменьшения онкотического давления при гипопротеинемии; 2)за счет увеличения онкотического давления при гиперпротеинемии; 3)за счет увеличения онкотического давления при возрастании концентрации электролитов; 4)за счет уменьшения онкотического давления при уменьшении концентрации форменных элементов. 11.Осмотическое давление пропорционально: 1)молярной концентрации растворенного вещества; 2)моляльной концентрации растворенного вещества; 3)молярной концентрации эквивалента растворенного вещества; 4)молярной доле растворенного вещества. 12.Если в равновесную систему жидкость-пар ввести растворимое нелетучее вещество, то давление пара растворителя над раствором: 1)увеличится; 2)уменьшится; 3)не изменится; 4)уменьшается, затем увеличивается. 13.Относительное понижение давления пара над раствором пропорционально: 1)молярной доле растворенного вещества; 2)молярной концентрации растворенного вещества; 3)моляльной концентрации растворенного вещества; 4)молярной доле растворителя. 14.Давление пара над раствором при увеличении концентрации растворенного в нем нелетучего вещества по сравнению с чистым растворителем: 1)уменьшается, т. к. уменьшается молярная доля растворителя; 2)увеличивается, т. к. увеличивается молярная доля растворенного вещества; 3)не изменяется, т. к. растворенное вещество нелетучее. 15.Повышение температуры кипения и понижение температуры замерзания раствора по сравнению с растворителем пропорционально: 1)молярной концентрации растворенного вещества; 2)молярной концентрации эквивалента растворенного вещества; 3)моляльной концентрации растворенного вещества; 4)молярной доле растворителя. ОТВЕТЫ 1 – 3; 2 – 1; 3 – 2; 4 – 2; 5 – 4; 6 – 1; 7 – 3; 8 – 1; 9 – 2; 10 – 1;11 – 1; 12 – 2; 13 – 1; 14 – 1; 15 – 3. теории кислот и оснований 1. Математическое выражение закона Дебая-Гюккеля имеет вид: 1) 4) 2  . В реакции Сг3+ + 4OH- [Сг (OH)4]+ с позиции теории Льюиса он Сг3+ является . В реакции Сг3+ + 4OH- [Сг (OH)4]+ с позиции теории Льюиса он Сг3+ является 1) анионом; 2) кислотой; 3) основанием; 4) окислителем 3  . В реакции NH4+ + H2O NH3 + H3O+ ион NH4+ с позиций теории Бренстеда является . В реакции NH4+ + H2O NH3 + H3O+ ион NH4+ с позиций теории Бренстеда является1) кислотой; 2) анионом; 3) акцептором электронной пары; 4) основанием 4. При переходе к растворителю с большей диэлектрической проницаемостью степень диссоциации электролита 1) уменьшается; 2) не изменяется; 3) может как уменьшаться, так и увеличиваться; 4) увеличивается 5. Среди представленных щелочей самым слабым основанием является: 1) КOH; 2) LiOH; 3) NH3∙H2O; 4) Ba(OH)2 6  . В реакции протонирования H2O + H+ H3O+ молекула H2O с позиций теории Бренстеда- Лоури является: . В реакции протонирования H2O + H+ H3O+ молекула H2O с позиций теории Бренстеда- Лоури является:1) амфолитом 2) сольватирующим агентом; 3) основанием; 4) кислотой; 7 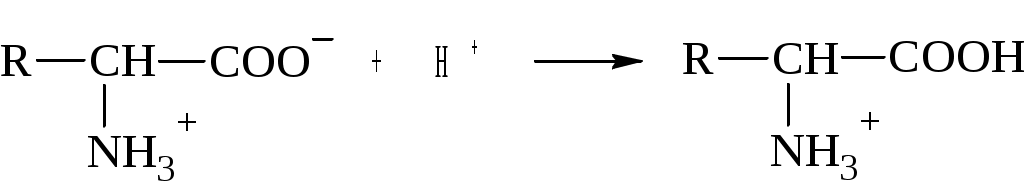 . В реакции . В реакции молекула белка с позиций теории Льюиса является: 1) акцептором электронной пары; 2) основанием; 3) кислотой; 4) амфолитом 8. При увеличении ионной силы раствора коэффициенты активности ионов: 1) возрастают для анионов, снижаются для катионов; 2) снижаются для анионов, возрастают для катионов; 3) не изменяются; 4) снижаются независимо от заряда иона 9  . В реакции HSO3 + OH SO32 + H2O с позиций теории Бренстеда- Лоури молекула Н2О по отношению к иону ОН является: . В реакции HSO3 + OH SO32 + H2O с позиций теории Бренстеда- Лоури молекула Н2О по отношению к иону ОН является:1) кислотой; 2) основанием; 3) сопряженной кислотой; 4) сопряженным основанием |
