Есмурат Сариев. В металлургии и ряде других отраслей техники используют
 Скачать 117.74 Kb. Скачать 117.74 Kb.
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Приход | Расход | ||||
| Материалы | кг | % | Продукт | Кг | % |
| Шлак | 50 | 23,072 | Металл | 53,430 | 24,658 |
| Руда | 50 | 23,072 | Шлак | 153,589 | 70,881 |
| Известь | 74,888 | 34,557 | Газы | 9,668 | 4,462 |
| СМн | 41,149 | 18,988 | Невязка | 0,000 | 0,000 |
| Электроды | 0,030 | 0,014 | | | |
| О2 на окисл | 0,642 | 0,296 | | | |
| Всего | 216,709 | 100,000 | Всего | 216,686 | 100,000 |
В материальном балансе разность между статьями расхода и прихода равна:
216,709 – 216,710= 0,001
2.7 Расчет удельного расхода материалов
Расчет расхода шихтовых материалов на 1 т сплава, кг:
Шлак 1000 · 50 / 53,430 = 935,8
Руда 1000 · 50 / 53,430 = 935,8
Известь 1000 · 74,888 / 53,430 = 1401,6
СМн 1000 · 41,149 / 53,430 = 770,2
3 РАСЧЕТ ТЕПЛОВОГО БАЛАНСА
Тепловой баланс процесса получения ферросплавов определяется равенством, кДж.
Qспл. + Qшл. + Qгаз + Qэнд. + Qпот. = Qфиз. + Qэкз. + Qэл.эн.
Qспл, Qшл., Qгаз – теплосодержание продуктов;
Qэнд. – тепловые затраты на эндотермические процессы;
Qпот. – тепловые потери процесса;
Qфиз. – физическое тепло нагретой шихты;
Qэкз. – экзотермическое тепло реакции окисления и шлакообразования;
Qэл.эн. – тепло, вводимое электроэнергией, которое определяется как разность между расходной и приходной частями баланса.
3.1 Приход тепла
3.1.1 Физическое тепло шихты
В расчетах, как правило, за нулевую отметку по температуре принимают температуру окружающей среды. Шихта внесет дополнительное тепло, если ее температура превышает температуру среды:
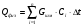
Так как в нашем случае по условиям расчета не предусмотрен предварительный нагрев шихты, то шихта не будет вносить дополнительное количество тепла Qфиз. = 0.
3.1.2 Экзотермическое тепло реакций
Статья включает тепло реакций окисления Qэкз.ок., тепло реакций восстановления Qэкз.восст., тепло металлообразования Qэкз.мет. и тепло шлакообразования Qэкз.шл.. Тепло от окисления кремния восстановителей на колошнике, растворения кремния в сплаве, образования силикатов в шлаке рассчитывают по количеству окислившегося элемента или образовавшегося соединения gi и соответствующему тепловому эффекту (табл. 8):
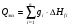
Qэкз = Qэкз.ок + Qэкз.восст + Qэкз.мет + Qэкз.шл
1. Тепло реакций окисления Qэкз.ок выделяется при окислении кремния кислородом воздуха по реакции:
Si + О2 = SiO2 ΔH= -911,55 кДж/моль
Qэкз. ок. = (41,149 · 0,2731 · 0,05) · 911,55 / 0,028 = 18 293 кДж
2. Тепло реакций восстановления Qэкз.восст выделяется при восстановлении марганца, железа и фосфора по реакциям:
1. 2MnO + Si→ 2Mn + SiO2 ΔН = - 911,55 + 2 · 385,186 = - 141,178 кДж/моль;
Q1 = 3,913 · 141,178 / 0,028 = 19 728 кДж.
2. MnO2 + Si→ Mn + SiO2 ΔН = - 911,55 + 521,257 = - 390,293 кДж/моль;
Q2 = 5,965 · 390,293 / 0,028 = 83 146 кДж.
Таблица 8 – Энтальпии образования оксидов
| Оксид | ∆Нf, кДж/моль | Оксид | ∆Нf, кДж/моль |
| Fe2O3 | -822,20 | FeSi | - 73,70 |
| SiO2 | -911,55 | Mn23C6 | -252,0 |
| P2O5 | -1530,50 | 2CaO ·SiO2 | - 2308,98 |
| MnO2 | -521,257 | MgO∙Al2O3 | - 2302,32 |
| MnO | -385,186 | MnO∙SiO2 | -1320,87 |
| СаСО3 | -1206,87 | H2Oж | -285,838 |
| СаО | -635,6 | H2Oг | -241,825 |
| СО2 | -393,51 | | |
3. 2Fe2O3 + 3Si = 4Fe + 3SiO2 ΔН = 3∙(-911,55) + 2 · 822,2 = -1090,25 кДж/моль;
Q3 = 1,147 · 1090,25 / (4 ∙ 0,056) = 5 581 кДж.
4. 2Р2O5 + 5Si = 4Р + 5 SiO2 ΔН = -4557,75+2 · 1530,5 =-1496,75 кДж/моль;
Q4 = 0,024 · 1496,75 / (4 ∙ 0,031) = 285 кДж.
Qэкз.восст. = 19 728 + 83 146 + 5 581 + 285 = 108 740 кДж.
3. Тепло металлообразования Qэкз.мет. складывается в основном из реакций образования в сплаве карбидов и силицидов (остальным пренебрегаем). Принимаем, что весь углерод в ферромарганце связан только с марганцем и присутствует в виде Mn23C6. Образование карбида марганца происходит по реакции
23Mn + 6C =Mn23C6 ΔH = - 252,0 кДж/моль.
Также принимаем, что весь кремний в ферромарганце связан только с железом и присутствует в виде FeSi. Образование силицида железа происходит по реакции
Fe + Si = FeSi ΔH = - 73,70 кДж/моль.
При растворении 0,337 кг углерода в ферромарганце выделится тепла
Q1 = 0,337 · 290,0 / (6 · 0,012) = 1 281 кДж.
При растворении 0,337 кг кремния в ферромарганце выделится тепла
Q2 = 0,337 · 73,70 / 0,028 = 887 кДж.
Таким образом, Qэкз.мет. = 1 281 + 887 = 1 719 кДж.
4. Тепло шлакообразования Qэкз.шл складывается в основном из реакций образования в шлаке двухкальциевого силиката и тефроита (остальным пренебрегаем ). Принимаем, что весь оксид марганца в шлаке связан только с кремнеземом и присутствует в тефроита MnO·SiO2. Образование тефроита из оксидов происходит по реакции
MnO + SiO2 = MnO·SiO2 ΔH = -1320,87 + 911,55 + 385,186 = - 24,134 кДж/моль.
При образовании тефроита из 34,010 кг оксида марганца выделится тепла
Q1 = 34,010 · 24,134 / 0,071 = 11 561 кДж.
Также принимаем, что весь кремнезем связан с оксидом кальция и присутствует в шлаке в виде ларнита 2CaO·SiO2. Образование ларнита происходит по реакции
2СаO + SiO2 = 2СаO∙SiO2 ΔH =-2308,98 + 2·635,6+ 911,55 = -126,23 кДж/моль.
41,279 кг кремнезема связывается в ларнит, при этом выделится тепла
Q2 = 41,279 · 126,23 / 0,060 = 86 844 кДж.
Таким образом, при шлакообразовании выделится тепла
Qэкз.шл = 11 561 + 86 844 = 98 405 кДж.
Qэкз. = 18 293 + 108 740 + 2 168 + 98 405 = 227 606 кДж.
3.2 Расход тепла
3.2.1 Теплосодержание сплава при температуре выпуска
Теплосодержание сплава определяется теплоемкостью, температурой и массой сплава (на основе материального баланса) при нагреве сплава до температуры плавления, теплотой плавления и перегрева жидкого сплава до температуры выпуска из печи (табл. 9).
Для стандартных сплавов величину теплосодержания сплава следует считать по экспериментально определенным постоянным теплофизическим величинам согласно нижеприведенной формуле
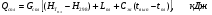
Таблица 9 – Теплофизические свойства ферромарганца марки ФМн90
| Температура плавления, tпл, °С | Энтальпия при Тпл, 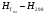 , кДж/кг , кДж/кг | Теплота плавления, Lпл, кДж/кг | Теплоемкость жидкого, Сж, кДж/кг | Температура сплава на выпуске, °С |
| 1260 | 695 | 267,0 | 0,826 | 1540-1560 |
Используя данные, приведенные в таблице 9 рассчитаем теплосодержание низкоуглеродистого ферромарганца марки ФМн90 при температуре выпуска 1550°С:
Qспл = 53,430 ∙ [695 + 267,0 + 0,826 ∙ (1550 – 1260)] = 64 198 кДж
3.2.2 Теплосодержание шлака при температуре выпуска
Температура шлака на выпуске при выплавке низкоуглеродистого ферромарганца, как и любого другого сплава, находится на 50-80°С выше аналогичной температуры для сплавов, т.е. на уровне 1630°С.
Теплосодержание шлака при отсутствии экспериментальных данных можно оценить аддитивно, но основным (трем-четырем) составляющим компонентам по справочным данным согласно нижеприведенной формуле:
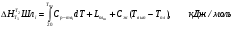
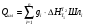
Однако температуры плавления большинства оксидов, составляющих шлак, намного выше температуры плавления самого шлака. Поэтому, строго говоря, оксиды не плавятся, образуя шлак, а растворяются. Однако однотипность физических процессов лежащих в основе плавления и растворения, позволяет уравнять изменения энтальпии в этих процессах
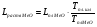
Таким образом, задаваясь нижеприведенным справочными данным, рассчитаем теплосодержание шлака при температуре 1790°С для основных составляющих шлака (MgO, SiO2, Al2O3, Cr2O3, CaO), сумма которых превышает 99% от общей массы.
Таблица 10 – Теплофизические величины основных компонентов шлака и газа
| Элемент | 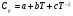 , Дж/моль∙К , Дж/моль∙К | Энтальпия плавления, кДж/моль | Температура плавления, К | Теплоемкость в жидком состоянии, Дж/моль∙К | ||
| a | b∙103 | c∙10-5 | ||||
| Al2O3 | 114,84 | 12,81 | -35,46 | 113,04 | 2326 | 144,96 |
| SiO2 | 46,98 | 34,33 | -11,3 | 0,63 | 0-848 | - |
| 60,33 | 8,12 | 0 | 7,70 | 848-1996 | 85,82 | |
| MgO | 42,62 | 7,28 | -6,2 | 77,46 | 3098 | 84,0 |
| MnO | 46,51 | 8,12 | -3,68 | 43,9 | 2058 | 63,48 |
| СаО | 105,37 | 11,953 | -18,979 | 80,0 | 3172 | 84,0 |
| СО2 | 44,17 | 9,04 | -8,54 | - | - | - |
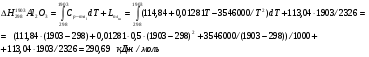
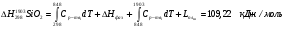
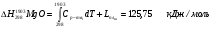
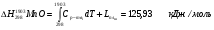
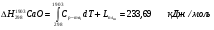
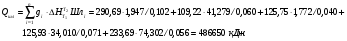
3.2.3 Теплосодержание газообразных продуктов
Допустим, что газы покидают печь при средней температуре 450°С. Для упрощения расчетов принимаем теплоемкости всех газообразных продуктов равными теплоемкости окиси углерода CO2 основной составляющей газообразной фазы, образующуюся при разложении карбоната кальция в извести.
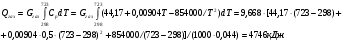
3.2.4 Тепло эндотермических реакций
Тепло диссоциацию карбонатов, испарение влаги и т.д. подсчитывают по энтальпии реакции и их массе
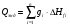
CаСО3 = CаО + СО2 ΔН = – 635,6 – 393,51 + 1207,0 = 177,89 кДж/моль
Qэнд = 0,825 · 177,89 / 0,044 = 3 337 кДж.
3.2.5 Потери тепла
По экспериментальным данным тепловые потери через футеровку, излучением колошника, теплопроводностью через электроды, охлаждающей водой и т.д. при выплавке низкоуглеродистого ферромарганца составляют 20,4% (табл. 11) от общего расхода тепла. Величина тепловых потерь в электропечной силикотермической плавке может быть оценена по выражению
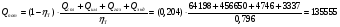 кДж
кДжОбщий расход тепла будет равен:
Q1-4 =64 198 + 456 650 + 4 746 + 3 337 + 135 555 = 664 484 кДж.
