Резакова ,вариант 4,21.12.20. Вариант 4. Способы очистки биологически активных веществ (бав) растительного, животного происхождения, полученных на основе биосинтеза
 Скачать 398.6 Kb. Скачать 398.6 Kb.
|
|
Вариант №4. *Способы очистки биологически активных веществ (БАВ) растительного, животного происхождения, полученных на основе биосинтеза. *Гидрофобная хроматография. Аффинная хроматография. Электрофорез. Гидрофобная хроматография Метод гидрофобной хроматографии используют для разделения БАВ на основе гидрофобных свойств, характерных для биологических объектов. В основе механизма селективности при гидрофобной хроматографии лежит проявление так называемого гидрофобного эффекта, а также модуляция электровалентных взаимодействий, вследствие понижения локальной диэлектрической постоянной среды при введении неполярных радикалов иди понижении активности растворителя. Гидрофобная хроматография реализуется в виде нескольких различных процессов. В наиболее часто встречаемом варианте сорбция амфильных соединений гидрофобными сорбентами осуществляется из разбавленных водных растворов при низких значениях рН (2,0-4,0), а элюация – путем снижения так называемой элюатропной силы подвижной фазы, достигаемой изменением рН, уменьшением полярности элюента (при добавлении спиртов, детергентов и других органических модификаторов). Этот вид хроматографии получил название обратнофазной хроматографии (ОФХ). При введении в раствор амфильных соединений, способных вступать во взаимодействие с разделяемыми менее гидрофобными компонентами, последние все же можно разделить. Таким методом на неполярных сорбентах удается разделить даже ионизированные соединения, если добавить в раствор противоположно заряженные амфильные соединения, способные образовывать ионные пары с изучаемыми компонентами. Этот вид хроматографии был назван ионпарной обратнофазной хроматографией. Гидрофобное взаимодействие реализуется также и при так называемой высаливающей хроматографии (ВХ), часто называемой хроматографией гидрофобных взаимодействий, основной прием которой заключается в сорбции амфильных соединений из водных растворов при большой концентрации солей с последующей элюацией солевыми растворами с более низкой ионной силой или водой. Иногда элюацию осуществляют таким образом, что одновременно с уменьшением концентрации соли повышают концентрацию гидрофобного вытеснителя. Как в обратнофазной, так и высаливающей хроматографии могут использоваться одни и те же типы сорбентов с пришитыми неполярными радикалами. При приведении гидрофобной технологии следует учитывать физикохимические параметры сорбентов: пористость, удельную поверхность, гидрофильные и гидрофобные свойства, химическую стабильность, инертность, проницаемость. Всем этим требованиям отвечают обратнофазные гидрофобные сорбенты и макропористые гетерогенные полимерные сорбенты типа солоза К 30/40, К 20/40, К 10/40, КГ 8/40, гидрофобные свойства которых выражены более слабо, чем у обратнофазных сорбентов. Поверхность кремнеземных сорбентов содержит большое число силанольных (SiOH) и силоксановых групп (Si–O–Si), а также небольшое количество примесей оксидов металлов. Наибольшей химической однородностью обладают аэросилогели (силохромы), получаемые спеканием частиц непористого высокодисперсного диоксида кремния – аэросила. Различные модификации методов ОФХ широко используют для очистки пептидов, таких как окситоцин, липрессин, пептидного гормона роста – соматотропина, пептидных антибиотиков, лейкоцитарного интерферона, для разделения высокомолекулярных белков (химотрипсиногена, ферритина и др.). Использование гидрофобной хроматографии удобно и при работе с высококонцентрированными растворами. Так раствор аммония сульфата в концентрациях несколько ниже необходимых для высаливания белка способствует связыванию белков с гидрофобными гелями. Высокая концентрация соли снижает растворимость белков и увеличивает их способность взаимодействовать с неполярной поверхностью сорбента. Фракционирование связанных белков часто достигается понижением полярности элюента (например, с помощью полиэтиленгликоля). При подборе условий разделения смеси белков при ОФХ обязательно учитывают рН раствора, вязкость и температуру. [3, с. 563] : Гидрофобные лиганды (Рис. 1), используемые в гидрофобной хроматографии: 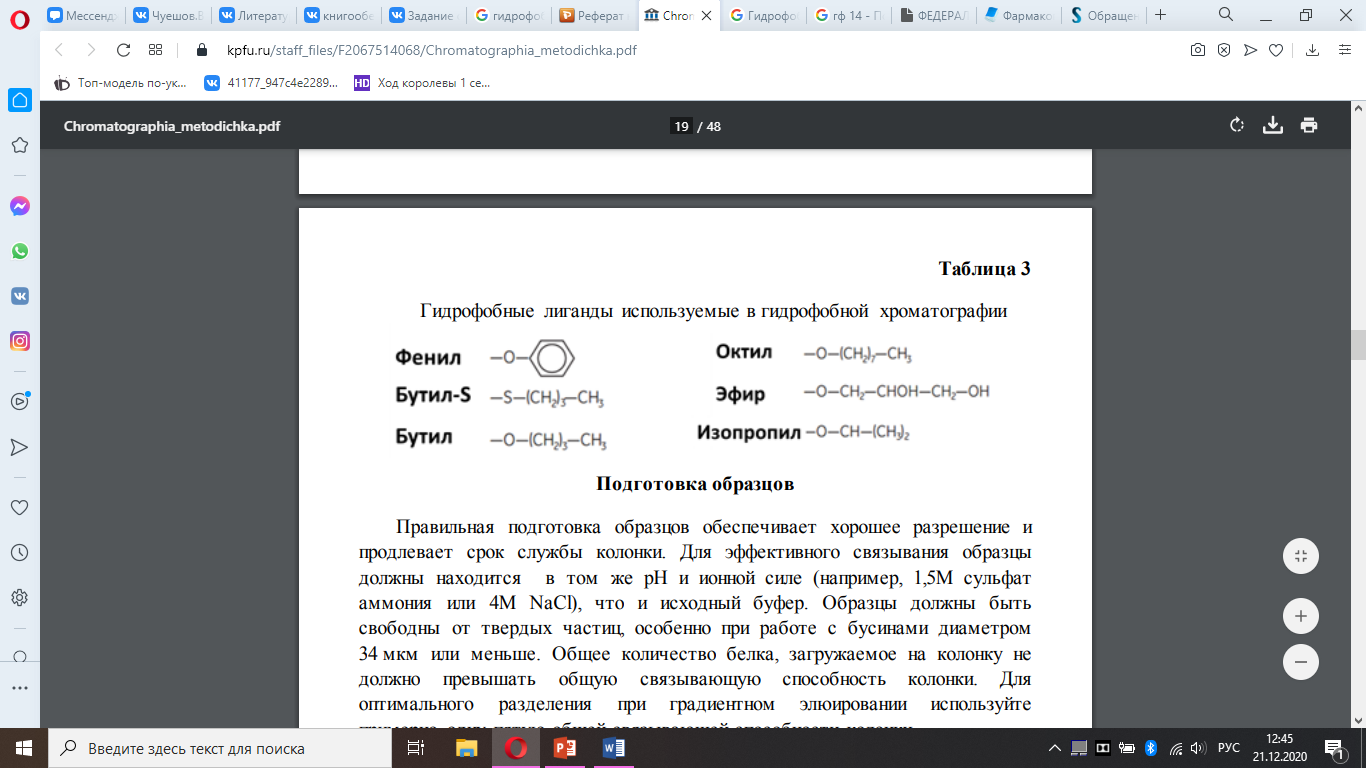 Аффинная хроматография Интересным хроматографическим методом является аффинная хроматография, основанная на нативной специфичности некоторых биополимеров, особенно если они содержатся в извлечении в небольших концентрациях – менее 1 мкг/мл. [3, с. 565] Аффинная хроматография является разновидностью метода хроматографии по механизму разделения, основанному на высокоспецифичном взаимодействии между веществом. [1] Между аффинной хроматографией и другими более традиционными методами адсорбционной или ионообменной хроматографии существуют значительные различия. В традиционных хроматографических методах сначала адсорбируются все компоненты смеси, а их разделение осуществляется на стадии десорбции посредством, например, замены концентрации элюента, или концентрации солей в элюенте, или постепенного повышения рН элюента. Специфичность аффинной хроматографии определяется в основном на стадии сорбции (рис. 2). Поэтому при аффинной хроматографии через колонку целесообразно пропускать раствор разделяемой смеси в течение длительного промежутка времени, пока не будет достигнуто насыщение неподвижной фазы, так как только в ней адсорбируются выделяемые соединения. Таким образом, проведение разделения БАВ аффинной хроматографией приближается к обычной сорбции в неподвижном слое вплоть до насыщения слоя адсорбента и резко отличается от обычного разделения многокомпонентной смеси, вводимой в колонку однократно в виде концентрированного раствора. В этом методе хорошее разделение достигается за счет специфического взаимодействия между иммобилизованным агентом и растворенным веществом.  Рис. 2. Схематическое представление аффинной хроматографии: а – ввод смеси веществ; б – разделение; в – элюирование связанного с неподвижной фазой компонента смеси. Сорбентами для аффинной хромагографии, в основном, являются полимеры, используемые для гельпроникающей хроматографии, после целенаправленной модификации (агарозы, полиакриламиды, целлюлозы, пористые стекла). При выборе исходного сорбента приходится уделять внимание сокращению размеров доступных областей в порах после введения в них протяженных аффинатов. Поэтому матрицы для биоспецифической хроматографии с объемными аффинатами должны иметь диаметры пор, превышающие в 3-5 раз сумму хроматографических диаметров макромолекул комплексов антиген-антитело, белок-ингибитор и т.д. Матрицей может быть любой полимер, в той или иной степени удовлетворяющий следующим требованиям: – крупнопористость гелевой структуры; – гидрофильность, обеспечивающая хорошее взаимодействие ее с водой и отсутствие неспецифического связывания белков по гидрофобным центрам; – отсутствие в структуре заряженных групп; – способность полимера легко активироваться определенными химическими агентами. Указанным требованиям отвечают синтетические полимеры – полиакриламиды, сфероны, а также крупнопористое стекло и силикагели. Направленный синтез биоспецифических сорбентов и выбор режимов афинной хроматографии позволяет добиться таких высоких степеней очистки БАВ, которые недостижимы для других хроматографических приемов. За одну стадию степень очистки может достигать 10² -10³ раз. [3, с. 566]  Электрофорез Электрофорез - метод анализа, основанный на способности заряженных частиц, растворенных или диспергированных в электролите, перемещаться под действием внешнего электрического поля. Различие физико-химических свойств заряженных частиц (размер, форма, величина заряда), а также влияние факторов электролитической среды (напряженность электрического поля, природа среды, вязкость электролита, pH, температура среды, а также продолжительность электрофореза) обусловливают различие скоростей перемещения частиц и, следовательно, обеспечивают их разделение. При электрофорезе на твердых носителях на подвижность и эффективность разделения дополнительное влияние оказывают: адсорбция, неоднородность вещества носителя и его ионообменные свойства, размер пор, электроосмос и капиллярный эффект. [2] Электрофорезом называют разделение БАВ благодаря различной скорости их перемещения в электрическом поле. Постоянная скорость Ue достигается частицей с зарядом q, в жидкой среде под влиянием электрического поля с напряженностью Е, определяется балансом. Для глобулярных белков можно использовать закон Стокса в применении к сопротивлению сферы радиуса rp, движущийся в ньютоновской жидкости с вязкостью µc. 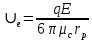 Поскольку в общем случае каждый белок имеет свой собственный, только ему результирующий заряд, то наложение электрического поля приводит к тому, что разные белки движутся с разными скоростями. Таким путем смесь нескольких белков можно разделить на индивидуальные компоненты. Посредством изменения рН можно регулировать электрофоретическую подвижность белка. Если pl данного белка меньше рН среды, то его заряд и скорость будут отрицательными. Напротив, белки с pl > рН будут двигаться в положительном направлении. Этот принцип положен в основу одного из методов определения pl белков и других веществ; в градиенте рН pl белка равна рН, при котором его электрофоретическая подвижность Ue равна нулю. В методе электрофореза в потоке жидкая фаза двигается перпендикулярно направлению электрического поля, что позволяет осуществлять непрерывное разделение. При электрофорезе в геле на движение молекул БАВ влияют процессы адсорбции и десорбции, а также сопротивление диффузии. [3, с. 567] Список литературы: Технология лекарств промышленного производства: учебник для студ. высш. учебн. завед.: перевод с укр.: в 2 ч. Ч.1; перевод с укр. яз. / [В. И. Чуешов, Е. В. Гладух, И. В. Сайко и др.]. – Винница: Нова Книга, 2014. – 696 с.: ил. Государственная Фармакопея РФ XIV издание, Том I, ОФС.1.2.1.0009.18 «Аффинная хроматография». Государственная Фармакопея РФ XIV издание, Том I, ОФС.1.4.1.0021.15 «Электрофорез». |
