Термодинамическое моделирование получения чистых металлов из газовой фазы методом химических транспортных реакций.. Термодинамическое моделирование получения чистых металлов из газ. Вариант 9 Be, I, I2
 Скачать 491.47 Kb. Скачать 491.47 Kb.
|
|
Вариант 9: Be, I, I2 С помощью программы HSC были получены математические модели взаимодействия данных веществ при различных температурах. По этим данным были построены графики зависимости количества веществ в системе от температуры. Исходные данные: 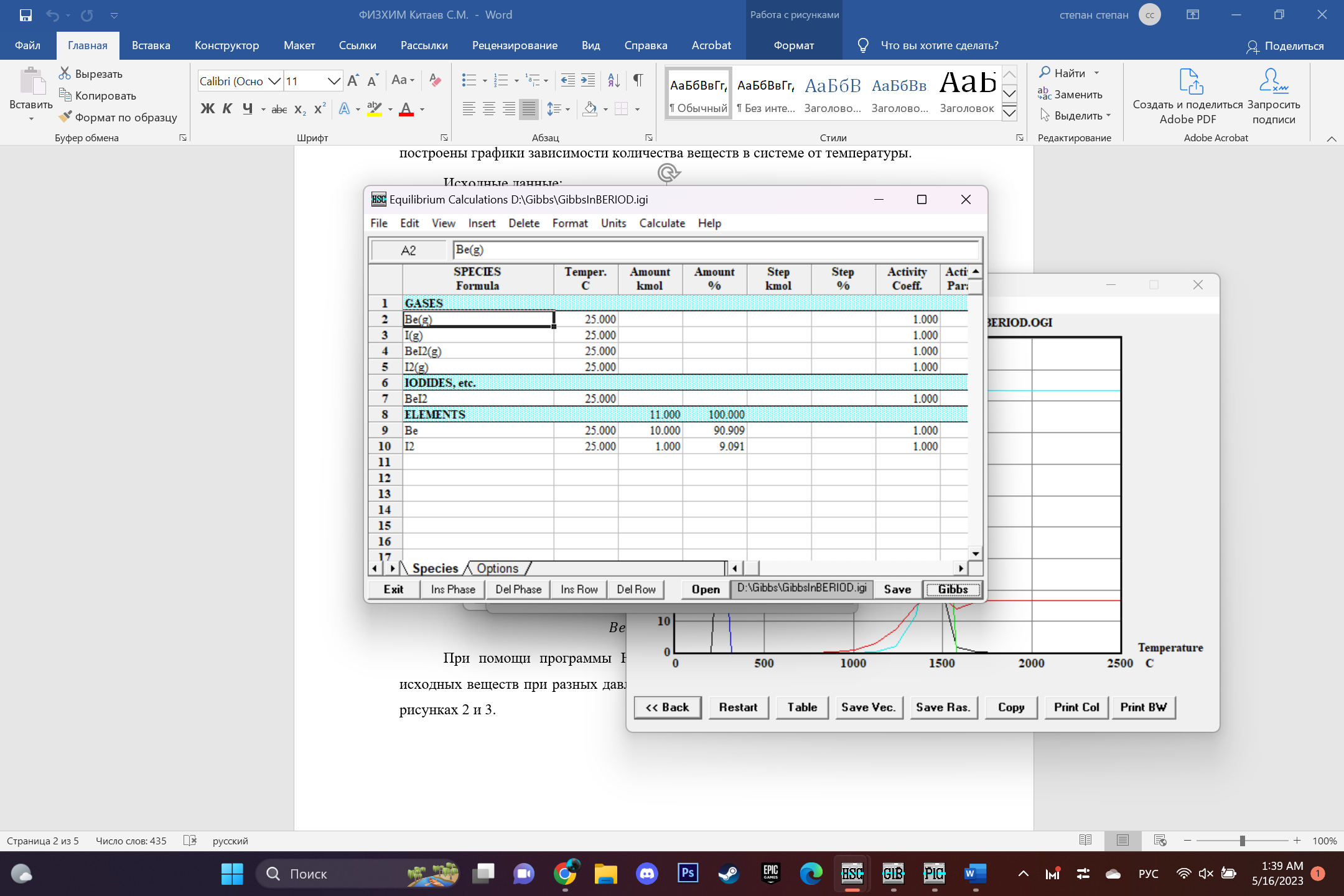 Рис.1 В системе Be-I возможны следующие реакции: 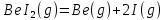 При помощи программы HSC построим зависимости количества продуктов и исходных веществ при разных давлениях. Графики для данной системы представлены на рисунках 2 и 3.  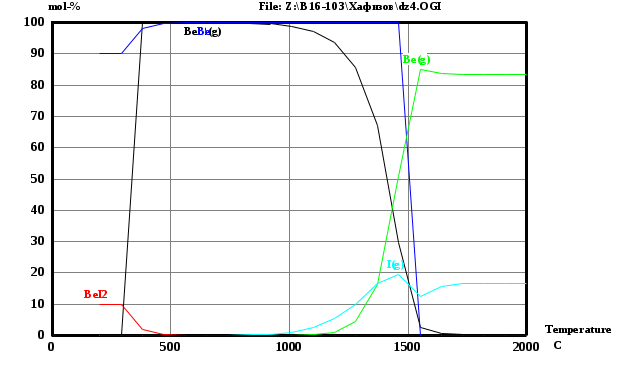 Рис.2 Реакции при Р=0.001 атм.  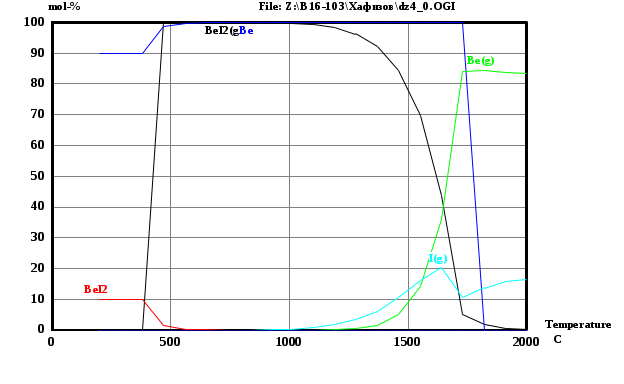 Рис.3 Реакции при Р=0.01 атм. Добавим в систему «загрязняющий компонент» - 1 моль железа.  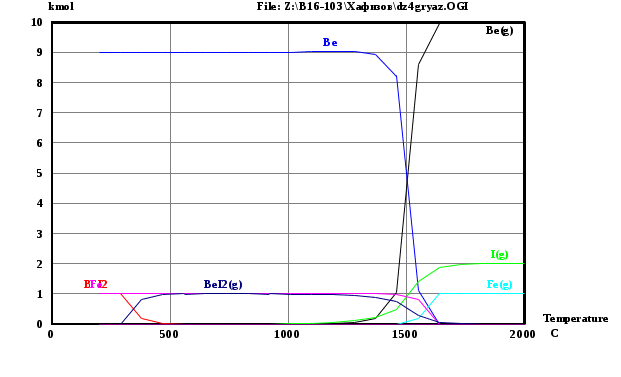 Рисунок 4 Реакции при Р=0.001 атм.  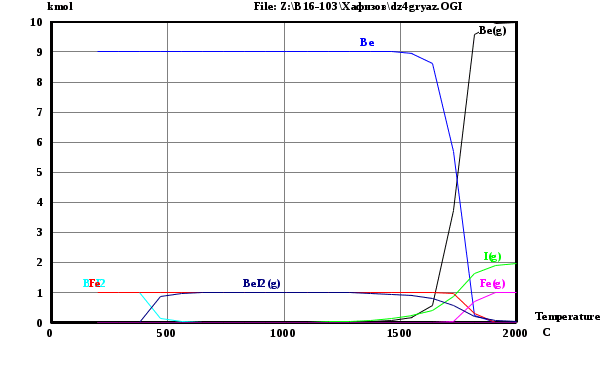 Рисунок 5 Реакции при Р=0.01 атм. Заключение В ходе работы был изучен процесс получения чистых металлов из газовой фазы методом химических транспортных реакций. Был составлен перечень веществ, используемых в данном задании – рисунок 1, и была определена химическая реакция. При помощи программы HSC были рассчитаны мольные доли галогенидов в зависимости от температуры. Полученные данные выведены в таблицах 1 и 2. Результат расчета равновесного состава газовой фазы при различных суммарных давлении в системе приведены на рисунке. Из рисунка 2 можно понять, что химическая газотранспортная реакция начинается примерно при 1000 °С, а проходит при оптимальных скоростях при 1400°С. Также из этого рисунка видно, что соединение BeI2 находится в конденсированном состоянии при температурах ниже 500°С, а в остальных случаях – в газообразном. При этой температуре начинают выделяться газообразный йод и бериллий. При более высоком давлении (увеличенным в 10 раз) реакция происходит уже при 1700 °С, что обуславливается затруднением испарения компонентов при высоких давлениях. Из-за этого, в промышленности эта реакция реализуется преимущественно при р=0.001 атм. При добавлении в систему «загрязняющего компонента» - 1 моль железа исходя из рисунка 4 видно, что химическая транспортная реакции начинаются при температуре 1500°С. При этих реакциях начинают появляться Fe, Be и I2 в газообразных состояниях. Из графика видно, что железо в интервале температур 0-2000°С никак не взаимодействует с газом, а значит не влияет на ход транспортной реакции и всегда остается в исходном металле. При увеличении давления в 10 раз газотранспортная реакция начинает проявляться при более высоких температурах: 1750°С, что продемонстрировано на рисунке 5. Исходя и этого можно сделать вывод, что транспортная реакция бериллия возможна, но протекает с небольшой скоростью. Также была рассмотрена система с йодидом хрома. По графикам было определено, что у данного соединения слишком высокая температура разложения и в результате получается неверная термодинамика. Вследствие этого, мы не стали делать термодинамическое моделирование данного соединения. |
