Лабораторная работа по химии на тему _Бериллий, магний, щелочноз. Цель работы изучение химических свойств металлов iia группы и их соединений формирование навыков выполнения химического эксперимента. Опыт Получение и свойства гидроксида бериллия
 Скачать 71.42 Kb. Скачать 71.42 Kb.
|
|
Лабораторная работа Бериллий, магний, щелочноземельные металлы и их соединения. Цель работы: изучение химических свойств металлов IIA группы и их соединений; формирование навыков выполнения химического эксперимента. Опыт 1. Получение и свойства гидроксида бериллия.  В пробирку поместили 2 мл. нитрата бериллия и по каплям добавили раствор гидроксида натрия. При этом наблюдалось образование белого аморфного осадка гидроксида бериллия. В пробирку поместили 2 мл. нитрата бериллия и по каплям добавили раствор гидроксида натрия. При этом наблюдалось образование белого аморфного осадка гидроксида бериллия.Be(NO3)2 + 2NaOH = 2NaNO3 + Be(OH)2 Be2+ + 2NO-3 + 2Na+ + 2OH- = 2Na+ + 2NO-3 + Be(OH)2 Be2+ + 2OH- = Be(OH)2 Полученный осадок разделили на две части. К первой части осадка (гидроксида бериллия) прилили раствор соляной кислоты. Наблюдалось растворение осадка. Be(OH)2 + 2HClразб.= BeCl2 + 2H2O Be(OH)2 + 2H+ + 2Cl- = Be2+ + 2Cl- + 2H2O Be(OH)2 + 2H+ + 2Cl- = Be2+ + 2Cl- + 2H2O Ко второй части осадка (гидроксида бериллия) добавили избыток концентрированного раствора гидроксида натрия. Наблюдалось растворение осадка. Be(OH)2 + 2NaOHконц.= Na2[Be(OH)4] Be2+ + 2OH- + 2Na+ + 2OH- = 2Na+ + [Be(OH)4]2- Be2+ + 4OH- = [Be(OH)4]2- В данном опыте гидроксид бериллия взаимодействует и с кислотой, и с щелочью, это позволяет сказать, что гидроксид бериллия проявляет амфотерные свойства. Опыт 2. Гидролиз солей бериллия. В пробирку поместили 2 мл. раствора хлорида бериллия. Добавили несколько капель лакмуса, после чего жидкость к пробирке приобрела красный цвет. Это указывает на кислый характер среды раствора в пробирке. Можно сказать, что хлорид бериллия гидролизуется по катиону, так как соль образована сильной кислотой и слабым основанием. Первая стадия гидролиза.   BeCl2 + H2O BeOHCl + HCl BeCl2 + H2O BeOHCl + HCl  Be2+ + 2Cl- + H2O BeOH+ + Cl- + H+ + Cl- Be2+ + 2Cl- + H2O BeOH+ + Cl- + H+ + Cl-  Be2+ + H2O BeOH+ + H+ Be2+ + H2O BeOH+ + H+Вторая стадия гидролиза.   BeOHCl + H2O Be(OH)2 + HCl BeOHCl + H2O Be(OH)2 + HCl  BeOH+ + Cl- + H2O Be(OH)2 + H+ + Cl- BeOH+ + Cl- + H2O Be(OH)2 + H+ + Cl-  BeOH+ + H2O Be(OH)2 + H+ BeOH+ + H2O Be(OH)2 + H+Запись второй стадии гидролиза при рассмотрении данного опыта условна, так как гидролиз хлорида бериллия проходит только до первой ступени. Объяснить это можно тем, что уже на первой ступени гидролиза образуется хлорид гидроксобериллия. BeOH+ при этом частично полимеризуется, что ведет к прекращению гидролиза. Опыт 3. Восстановительные свойства металлического магния. А) Взаимодействие магния с водой. Кусочек магниевой ленты был очищен с помощью наждачной бумаги и помещен в пробирку с дистиллированной водой. При этом видимые признаки реакции отсутствовали.  Пробирку с дистиллированной водой и магниевой лентой начали нагревать на пламени спиртовки. При этом наблюдалось растворение выделение бесцветного газа. Реакция проходила достаточно медленно. В пробирку был добавлен фенолфталеин. После этого жидкость приобрела малиновый цвет. Это говорит о щелочном характере среды полученного раствора. Пробирку с дистиллированной водой и магниевой лентой начали нагревать на пламени спиртовки. При этом наблюдалось растворение выделение бесцветного газа. Реакция проходила достаточно медленно. В пробирку был добавлен фенолфталеин. После этого жидкость приобрела малиновый цвет. Это говорит о щелочном характере среды полученного раствора.Mg + 2H2O = Mg(OH)2 + H2 Mg0 - 2e = Mg+2 2 1; Mg0 – восстановитель; 2H+ + 2e = H20 1; H+ - окислитель; Взаимодействие магния с водой происходит при повышенной температуре. б) Взаимодействие магния с кислотами. Теоретический вывод о возможности протекания реакции магния с серной с соляной кислотами можно сделать, используя значения стандартных электродных потенциалов элементов, возможность взаимодействия которых необходимо установить. Так, стандартный электродный потенциал магния: ϕ0(Mg2+ / Mgтв.) = -2,34 В. Стандартный электродный потенциал водорода: ϕ0(2H+ / H2) = 0,00 В. Возможность протекания окислительно-восстановительной реакции в данном направлении определяет положительной значение Э.Д.С., которое может быть вычислено по формуле: Э.Д.С. = ϕ(окислителя) – ϕ(восстановителя). ϕ0(Mg2+ / Mgтв.) = -2,34 В. ϕ0(2H+ / H2) = 0,00 В. Э.Д.С. = 0 + 2,34 = 2,34 В. Э.Д.С. > 0 – магний может взаимодействовать с раствором соляной кислоты и разбавленным раствором серной кислоты с выделением молекулярного водорода. Вывод, сделанный теоретически, подтверждает опыт. В две пробирки поместили 2 мл. растворов серной и соляной кислот. В каждую пробирку добавили по кусочку магниевой стружки. В обеих пробирках наблюдалось выделение бесцветного газа, в пробирке с серной кислотой реакция проходила более бурно.  Mg + H2SO(разб.) = MgSO4 + H2 Mg + H2SO(разб.) = MgSO4 + H2 Mg0 - 2e = Mg+2 2 1; Mg+2 – восстановитель; 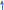 2H+ + 2e = H20 1; H+ - окислитель; 2H+ + 2e = H20 1; H+ - окислитель;Mg + 2HCl + 4H2O = [Mg(H2O)4]Cl2 + H2 Mg0 - 2e = Mg+2 2 1; Mg+2 – восстановитель; 2H+ + 2e = H20 1; H+ - окислитель; На основе значений стандартных электродных потенциалов определим возможность протекания реакции магния с концентрированной серной кислотой. ϕ0(Mg2+ / Mgтв.) = -2,34 В. ϕ0(SO4. / H2SO3) = +0,20 В. Э.Д.С. = 0,2 + 2,34 = 2,54 В. Э.Д.С. > 0 – магний может взаимодействовать с концентрированной серной кислотой с образованием неустойчивой сернистой кислоты. ϕ0(Mg2+ / Mgтв.) = -2,34 В. ϕ0(SO2-4 / S) = +0,357 В. Э.Д.С. = 0,357 + 2,34 = 2,697 В. Э.Д.С. > 0 – магний может восстанавливать концентрированную серную кислоту до молекулярной серы. ϕ0(Mg2+ / Mgтв.) = -2,34 В. ϕ0(SO2-4 / H2S) = +0,311 В. Э.Д.С. = 0,311 + 2,34 = 2,651 В. Э.Д.С. > 0 – магний может восстанавливать концентрированную серную кислоту до сероводорода. На основании этих расчетов можно сделать вывод, что магний может восстанавливать концентрированную серную кислоту и до сернистой кислоты (диоксида серы), и до молекулярной серы, и до сероводорода. В ходе опыта в пробирку поместили концентрированную серную кислоту и добавили кусочек магниевой стружки. Наблюдалось выделение бесцветного газа с характерным запахом разлагающегося белка. Реакция проводилась в вытяжном шкафу. 4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S + 4H2O Mg0 – 2e = Mg+2 8 4; Mg0 – восстановитель; S+6O4 + 10H+ + 8e = H2S-2 + 4H2O 1; S+6 – окислитель; 4Mg + SO2-4 + 10H+ = 4Mg2+ + H2S + 4H2O Mg + 5H2SO4(конц.) = 4MgSO4 + H2S + 4H2O Опыт 4. Получение и свойства гидроксида магния. В три пробирки налили по 2 мл. раствора нитрата магния, после чего в каждую пробирку налили по каплям раствор гидроксида натрия. Наблюдалось образование белого студенистого осадка. 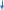 Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3 Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3Mg2+ + 2NO-3 + 2Na+ + 2OH- = Mg(OH)2 + 2Na+ + 2NO-3 Mg2+ + 2OH- = Mg(OH)2 В одну пробирку налили раствор соляной кислоты. При этом наблюдалось растворение осадка. Mg(OH)2 + 2HCl = MgCl2 + 2H2O Mg(OH)2 + 2H+ + 2Cl- = Mg2+ +2Cl- + 2H2O Mg(OH)2 + 2H+ = Mg2+ + 2H2O В другую пробирку налили раствор хлорида аммония. При этом наблюдалось растворение осадка. Mg(OH)2 + 2NH4Cl = MgCl2 + 2NH4OH Mg(OH)2 + 2NH+4 + 2Cl- = Mg2+ +2Cl- + 2NH4OH Mg(OH)2 + 2NH+4 = Mg2+ + 2NH4OH В третью пробирку налили избыток раствора гидроксида натрия. При этом наблюдалось растворение осадка. Mg(OH)2 + 2NaOH = Na2[Mg(OH)4] Mg(OH)2 + 2Na+ + 2OH- = 2Na+ + [Mg(OH)4]2- Mg(OH)2 + 2OH- = [Mg(OH)4]2- В данных реакциях гидроксид магния проявляет свойства слабого основания. Реакция с кислотой возможна, потому что ее продукт – вода обладает произведением растворимости меньшим (10-14), чем у гидроксида магния (7,1*10-12). Гидроксид магния взаимодействует с хлоридом аммония, так как образующееся вещество – гидроксид аммония – более слабое основание. Опыт 5. Взаимодействие кальция с водой. В пробирку налили 8 мл. дистиллированной воды и поместили в нее небольшой кусочек металлического кальция. Наблюдалось выделение бесцветного газа и последующее помутнение раствора. Газ был собран в пробирку, после чего в ее горлышко была внесена тлеющая лучинка, был слышен глухой хлопок, что говорит о том, что выделяющийся газ – водород. Помутнение раствора происходит потому, что образующийся гидроксид кальция – малорастворимое основание. Стронций и барий также будут взаимодействовать с водой с образованием водорода и соответствующих оснований, однако помутнения раствора, скорее всего, наблюдаться не будет, так как Sr(OH)2 и Ba(OH)2 представляют собой сильные основания, растворимые в воде лучше, чем гидроксид кальция. После завершения реакции в жидкость в пробирке был добавлен фенолфталеин, после чего она окрасилась в малиновый цвет, что говорит о щелочном характере среды в пробирке. Ca + 2H2O = Ca(OH)2 + H2 Ca0 + 2H2O – 2e = Ca+2 (OH)2 + 2H+ 2 1; Ca0 – восстановитель; 2H+ + 2e = H20 1; H+ - окислитель; Ca + 2H2O + 2H+ = Ca(OH)2 + 2H+ + H2; Ca + 2H2O = Ca(OH)2 + H2. Опыт 6. Получение гидроксидов щелочноземельных металлов. В три пробирки добавили по 2 мл. растворов хлорида кальция, хлорида стронция, хлорида бария. После этого в каждую пробирку добавили раствор гидроксида натрия. Наблюдалось образование осадков, причем в пробирке с хлоридом бария объем образовавшегося осадка был наименьшим (образование осадка происходило в незначительной мере), а в пробирке с хлоридом кальция – наибольшим. Объяснить это можно тем, что сила оснований в ряду Ca(OH)2 – Sr(OH)2 – Ba(OH)2 увеличивается, возрастает и растворимость этих веществ в воде. При этом опытные данные можно доказать теоретически. В одном литре воды при 20 °C растворимо 38 грамм гидроксида бария (m1) (Общая химия: учебное пособие / Н.Л. Глинка.). Масса гидроксида лития, находящегося в жидкости в пробирке, может быть определена следующим путем. Cн =  ; ; n(Ba(OH)2) = Cн(Ba(OH)2)fэ(Ba(OH)2)V(раствора); m(Ba(OH)2) = Cн(Ba(OH)2)fэ(Ba(OH)2)V(раствора)M(Ba(OH)2). При этом объем жидкости составит: 2 + 1 = 3 мл. (2 мл. – объем раствора хлорида бария; 1 мл. – объем раствора гидроксида натрия, найденный из закона эквивалентов: 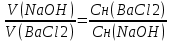 ) )Можно составить пропорцию: 3 - Cн(Ba(OH)2)fэ(Ba(OH)2)V(раствора)M(Ba(OH)2) 1000 – m2 (масса гидроксида бария в 1 литре раствора). m2 = 114 г. Δm = m2 – m1 = 76 г. ε = 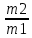 = 3. = 3.В лабораторной работе использовались растворы хлоридов кальция, стронция, бария концентрацией 2н. Максимальное значение растворенного вещества превышено – будет выпадать осадок. Аналогичные вычисления можно провести в отношении гидроксида кальция и гидроксида стронция. m2(Sr(OH)2) = 81 г. m1(Sr(OH)2) = 8 г. Δm = m2 – m1 = 73 г. ε = 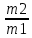 = 10,1. = 10,1.m2(Ca(OH)2) = 49 г. m1(Ca(OH)2) = 1,56 г. Δm = m2 – m1 = 47,44 г. ε = 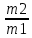 = 31,4. = 31,4.Данные расчеты позволяют сказать, что в ходе всех трех реакций будут выпадать осадки. CaCl2 + 2NaOH = Ca(OH)2 + 2NaCl Ca2+ + 2Cl- + 2Na+ + 2OH- = Ca(OH)2 + 2Na+ + 2Cl- Ca2+ + 2OH- = Ca(OH)2 SrCl2 + 2NaOH = Sr(OH)2 + 2NaCl Sr2+ + 2Cl- + 2Na+ + 2OH- = Sr(OH)2 + 2Na+ + 2Cl- Sr2+ + 2OH- = Sr(OH)2 BaCl2 + 2NaOH = Ba(OH)2 + 2NaCl Ba2+ + 2Cl- + 2Na+ + 2OH- = Ba(OH)2 + 2Na+ + 2Cl- Ba2+ + 2OH- = Ba(OH)2 (образование осадка происходит в незначительной мере). Опыт 7. Получение и свойства солей щелочноземельных металлов. А) Получение и свойства карбонатов щелочноземельных металлов.  Взаимодействием нитратов кальция, стронция и бария с раствором соды в трех пробирках были получены соответствующие карбонаты. В ходе реакции наблюдалось образование белых кристаллических осадков (карбонаты кальция, стронция, бария обладают малой растворимостью в воде) – карбонатов кальция, стронция, бария. Взаимодействием нитратов кальция, стронция и бария с раствором соды в трех пробирках были получены соответствующие карбонаты. В ходе реакции наблюдалось образование белых кристаллических осадков (карбонаты кальция, стронция, бария обладают малой растворимостью в воде) – карбонатов кальция, стронция, бария. Ca(NO3)2 + Na2CO3 = CaCO3 + 2NaNO3 Ca2+ + 2NO-3 + 2Na+ + CO-3 = CaCO3 + 2Na+ + 2NO-3  Ca2+ + CO-3 = CaCO3 Ca2+ + CO-3 = CaCO3Sr(NO3)2 + Na2CO3 = SrCO3 + 2NaNO3 Sr2+ + 2NO-3 + 2Na+ + CO-3 = SrCO3 + 2Na+ + 2NO-3  Sr2+ + CO-3 = SrCO3 Sr2+ + CO-3 = SrCO3Ba(NO3)2 + Na2CO3 = BaCO3 + 2NaNO3 Ba2+ + 2NO-3 + 2Na+ + CO-3 = BaCO3 + 2Na+ + 2NO-3 Ba2+ + CO-3 = BaCO3 В каждую пробирку прилили раствор соляной кислоты. Наблюдалось растворение полученных ранее осадков и выделение бесцветного газа. CaCO3 + 2HCl = CaCl2 + CO2 + H2O CaCO3 + 2H+ + 2Cl- = Ca2+ + 2Cl- + CO2 + H2O CaCO3 + 2H+ = Ca2+ + CO2 + H2O SrCO3 + 2HCl = SrCl2 + CO2 + H2O SrCO3 + 2H+ + 2Cl- = Sr2+ + 2Cl- + CO2 + H2O SrCO3 + 2H+ = Sr2+ + CO2 + H2O BaCO3 + 2HCl = BaCl2 + CO2 + H2O BaCO3 + 2H+ + 2Cl- = Ba2+ + 2Cl- + CO2 + H2O BaCO3 + 2H+ = Ba2+ + CO2 + H2O Теоретически проанализировать растворимость карбонатов кальция, стронция, бария в воде можно, использовав значения произведений растворимостей этих веществ. П.Р. (CaCO3) = 3,8*10-9 П.Р. (SrCO3) = 1,1*10-10 П.Р. (BaCO3) = 4,0*10-10 На основании этих данных можно сделать вывод, что в ряду SrCO3 – BaCO3 – CaCO3 растворимость веществ в воде увеличивается. Б) Получение и свойства сульфатов щелочноземельных металлов. Взаимодействием нитратов кальция, стронция, бария с раствором сульфата натрия в трех пробирках были получены белые кристаллические осадки соответствующих сульфатов.  Ca(NO3)2 + Na2SO4 = CaSO4 + 2NaNO3 Ca2+ + 2NO-3 + 2Na+ + SO2-4 = CaSO4 + 2Na+ + 2NO-3 Ca2+ + SO2-4 = CaSO4  Sr(NO3)2 + Na2SO4 = SrSO4 + 2NaNO3 Sr2+ + 2NO-3 + 2Na+ + SO2-4 = SrSO4 + 2Na+ + 2NO-3 Sr2+ + SO2-4 = SrSO4  Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3 Ba2+ + 2NO-3 + 2Na+ + SO2-4 = BaSO4 + 2Na+ + 2NO-3 Ba2+ + SO2-4 = BaSO4 При этом образование осадка происходило быстрее всего мере в реакции с нитратом бария, медленнее всего – в реакции с сульфатом кальция. Теоретически проанализировать растворимость сульфатов кальция, стронция, бария в воде можно, использовав значения произведений растворимостей этих веществ. П.Р. (CaSO4) = 2,5*10-5 П.Р. (SrSO4) = 3,2*10-7 П.Р. (BaSO4) = 1,1*10-10 На основании этих данных можно сделать вывод, что в ряду BaSO4 – SrSO4 – CaSO4 растворимость веществ в воде увеличивается. Исследовали отношение полученных сульфатов к разбавленным растворам соляной и азотной кислот. Сульфаты бария, стронция и кальция в растворах указанных кислот нерастворимы. Объяснить это можно тем, что продукты такого взаимодействия хорошо растворимы в воде (намного лучше, чем сульфаты кальция, стронция и бария). Опыт 8. Окрашивание пламени солями щелочноземельных металлов. В бесцветное пламя спиртовой горелки внесли нихромовую проволоку, изменения цвета пламени при этом не наблюдалось. Проволока была смочена раствором хлорида кальция и внесена в нижнюю часть пламени спиртовки. При этом пламя приобрело кирпично-красный цвет. Аналогичные действия были проведены в отношении хлоридов стронция и бария. В случае хлорида стронция пламя приобрело карминово-красный цвет, а в случае хлорида бария – желто-зеленый цвет. После каждого опыта проволока промывалась раствором соляной кислоты. |
