цитотоксические. Вещества цитотоксического действия
 Скачать 3.01 Mb. Скачать 3.01 Mb.
|
Механизм токсического действия соединений мышьякаВ 1925 году Фегтлиным было высказано предположение, что токсическое действие соединений трехвалентного мышьяка, сопровождающееся значительным нарушением функций и гибелью клеток различных органов и тканей, обусловлено их способностью к взаимодействию с сульфгидрильными группами биологических молекул. Предпосылкой к этому послужили данные о способности арсенитов взаимодействовать с сероводородом с образованием сульфидов мышьяка:  По мнению автора, основным объектом токсического воздействия в клетках является глутатион, сульфгидрильные группы которого в процессе реакции блокируются:  Было установлено, что предварительное введение глутатиона защищает лабораторных животных от арсеноксида и арсенита натрия, вводимых в смертельных дозах. Теоретически отравление мышьяком может сопровождаться нарушением активности всех SH-содержащих молекул (см. выше). Однако в начале сороковых годов ХХ века Томпсоном и соавторами было показано, что реакции соединений мышьяка, и в частности люизита, с тиоловыми группами протекают двояко. При взаимодействии арсенитов с монотиолами образуются малопрочные, легко гидролизуемые соединения. При взаимодействии же токсикантов с молекулами, в которых две тиоловые группы расположены рядом (в положении 1,2, либо - 1,3) образуются прочные, не поддающиеся гидролизу циклические соединения:  Была высказана гипотеза (Питерс, Томпсон, Стокен), согласно которой токсическое действие различных соединений мышьяка обусловлено главным образом их реакцией с молекулами со смежным расположением SH-групп, в результате чего образуются прочные циклические структуры. В частности, токсиканты активно связывается с липоевой кислотой, являющейся коэнзимом пируватоксидазного ферментного комплекса, регулирующего превращение пировиноградной кислоты (конечного продукта гликолиза) в активную форму уксусной кислоты (ацетил КоА), утилизируемую циклом Кребса. Происходит блокада цикла Кребса и энергообразования. В результате в крови и тканях накапливается пировиноградная кислота, пируват, развивется ацидоз. Блокируется цикл трикарбоновых кислот - нарушаются процессы энергетического обмена в клетках действия). различных органов (в этой связи люизит можно рассматривать и как вещество общеядовитого действия.  липоевая кислота липоевая кислотаВзаимодействием мышьяк содержащих веществ с сульфгидрильными группами можно объяснить и их гипотензивное действие. Так, полагают, что рецепторные структуры для оксида азота, активного регулятора сосудистого тонуса, включают в качестве функционально-значимых элементов SH-группы. В основе расслабляющего действия NO на сосуды лежит его способность образовывать с SH-группами нестабильные нитрозотиолы (период полусуществования комплекса в организме - около 3 - 5 секунд):  Падение артериального давления, наблюдаемое при отравлении соединениями мышьяка, может быть объяснено образованием относительно стойких связей As с SH-группами сосудистых рецепторов оксида азота. Широкое представительство в организме лигандов с высоким сродством к мышьяку и их большая роль в поддержании гомеостаза лежат в основе способности токсикантов действовать практически на все органы и системы, инициируя различные формы токсических процессов. Этим, в частности, можно объяснить развитие не только тяжелых воспалительно-некротических изменений в покровных тканях при непосредственном действии на них токсикантов, но и целый ряд функциональных нарушений со стороны ЦНС, печени, миокарда и т.д., наблюдаемых при отравлении соединениями мышьяка. Способностью взаимодействовать с сульфгидрильными группами молекул и молекулярных комплексов, регулирующих процессы, лежащие в основе клеточного деления, можно объяснить и канцерогенное действие соединений мышьяка (по данным МАИР - мышьяк канцероген для человека). Мероприятия медицинской защиты Специальные санитарно-гигиенические мероприятия: - использование индивидуальных технических средств защиты (средства защиты кожи; средства защиты органов дыхания) в зоне химического заражения; - участие медицинской службы в проведении химической разведки в районе расположения войск, проведение экспертизы воды и продовольствия на зараженность ОВТВ; - запрет на использование воды и продовольствия из непроверенных источников; - обучение личного состава правилам поведения на зараженной местности. Специальные профилактические медицинские мероприятия: - проведение частичной санитарной обработки (использование ИПП) в зоне химического заражения; - проведение санитарной обработки пораженных на передовых этапах медицинской эвакуации. Специальные лечебные мероприятия: - применение антидотов и средств патогенетической и симптоматической терапии состояний, угрожающих жизни, здоровью, дееспособности пораженного, в ходе оказания первой (само-взаимопомощь), доврачебной и первой врачебной (элементы) помощи пострадавшим. - подготовка и проведение эвакуации Медицинские средства защиты Средства, применяемые при отравлениях мышьяк содержащими веществами, представлены препаратами трех групп: 1. Препараты для обезвреживания мышьяка, не всосавшегося во внутренние среды организма, на поверхности кожи, слизистой глаз, в просвете желудочно-кишечного тракта; 2. Лечебные антидоты; 3. Средства симптоматической и патогенетической помощи пострадавшим. Средства для обезвреживания мышьяка на покровных тканях. При попадании капельно-жидкого ОВ на кожу или одежду в первые 5-10 мин производят частичную санитарную обработку с помощью содержимого индивидуального противохимического пакета. Помимо содержимого ИПП, для обезвреживания мышьяка на поверхности кожи могут быть использованы вещества, которые окисляют, хлорируют или приводят к гидролизу его соединения. Дегазирующие свойства окислителей основаны на превращении трехвалентного мышьяка, входящего в состав люизита, в пятивалентный, и снижении, в связи с этим, токсичности образующихся соединений. В качестве окислителей могут быть использованы растворы 5% монохлорамина, 5% марганцовокислого калия в 5% уксусной кислоте, 5-10% раствор йода, 40% гидропирита (перекис мочевины). Для ослабления поражений кожи люизитом в виде мази применяют комплексообраователи из группы дитиолов: 3,5% или 5% мазь 2,3-димеркаптопропанола под названием “дикаптол” или 30% мазь унитиола. При поражении глаз люизитом необходимо промыть глаз водой либо 0,25% раствором хлорамина и ввести в коньюнктивальный мешок на 1 - 2 минуты 30% мазь унитиола (затем глаз опять промыть). При поражении слизистых оболочек дыхательных путей необходимо провести обмывание слизистой растворами 0,05% KMnO4, 0,25 - 1% хлорамина. При попадании соединений мышьяка с зараженной водой или пищей необходимо обильно промыть желудок и пищевод раствором марганцовокислого калия (0,05% раствор). После этого следует назначить внутрь 5 мл 5% раствора унитиола. Специфические противоядия соединений мышьяка Как уже указывалось, Фегтлин и Розенталь еще в начале ХХ века установили защитную роль глутатиона против токсического действия арсеноксида и арсенита натрия. Позже было показано, что защитными свойствами обладают и другие соединения, содержащие одну сульфгидрильную группу (монотиолы): цистин, цистеин, ацетилцистеин, тиоэтиленгликоль, тиогликонат натрия, тиомалоновая кислота и т.д. Однако одновременно отмечалась малая активность монотиолов при лечении мышьяковых и особенно люизитных отравлений. Работами Стокена и Томпсона было показано, что существенно повысить эффективность антидотной терапии можно, используя дитиольные соединения - вещества, образующие прочные циклические комплексы с мышьяком. Из препаратов такого типа весьма эффективным оказался 2,3-димеркаптопропанол, синтезированный в Великобритании в 1941 - 1942 гг и вошедший в медицинскую практику под названием “Британский антилюизит” (БАЛ). Под влиянием БАЛ скорость выведения мышьяка из организма отравленных с мочой увеличивается в 5 - 10 раз, особенно в первый день после воздействия токсиканта. По данным разработчиков терапевтический эффект БАЛ при отравлении люизитом и другими соединениями мышьяка обусловлен его способностью реагировать не только со свободными токсикантами, циркулирующими в крови (химический антагонизм), но и с мышьяком, который уже успел связаться с сульфгидрильными группами в тканях. Вследствие этого БАЛ не только предотвращает токсическое действие яда на биомолекулы, но и восстанавливает их физиологическую активность (биохимический антагонизм):  2,3-Димеркаптопропанол - бесцветная маслянистая жидкость с запахом меркаптана. В воде растворяется плохо (менее 6%), хорошо в органических растворителях. Для практических целей БАЛ рекомендуют применять внутримышечно в виде 5 - 10% раствора в масле из расчета 2 - 3 мг/кг. Отдельные свойства 2,3-димеркаптопропанола понижают его ценность, как средства медицинской защиты. К таковым относятся: высокая токсичность (смертельная доза для крыс - около 200 мг/кг; непереносимая доза для человека, вызывающая тошноту, рвоту, головокружение и т.д. - около 5 мг/кг) и плохая растворимость в воде (и, следовательно, невозможность внутривенного способа введения). Это дало повод для поиска новых средств. В настоящее время в литературе имеется описание большого количества тиоловых соединений, испытанных в качестве антидотов мышьяка. Среди них дитиоэтиленгликоль, 2,3-димеркаптопропилэтиловый эфир, 2,3-димеркаптопропил-глюкозид, 2,3-димеркаптопропиламин, димеркаптосукцинат и т.д. Лишь некоторые из них нашли применение в клинической практике.  Структура некоторых комплексообразователей из групп ди- и монотиолов В нашей стране профессором А.И. Черкесом и соавторами был разработан антидот - 2,3-димеркаптопропансульфонат натрия (унитиол), тоже относящийся к группе дитиолов, лишенный недостатков БАЛ. Это вещество хорошо растворимо в воде. Широта терапевтического действия - 1:20. Унитиол, так же как БАЛ, взаимодействует в крови и тканях отравленного и со свободным люизитом, и с ядом, уже связавшимся с молекулами-мишненями. Комплекс “люизит-унитиол”, называемый тиоарсенитом, малотоксичен, хорошо растворим в воде, и легко выводится из организма с мочой. Под влиянием унитиола у отравленных нормализуется состояние сердечно-сосудистой системы и системы крови: восстанавливается уровень кровяного давления, коллапс и сгущение крови, как правило, не развиваются. Отмечается нормализация биохимических показателей. Лечебная эффективность антидота в известной мере определяется сроками начала лечения. Наилучшие результаты наблюдались при введении вещества в течение первых 0,5 - 1 час после отравления мышьяком. Однако введение унитиола и через 4 - 6 часов после отравления обеспечивает выживание экспериментальных животных, отравленных абсолютно смертельными дозами яда. Унитиол выпускается в ампулах по 5 мл 5% водного раствора. Поскольку, после введения, унитиол определяется в крови в течение лишь 5 часов, при отравлениях соединениями мышьяка, его вводят подкожно или внутримышечно по следующей схеме: в 1-е сутки – по 1 ампуле 4-6 раз с интервалом 4-6 ч; во 2-3-и сутки – по 1 ампуле 2-3 раза с интервалом 8-12 ч; в последующие 4-5-е сутки – по 1 ампуле в сутки. К числу достаточно эффективных препаратов относят димеркаптосукцинат (ДМС). В эксперименте вещество оказалось весьма эффективным при острых интоксикациях As. Препарат является менее токсичными чем БАЛ. Д-пенициламин (группа монотиолов) образует менее прочные комплексы с металлом, чем дитиолы, но в отличии от последних хорошо всасываются в желудочно-кишечном тракте и потому может быть назначен через рот. Необходимо отметить, что применение специфических противоядий (дитиолов) при отравлениях соединениями мышьяка не всегда устраняет симптомы интоксикации. Достаточно резистентными оказываются нарушения со стороны ЦНС, обмена веществ при тяжелых формах отравления, а также в случае применения антидота в поздние периоды интоксикации. Поэтому при оказании медицинской помощи отравленным мышьяксодержащими веществами следует широко использовать и симптоматические средства терапии. Важнейшим направлением оказания помощи является борьба с развивающейся острой сердечно-сосудистой недостаточностью. 3. Токсичные модификаторы пластического обмена К числу модификаторов пластического обмена принадлежат полигалогенированные ароматические углеводороды (ПАУ), среди которых наибольшей биологической активностью обладают диоксин и диоксиноподобные вещества. По степени токсичности ПАУ можно выстроить в следующий ряд: дибензо- пара диоксины-дибензофураны--- бифенилы-нафталены. --- диоксины (соединения, содержащие различное количество атомов галогена, два бензольных кольца, два атома кислорода, называются галогенированными диоксинами): 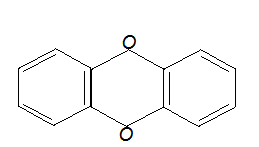 Диоксин Например: 2,3,7,8 тетрахлордибензо парадиоксин; 2,3,6,7 тетрахлордибензо парадиоксин. --- дибензофураны (соединения, содержащие различное количество атомов галогена, два бензольных кольца, один атом кислорода, называются галогенированными бензофуранами): 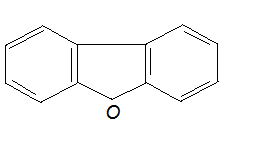 Бензофуран Например: 3,3,7,8 тетрахлор дибензофуран --- бифенилы (соединения, содержание различное количество атомов галогена, два бензольных кольца и не содержащие атома кислорода, называются галогенированными бифенилами): 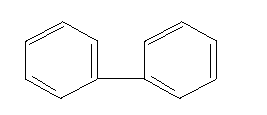 Бифенил Например: 3,3,4,4 тетрахлор бифенил; 2,3,6,7 тетрахлор бифенил 2,3,6,6 - тетрахлорнафтален Диоксины и диоксиноподобные вещества Являются продуктами горения, обладающими цитотоксическимдействием. Механизм образования диоксинов – высокотемпературные процессы хлорирования органических веществ, пиролитическая переработка и сжигание органических соединений. Диоксины обладают наибольшей биологической активностью в классе полигалогенированных ароматических углеводородов. Являются экотоксикантами. Они обладают высокой токсичностью, наибольшей биологической активностью, стойкостью в окружающей среде, способностью к длительной материальной кумуляции в богатых липидами тканях и прежде всего в жировой, характерным своеобразием клинических проявлений интоксикации. Диоксины очень медленно выводятся из организма. Период полувыведения ТХДД из организма человека составляет в среднем - 7 лет. Особенностью токсикокинетики диоксинов является феномен энтерогепетической рециркуляции. После поступления в кровь диоксины распределяются во всех органах и тканях, накапливаясь, как уже было сказано, в жировой ткани. Характерна большя отсроченность токсических эффектов диоксина. Токсикологические характеристики диоксинов и диоксиноподобных соединений зависят от положения атомов хлора в молекуле. Особенно токсичны вещества, содержащие галогены в тех же местах, что и в молекуле 2,3,7,8 – тетрахлордибензо-парадиоксина ( ТХДД) – самого токсичного из диоксинов. Семейство диоксинов очень обширное, токсичность их различна, и человек, сталкиваясь с ними, подвергается воздействию их смесей. Токсичность смесей оценивается по особым системам, где каждому соединению присваивается коэффициент токсичности относительно 2,3,7,8- ТХДД, и общая токсичность смеси выражается в эквивалентном количестве этого соединения (так называемый «диоксиновый эквивалент»). Основная опасность диоксинов заключается не столько в острой токсичности, сколько в кумуляции действия и отдаленных последствиях хронического отравления в малых дозах. В настоящее время место лидера полихлорбифенильных соединений занял диоксин (2,3,6,7 – тетрахлордибензо пара- диоксин): Это белое кристаллическое вещество, с температурой плавления 305,5 градусов С, температурой кипения 800 градусов С, хорошо растворяется в маслах, плохо в воде. Среди 10 млн синтезированных химических соединений диоксин – самое стойкое, его период полураспада – 10 лет. Среди 10 млн химических веществ диоксин – самое токсичное. Расчетная смертельная доза для человека при энтеральном введении равна 3,5 мкг/кг, при загрязнении через кожные покровы – 70 мкг/кг. Диоксин обладает сильнейшим эмбриотоксическим и тератогенным действием. Патогенез Механизм действия диоксина связан с наличием в его структуре четырех и может быть шести алкилирующих групп (четыре атома хлора и две эпоксидные группы в диоксановом кольце). Возможно «сшивание” молекулы нуклеотида в 4-6 точках. Диоксин во многом сходен с классическими алкилирующими агентами - сернистым и азотистым ипритами. Диоксин – один из самых мощных индукторов микросомальных ферментов. А т. к. он долго присутствует в организме, наблюдается стойкая индукция микросомальных энзимов. С этим свойством связывают механизм его токсичесокого действия. Токсическое действие диоксина связано с длительной оккупацией цитозольного Аh-рецептора клеток органов –мишеней (печени, кожи и др.), что сопровождается образованием свободных радикалов, которые активируют перекисное окисление липидов в мембране клеток и субклеточных образований, приводящих к нарушению биохимических и физиологических процессов в различных клетках. Токсическому действию подвергаются: гепатоциты, энтероциты, нервные и эмбриональные клетки. Это обусловливает многообразный характер токсического действия диоксина: токсическое поражение печени, кожи, ЦНС, синдром истощения, угнетения иммунитета и развитие инфекционных осложнений, нарушение репродуктивной функции, тератогенное и канцерогенное действие. Действие диоксинов на человека обусловлено их влиянием на рецепторы клеток, ответственных за работу гормональной системы. Клиника Обычно развивается после латентного периода, длящегося 2-3 недели и очень медленно. Поэтому факт воздействия яда остается незамеченным. Необходимо организовывать тщательное наблюдение за состоянием здоровья людей. Тяжесть поражения делится на три степени.
При не смертельных острых поражениях токсический процесс растягивается на многие месяцы, а иногда и годы. Л.А. Федоров систематизировал признаки поражения диоксином следующим образом: --- кожные эффекты: хлоракне, гиперкератоз, гиперпигментация, гирсутизм, эластоз; --- системные эффекты: фиброз печени, повышение активности трансаминазв сыворотке крови, гиперхолистеринемия, потеря аппетита, потеря массы тела, нарушения пищеварения, боли в мышцах, увеличение лимфатических узлов, нарушения со стороны ССС, выделительной системы, дыхательных путей, поджелудочной железы; --- неврологические эффекты: половая дисфункция, головная боль, неврастения, расстройства зрения, изменения вкуса, обоняния, слуха; --- эффекты в отношении психической сферы: расстройства сна, депрессия. Потеря активности, нехарактерные приступы гнева. Таким образом, на основе клинических и экспериментальных данных можно систематизировать эффекты действия диоксина следующим образом: эмбриотоксические и тератогенные эффекты; имуннотоксические эффекты; патологические изменения эпителиальных и эктодермальных тканей (чешуйчатая метаплазия кератиноцитов, трансформация клеток сальных желез с формированием «хлоракне», гипоплазия и деформация ногтей, кариозный процесс в зубах; поражение эпителия желудочно-кишечного тракта); гепатотоксическое действие; геморрагические проявления; эндокринно-токсические эффекты, нейротропное действие, канцерогенная активность. В настоящее время считается доказанным, что диоксины являются прямыми канцерогенами для человека. Диоксины и диоксиноподобные вещества относятся к веществам первой группы опасности из-за канцерогенности. Профилактика и лечение Учитывая стойкость диоксинов в окружающей среде, необходимо иметь в виду, что проведение дегазационных мероприятий в зонах химического заражения очень затруднено. В подобных случаях проводят демонтаж и захоронение технологического оборудования. Всем членам аварийных бригад выдают 2 комплекта нательного белья с носками, трикотажные перчатки, брюки, противогазы с аэрозольным фильтром, пневмокостюмы (типа ЛГ), в которых предусмотрена подача чистого воздуха. Лечение Первая помощь Надевание противогаза с аэрозольным фильтром или изолирующего противогаза. Удаление пострадавшего из зараженной атмосферы. Доврачебная помощь То же, что и выше, ингаляция кислорода. При попадании препаратов, содержащих диоксин на кожу, необходимо удалить их при помощи марлевого тампона, не втирая, а затем обработать участок кожи проточной водой в течение 15 минут. Первая врачебная помощь Проведение санитарной обработки со сменой белья, обуви и одежды, многократно промыть глаза и закапать в них несколько капель 2% раствора адреналина в новокаине. При попадании диоксина в желудок следует вызвать рвоту, немедленно промыть желудок большим (10-15 л) количеством воды, дать активированный уголь и затем солевое слабительное. Транспортировка на дальнейший этап оказания медицинской помощи в фиксированном боковом положении. Квалифицированная и специализированная медицинская помощь Лечение с помощью симптоматических и некоторых патогенетических средств с учетом ведущих симптомокомплексов в специализ ированных лечебных учреждениях. Профилактика токсической гепатонефропатии: десенсибилизирующие средства, гормоны, интенсивная витаминотерапия (витамины группы В, аскорбиновая кислота, никотиновая кислота, фолиевая и липоевая кислоты, витамин А, эссенциале). Всем членам аварийных бригад, участвующих в ликвидации последствий аварий с выбросом диоксина и диоксиноподобных соединений выдают 2 комплекта нательного хлопчатобумажного белья с носками, трикотажные перчатки, хлопчатобумажные куртки и брюки, костюмы из поливинилхлоридного пластика. Для защиты органов дыхания могут быть использованы любые противогазы с аэрозольным фильтром. Костюмы из пластиката рецептур «80/277» и «80/193» отличаются морозостойстью соответственно до -15 и -25 градусов Цельсия. Изделия из пластиката рецептуры «80 АМ» армированы капроновой сеткой. В пневмокостюмах типа ЛГ предусмотрена подача чистого воздуха. Эти костюмы можно дегазировать не снимая с работника. Комплект «КЗП-1» (куртка, брюки, плащ-халат) на основе пленочных материалов предназначен для защиты при температуре от -20 до 50 градусов Цельсия. Стирка хлопчатобумажных изделий осуществляется в мыльном растворе с применением поверхностно-активных веществ. Средства индивидуальной защиты из пластика по окончании рабочей смены подлежат очистке путем орошения и протирания 5% раствором пищевой соды, тщательному ополаскиванию проточной водой и высушивают. Полихлорированные бифенилы (ПХБ) Полихлорированные бифенилы (ПХБ) это класс синтетических хлорсодержащих полициклических соединений.  Структура одного из изомеров полихлорированных бифенилов Хлор может замещать атомы водорода при любом атоме углерода. На рисунке представлена структура 3,5,3*,5*-тетрахлорбифенила. Теоретически возможно существование 209 изомеров вещества. ПХБ при остром воздействии обладают сравнительно низкой токсичностью. Сравнительное изучение изомеров показывает, что хлорзамещенные в мета- и параположении более токсичны. Средняя смертельная доза колеблется в интервале от 0,5 до 11,3 г/кг в зависимости от строения изомера и вида экспериментального животного. ПХБ широко использовались при производстве электрооборудования, в частности трансформаторов и усилителей, а также в качестве наполнителей при производстве красителей и пестицидов, смазочных материалов для турбин, для производства гидравлических систем, текстиля, бумаги, флуоресцентных ламп, телевизионных приемников и др. Такое широкое использование ПХБ было обусловлено их невысокой термостойкостью, химической стабильностью, диэлектрическими свойствами, что позволяло применять вещества для производства изделий, в которых применение других охлаждающих агентов было сопряжено с высокой опасностью взрывов или воспламенения. В 70-е годы в лабораторных и натурных исследованиях была установлена высокая опасность этих веществ, обусловленная способностью персистировать в окружающей среде и токсичностью для лабораторных животных. В 1979 году производство веществ в США было запрещено. Токсикокинетика В организм ПХБ могут проникать через кожу, легкие и желудочно-кишечный тракт. На производстве основной способ поступления веществ - через кожные покровы, в то время как в повседневной жизни большее количество веществ поступает в организм с контаминированной пищей. Попав в кровь, вещества быстро накапливаются в печени и мышцах, откуда, затем, перераспредляются в жировую ткань. Коэффициент распределения веществ в мозге : печени : жире составляет в среднем - 1 : 3,5 : 81. Среднее содержание ПХБ в сыворотке крови людей, проживающих в “чисты” регионах составляет примерно 7 частей на миллиард, у лиц, профессионально контактирующих с ПХБ - может достигать 3300. ПХБ метаболизируют в основном в печени с образованием гидроксилированных фенольных соединений, через промежуточный продукт - ареноксид. Возможно дегалогенирование соединений. Скорость метаболизма зависит от структуры изомера и вида экспериментального животного, на котором изучается процесс. Собаки и грызуны метаболизируют ПХБ с большей скоростью, чем приматы. Основные пути выведения: с желчью в содержимое кишечника и через почки с мочой. Как и диоксины ПХБ являются индукторами Р-450-зависимых оксидаз смешанной функции в печени, легких и тонком кишечнике. Их введение в организм сопровождается усилением метаболизма других ксенобиотиков. Индукторная способность различных изомеров ПХБ неодинакова. Степень депонирования веществ в тканях зависит от строения изомеров, пути и продолжительности проникновения их в организм, а также от пола, возраста, привычек человека (прием алкоголя). Период полувыведения из организма колеблется от 6 - 7 до 33 - 34 месяцев. Основные проявления острой интоксикации Проявления интоксикации ПХБ чрезвычайно напоминают эффекты, развивающиеся при отравлении диоксинами. В эксперименте на животных подострые и хронические воздействия приводят к развитию многообразных эффектов: прогрессивному падению веса, хлоракне, выпадению волос, отекам, инволюции тимуса и лимфоидной ткани, гепатомегалии, угнетению костного мозга, нарушению репродуктивных функций. У животных, подвергшихся воздействию ПХБ в пренатальном, неонатальном и постнатальном периоде, развиваются неврологические знаки, проявляющиеся, главным образом, нарушением поведения: склонностью к стереотипным “манежным” движениям, гипер- или гипоактивности. У взрослых животных нейротоксические свойства веществ не выявляются. В действующих дозах вещества вызывают понижение веса иммунокомпетентных органов, включая селезенку, тимус, лимфатические узлы. Функциональное состояние иммунной системы не однозначно: при действии высоких доз ПХБ. отмечается иммуносупрессивное (снижением уровня антител, особенно IgA, IgM), а малых - активирующее (повышение уровня IgG) действие. Имеются данные об увеличении частоты инфекционных заболеваний среди животных, подвергшихся воздействию ПХБ. Получены многочисленные данные, свидетельствующие о мутагенном и канцерогенном действии ПХБ. Токсический процесс, вызываемый ПХБ у человека изучен недостаточно. Наиболее достоверным эффектом является патология кожных покровов, и в частности, хлоракне (см. “Диоксин”). В некоторых исследованиях выявлена связь между действием ПХБ и развитием таких общих неблагоприятных эффектов, как частая головная боль, утомляемость, нервозность. |
