химия экзамен. все билеты химия учить. Виды энергии Механическая Тепловая Электрическая Световая
 Скачать 3.4 Mb. Скачать 3.4 Mb.
|
|
Противоречия с планетарной моделью атома: Недостатком планетарной модели была невозможность объяснения ею устойчивости атомов. Из классической электродинамики следует, что если электроны движутся вокруг ядра, испытывая центростремительное ускорение как планеты вокруг Солнца, то они по законам классической электродинамики должны были бы излучать электромагнитные волны, терять орбитальную энергию движения и в результате упасть на ядро. Это противоречие было снято следующим шагом в развитии планетарной модели (модель Бора), постулирующая другие, отличные от классических законы движения электронов Билет 7. Модель строения атома водорода Бора. Постулаты Бора, обоснование атомных спектров. Проблемы модели Бора. Боровская модель атома: За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и очень быстро, а потеряв ее, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввел допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых они не излучают энергию, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Модель Бора электронного строения одноэлектронных водородоподобных систем основана на планетарной модели Резерфорда и двух постулатах Постулаты Бора: движение электрона в атоме может происходить только по дискретным стационарным орбитам, удовлетворяющим условиям кратности момента количества движения и кванту действия. Находясь на такой орбитали, электрон не испускает и не поглощает энергию. Электрон может излучать или поглощать энергию только при переходе с одной стационарной орбиты на другую. Происхождение атомных спектров: Если атом не подвергается никаким внешним воздействиям, то его электроны находятся в состояниях с минимальной энергией (основное состояние). При сообщении атому энергии (в результате столкновения с другим атомом, поглощения кванта света, электронного удара и др.) один или несколько электронов в атоме могут перейти на более высокий энергетический уровень. В этом случае атом становится возбужденным. Атомные спектры возникают при переходах между уровнями энергии внешних электронов атома. Проблемы модели Бора: Не смогла объяснить интенсивность спектральных линий. Справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева без экспериментальных данных (энергии ионизации или других). Теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно — уравнение движения электрона — классическое, другое — уравнение квантования орбит — квантовое. Теория Бора являлась недостаточно последовательной и общей. Поэтому она в дальнейшем была заменена современной квантовой механикой, основанной на более общих и непротиворечивых исходных положениях. Сейчас известно, что постулаты Бора являются следствиями более общих квантовых законов. Но правила квантования широко используются и в наши дни как приближённые соотношения: их точность часто бывает очень высокой. Билет 8. Уравнение Де-Бройля. Корпускулярно-волновые свойства электрона и других микрочастиц. Принцип неопределенности Гейзенберга. Статистический характер описания движения микрочастиц. 1924 г. Луи де Бройль предложил движение любой микрочастицы рассматривать как волновой процесс. Волновым процессам свойственна интерференция и дифракция. Де-Бройль предположил, что корпускулярно-волновым дуализмом обладает не только свет, но и любые частицы вещества : электроны, протоны, атомы и т.д. Математически это выражается соотношением де Бройля, согласно которому частице массой m, движущейся со скоростью v, соответствует волна длиной λ: λ = h/(m v) Корпускулярно-волновые свойства электрона - электрон обладает корпускулярно-волновой двойственностью, проявляя себя и как волна, и как частица. Представим электрон в виде волны. Если, совершив оборот, волна придет в исходную точку в фазе с начальной волной, такая волна усиливается. Если волна приходит в противофазе, она гасится. Орбиты, для которых справедливо 1 условие, это и есть стационарные орбиты по Бору. Для классических материальных точек характерно движение по определенным траекториям, так, что их координаты и импульсы в любой момент времени точно известны. Для квантовых частиц это утверждение неприемлемо, так как для квантовой частицы импульс частицы связан с ее длиной волны, а говорить о длине волны в данной точке пространства бессмысленно. Поэтому для квантовой частицы нельзя одновременно точно определить значения ее координат и импульса. Если частица занимает точно определенное положение в пространстве, то ее импульс полностью не определён и наоборот, частица с определенным импульсом имеет полностью неопределенную координату. Неопределенность в значении координаты частицы Δx и неопределенность в значении компоненты импульса частицы Δpx связаны “соотношением неопределенности”, установленным В. Гейзенбергом в 1927 году: Δx·Δpx. Невозможно одновременно точно определить положение микрочастицы (ее координаты) и ее импульс ( импульс р = mv). D q×Dp h/2p, где Dq – неопределенность положения объекта в пространстве (его координат), а Dp – неопределенность импульса (р = mv) объекта. Современная квантово-механическая модель строения атома использует вероятностный подход, который определяет необходимость использования статистического метода, который опирается на анализ большого числа наблюдений, либо на наблюдение за большим количеством атомов. Билет 9. Вероятностная модель описания атома водорода. Понятие о ψ-функции и её свойствах. Стационарное уравнение Шредингера. Полярные координаты, радиальная и угловая составляющие волновой функции. Функция радиального распределения электронной плотности. Полярные диаграммы. У 1926 год. Э. Шредингер использует волновое уравнение, характеризующее вероятность нахождения микрочастиц в пространстве. Математически волновое движение вдоль оси х описывается волновым уравнением для волновой функции Ψ: Ψ=а*sin[(2π/λ)x], где а-амплитуда, λ-длина волны, х-одномерная волна. Уравнение называют временным уравнением Шредингера, так как Ψ и U зависят от времени. ( 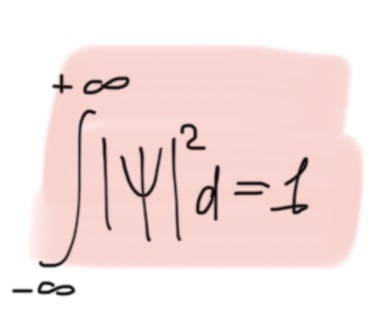 -h2/8π2m)*σΨ2/σx2+UΨ=EΨ -h2/8π2m)*σΨ2/σx2+UΨ=EΨУравнение трехмерной волны: (-h2/8π2m)*(σ2Ψ/σx2+ σ2Ψ/σy2+ σ2Ψ/σz2)+UΨ=EΨ, где U-потенциальная энергия, Е-полная энергия, Ψ-волновая функция пси. Волновая функция (Ψ) должна: Быть конечной, однозначной, непрерывной Обращаться в 0 там, где электрона быть не может Удовлетворять условию нормировки. Решить уравнение Шредингера значит найти удовлетворяющую ему Ψ, описывающую стационарное состояние системы. Уравнение имеет несколько решений Ψ. Ψ физического смысла не имеет, но Ψ2 определяет вероятность нахождения электрона в элементарном объеме пространства. Стационарное уравнение Шредингера имеет вид: ΔΨ+2m/h2(E-U)Ψ=0, где Ψ(x,y,z) – искомая волновая функция, Е-полная энергия частицы, движущаяся в силовом поле, U(x,y,z)-потенциальная энергия, которой обладает частица. П 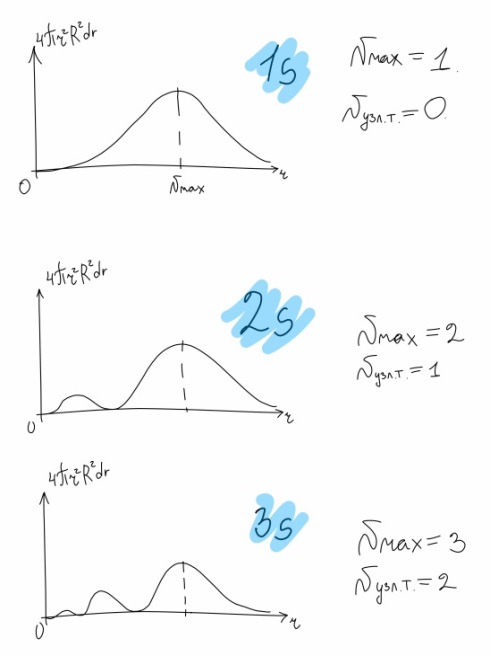 олярная система координат — двумерная система координат, в которой каждая точка на плоскости определяется двумя числами — полярным углом и полярным радиусом. Функцию R(r) называют радиальной составляющей волновой функции, а Θ(θ) Φ(φ) - ее угловыми составляющими. олярная система координат — двумерная система координат, в которой каждая точка на плоскости определяется двумя числами — полярным углом и полярным радиусом. Функцию R(r) называют радиальной составляющей волновой функции, а Θ(θ) Φ(φ) - ее угловыми составляющими. Радиальная составляющая волновой функции. Ψ(r,θ,ϕ)=R(r)*ϴ(θ)*ϕ(ϕ)=Rn,l(r)*ϴl,m(θ)*ϕm(ϕ) Для характеристики радиального распределения вероятности нахождения электрона в пространстве используют функцию радиального распределения электронной плотности 4Пr2dr-вероятность нахождения e в шаровом слое с бесконечно малой толщиной dr (dr-толщина слоя) на расстоянии r (расстояние e от ядра) от ядра. 4Пr^2-обьем шара. 4Пr2R2dr-вероятность нахождения электрона в шаровом слое толщиной dr. Число максимумов опр. как разность n-l. Угловая составляющая : Волновые функции электрона ψnlm(r, θ, φ) определяются тремя целочисленными параметрами: n, l, me. Эти целые числа называются квантовыми числами: n - главное квантовое число, оно, как мы знаем, определяет значение энергии En, n=1,2,3 и до бесконечности. 1) Характеризует возможное дискретное значение энергии e. E=-2π2me4/n2h2 2) Определяет размер атомной орбитали ( электронного облака ). R=n2h2/4π2me2 3) Определяет положение главного максимума функции радиального распределения электронной плотности. А 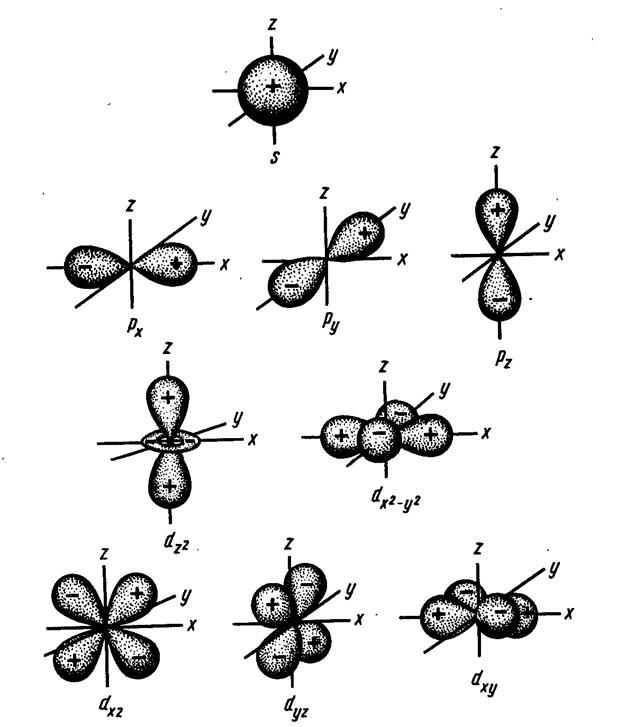 О (одноэлектронная волновая функция, полученная решением уравнения Шрёдингера для данного атома; задаётся: главным n, орбитальным l, и магнитным m — квантовыми числами) с n=const образует квантовый уровень. Min энергиии e соответствует n=1 (основное состояние), если n больше 1-возбужденное состояние атома H. О (одноэлектронная волновая функция, полученная решением уравнения Шрёдингера для данного атома; задаётся: главным n, орбитальным l, и магнитным m — квантовыми числами) с n=const образует квантовый уровень. Min энергиии e соответствует n=1 (основное состояние), если n больше 1-возбужденное состояние атома H.N=1, К-слой N=2, L-слой N=3, M-слой N=4, N-слой l - орбитальное квантовое число, оно определяет абсолютную величину орбитального момента количества движения.  И определяет форму атомной орбитали (электронного облака). n=1; l=0 1-s (сфера) n=2; l=0 2-s (сфера) l=1 2-p (гантелеобразная) n=3; l=0 3-s (сфера) l=1 3-p (гантелеобразная) l=2 3-d и тд. Следовательно, из уравнения Шредингера вытекает, что момент импульса электрона в атоме водорода квантуется и может принимать n значений. Так при n = 1 орбитальное квантовое число может принимать единственное значение l = 0. При n = 2 возможны значения l = 0,1. ml - это магнитное квантовое число. АО, имеющие один электрон, называют вырожденными. При заданном l магнитное квантовое число ml может принимать следующие значения: ml = -l … 0 … +l Оно определяет величину проекции вектора момента импульса электрона на заданное магнитным полем направление. Определяет ориентацию орбиталей в пространстве. Спин-это собственный момент импульса электрона, не связанный с движением в пространстве. Для всех электронов абсолютное значение = +-½. ms-спиновое магнитное квантовое число-проекция спина на ось z. Говорят, что уровень энергии En будет вырожден с кратностью n2. Значение главного квантового числа n указывают перед буквой, являющейся условным обозначением орбитального квантового числа l. Например, 1s-состояние - это состояние с главным квантовым числом n = 1 и орбитальным квантовым числом l = 0 (на это указывает буква s). Билет 10. Решение уравнения Шреденгера для атома водорода. Квантовые числа и их физический смысл. Понятия атомная орбиталь, электронное облако, граничная поверхность, узловая поверхность. Взаимосвязь вероятностной модели и модели Бора для атома водорода. (-h2/8π2m)*(σ2Ψ/σx2+ σ2Ψ/σy2+ σ2Ψ/σz2)+UΨ=EΨ, где U-потенциальная энергия, Е-полная энергия, Ψ-волновая функция пси. Атомная орбиталь – это волновая функция с определенным набором квантовых чисел. Электронное облако – это область пространства, в каждой точке которой может находиться электрон. Граничная поверхность электронного облака – это поверхность, в любой точке которой вероятность нахождения электрона одинакова, а внутри которой общая вероятность нахождения электрона максимальна. У 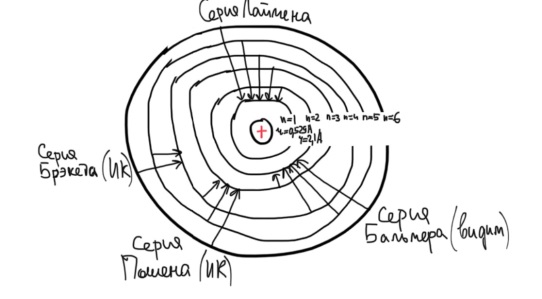 зловая точка – это область пространства, в которой вероятность нахождения электрона равна 0. зловая точка – это область пространства, в которой вероятность нахождения электрона равна 0.1913 год. Нильс Бор. Дополнил модель атома Резерфорда: Движение электрона может происходить только по дискретным орбитам, выполняющим кратность момента количества движения. Двигаясь по орбите электрон не излучает энергию. Переход электрона с одной орбиты на другую сопровождается испусканием кванта (света) эн. излучения с энергией, равной разности энергий электрона на этих стационарных орбитах. ΔE=E2-E1=hV (ню) Fк=Fу; e2/r2=mV2/r => r=n2h2/4π2me2где n-квант. число, h-постоянная Планка, m-масса электрона, e-заряд электрона. r= 0,529 n2 A֯, а так как в основном состоянии атома водорода n=1, то r=0,529 A֯. Билет 11. Вероятностная модель описания электронного строения многоэлектронных атомов – одноэлектронное приближение. Понятие об эффективном заряде ядра и постоянной экранирования, проникающей способности электрона. Энергетическая диаграмма атомных орбиталей многоэлектронного атома. 1.Электроны в многоэлектронном атоме движутся в поле ядра или других электронов 2.Для нахождения волновой функции многоэлектронных систем используют приближенные системы Одноэлектронное приближение — приближенный метод нахождения волновых функций и энергетических состояний квантовой системы со многими электронами. В основе одноэлектронного приближения лежит предположение, что квантовую систему можно описать как систему отдельных электронов, движущихся в усреднённом потенциальном поле, которое учитывает взаимодействие как с ядрами атомов, так и с другими электронами. Эффективный заряд ядра – заряд, согласно которому ядро действует на валентные электроны Постоянная экранирования — количественная характеристика того, насколько внутренние электроны экранируют внешние электроны от действия заряда атомного ядра. Проникающая способность электронов – способность электронов проникать вглубь атома · Z эфф = Z – b (постоянная экранирования) У s-электронов проникающая способность выше, поэтому они слабо экранируются ядром Энергетическая диаграмма атомных орбиталей многоэлектронного атома: расположение электронов в многоэлектронном атоме происходит по правилу Клечковского (заполнение атомных орбиталей электронами происходит в порядке роста суммы главного и орбитального чисел. При равенстве энергий сначала заполняется атомная орбиталь с наименьшим значением главного квантового числа.) Билет 12. Принципы и правила распределения электронов по атомным орбиталям в многоэлектронном атоме. Основное и возбуждённое состояния. Электронная и электронно-графическая формула химических элементов и их ионов. Изоэлектронные системы. 1. Принципы и правила распределения электронов по атомным орбиталям в многоэлектронном атоме. Конфигурация электронной оболочки невозбужденного атома определяется зарядом его ядра. Электроны с одинаковым значением главного квантового числа n образуют квантовый слой близких по размерам облаков. Квантовые слои в свою очередь построены из подслоев, объединяющих электроны с одинаковым значением квантового числа l ( эл). Подслой состоит из орбиталей. Наиболее устойчиво состояние атома, в котором электроны имеют самую низкую энергию (т.е. находятся в ближайших к ядру слоях). Последовательность энергетических состояний в порядке возрастания энергии орбиталей многоэлектронного атома можно представить в виде следующего ряда: 1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 4f ≈ 5d < 6p < 7s Порядок заполнения орбиталей данного подслоя подчиняется правилу Хунда: суммарное спиновое число электронов данного подслоя должно быть максимальным. Это означает, что орбитали сначала заполняются по одному, затем по второму электрону. Электроны с противоположными спинами на одной и той же орбитали образуют двухэлектронное облако и их суммарный спин равен нулю. Также электроны в многоэлектронных системах подчиняются принципу Паули: в любой многоэлектронной системе в каждом состоянии, определяемом полным набором 4 квантовых чисел, не может быть больше 1 электрона. 2. Основное и возбуждённое состояния. Переход электрона из одного квантового состояния в другое связан со скачкообразным изменением его энергии. Квантовое состояние атома с наименьшей энергией Е1 называют основным. Остальные квантовые состояния с более высокими уровнями энергии Е2, Е3, Е4... называют возбужденными. Электрон в основном состоянии связан с ядром наиболее прочно. Когда же атом находится в возбужденном состоянии, связь электрона с ядром ослабевает вплоть до отрыва электрона от атома и превращения его в положительно заряженный ион. Возбуждение атома происходит при нагревании, электроразряде, поглощении света и тд. При этом в любом случае атом поглощает лишь определенные кванты энергии, соответствующие разности энергетических уровней электронов. Обратный переход электрона сопровождается выделением точно таких же квантов энергии. 3. Электронная и электронно-графическая формула химических элементов и их ионов. Электронная формула- это формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы. Электронно-графическая формула показывает расположение электронов на электронных оболочках. Каждой ячейке отвечает определенная орбиталь, электрон отображается в виде стрелки (направление которой олицетворяет спиновое квантовое число). В каждой ячейке может располагаться только 1 электрон, или 2 электрона с противоположно направленными спинами. Свободная ячейка означает свободную орбиталь, которую может занимать электрон при возбуждении атома. 4. Изоэлектронные системы. Понятие изоэлектронные относится к двум атомам, ионам или молекулам, имеющим одинаковую электронную структуру и одинаковое число валентных электронов. Термин означает «равный электрический» или «равный заряд». Изоэлектронные химические вещества обычно проявляют сходные химические свойства. Говорят, что атомы или ионы с одинаковыми электронными конфигурациями изоэлектронны друг другу или имеют одинаковую изоэлектронность. К+ ион изоэлектронный с Са2+ ион. Молекула окиси углерода (СО) изоэлектронна газообразному азоту (N)2 Изоэлектронность может быть использована для прогнозирования свойств и реакций вида. Он используется для идентификации водородоподобных атомов, которые имеют один валентный электрон и, таким образом, являются изоэлектронными для водорода. Эта концепция может применяться для прогнозирования или идентификации неизвестных или редких соединений на основе их электронного сходства с известными видами. Билет 13. Периодический закон, периодическая система, периодические таблицы. Сравнительный анализ периодических таблиц. Понятие о периоде, группе, подгруппе. Внутренняя и вторичная периодичность. Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от их заряда атомного ядра. Система является графическим выражением периодического закона, открытого русским учёным Д. И. Менделеевым в 1869 году и установившего зависимость свойств элементов от их атомного веса (в современных терминах, от атомной массы) Первоначальный вариант был разработан Д. И. Менделеевым в 1869, и приведен к традиционному графическому виду в 1871 году. Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс. • Внутренняя периодичность - немонотонность в изменении атомных характеристик по периоду, связанная с повышенной устойчивость наполовину и полностью заполненных энергетических уровней и подуровней. • Вторичная периодичность-немонотонность сравнительных характеристик по периоду, связанная с наличием заполненных d и f уровней и d и f стания 1 марта 1869 г. Периодический закон и периодическая система Д.И. Менделеева (63 элемента) 1869 г . «Свойства элементов, а потому и свойства образуемых ими простых сложных тел, стоят в периодической зависимости от их атомного веса» Современная формулировка: Свойства элементов и их однотипных соединений находятся периодической зависимости от заряда атомным ядер элементов, что является следствием периодического повторения строения внешних электронных слоев атомов при увеличении заряда их ядра. Гру́ппа периодической системы химических элементов — последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением. Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома. В короткопериодном варианте периодической системы группы подразделяются на подгруппы — главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побочные (подгруппы В), содержащие d-элементы. Подгруппы также имеют названия по элементу с наименьшим зарядом ядра (как правило, по элементу второго периода для главных подгрупп и элементу четвёртого периода для побочных подгрупп). Элементы одной подгруппы обладают сходными химическими свойствами. С возрастанием заряда ядра у элементов одной группы из-за увеличения числа электронных оболочек увеличиваются атомные радиусы, вследствие чего происходит снижение[источник не указан 1346 дней] электроотрицательности, усиление[источник не указан 1346 дней] металлических и ослабление[источник не указан 1346 дней] неметаллических свойств элементов, усиление восстановительных и ослабление окислительных свойств образуемых ими веществ. Период — строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки. Периодическая система имеет семь периодов Периодический закон: свойства хим. элементов и образованных ими простых и сложных веществ находятся в периодической зависимости от заряда ядра Периодическая система: материальное отображение периодического закона, основанное на принципе Паули. Билет 14. Классификация химических элементов в зависимости от положения в периодической системе: s-, p-, d-, f-элементы; непереходные и переходные, элементы главных и побочных подгрупп; ранние и поздние; декады d-элементов; легкие и тяжёлые d-элементы; групповые названия. 1.Элементы Металлы (Ме) и Неметаллы (неМе) В ПС для определения Неметаллов нужно провести воображаемую линию от B до At: по правую сторону (включая линию) это неметаллы, по левую сторону металлы. 2.Переходные (d и f элементы (от Sc до Zn, от Y до Cd, от La (+лантаноиды) до Hg, от Ac (+ актиноиды) до Cn) и Непереходные (s и p элементы (все остальные)) элементы. 3.По обозначению атомных обителей внешних электронных уровней: s-элементы (ns) (эс элементы) p-элементы (ns, np) (пэ элементы) d-элементы ((n-1)d, ns, np) (дэ элементы) n - главное квантовое число. f-элементы ((n-2)f, (n-1)d, ns, np) (эф элементы) 4. Ранние и поздние элементы. с IA по IVA ранние элементы непереходные с VA по VIII A поздние элементы с III B по VII B ранние элементы переходные VIII B, I B, II B поздние элементы 5.Главная и побочная подгруппы. Главные подгруппы. Главные подгруппы IA IIA IIIA IVA VA VIA VIIA VIIIA, Побочные подгруппы IB IIB IIIB IVB VB VIB VIIB VIIIB. Вообще такое деление характерно для короткопериодной ПС. 6.Элементы определённого периода: 1, 2, 3 периоды – малые, следовательно элементы малого периода. 4, 5, 6, 7 периоды – большие, следовательно элементы большого периода. 7.Элементы определённой группы: I A щелочные металлы II A щелочно-земельные металлы V A пниктогены (образующие зловонье) VI A халькогены VII A галогены VIII A благородные/инертные газы Для переходных d-элементов: 8.Лёгкие и Тяжёлые элементы Для 3d элементов-лёгкие элементы. Для 4d, 5d элементов-тяжёлые элементы. 9.Декады элементов: 1. декада от Sc до Zn подсемейство Скандия 2. декада от Y до Cd подсемейство Иттрия 3. декада от La до Hg подсемейство Лантана 4. декада от Ac до Cn подсемейство Актиния 10. Для VIII B группы. (Fe, Co, Ni) семейство железа (Ru, Rh, Pd, Os, Ir, Pt) семейство платиновых металлов Примеры описания элементов: 1.Ca (кальций) это ранний, непереходный, 4s элемент, главной подгруппы, щелочноземельной группы, большого периода, металл. 2.S (сера) это поздний, непереходный, 3p элемент, главной подгруппы, группы халькогенов, малого периода, неметалл. 3.Ti (титан) это ранний, переходный, 3d элемент, побочной подгруппы, большого периода, лёгкий металл, 1 декады (подсемейство скандия). 4.Rh (родий) это поздний, переходный, 4d элемент, побочной подгруппы, большого периода, тяжёлый металл, 2 декады (подсемейство иттрия), семейства платиновых металлов. 5.Pb (свинец) это ранний, непереходный, 6p элемент, главной подгруппы, большого периода, металл. Билет 15. Радиусы атомов химических элементов (орбитальный, ковалентный, металлический, ионный, Ван-дер-ваальсовый). Энергия (потенциал) ионизации атомов химических элементов. Основные закономерности изменения атомных и ионных радиусов и величины энергии ионизации в зависимости от положения элемента в периодической системе.   Атомный радиус Атомный радиусЭффективные Орбитальные Экспериментально определённые Теоретически определённые (ионный, ковалентный, металлический, Ван-дер-Вальсовый) Орбитальный радиус – теоретически рассчитанное значение радиуса атома, соответствующее положению главного максимума функции радиального распределения электронной плотности. Ковалентный радиус – это радиус, который определяется как половина расстояния между двумя одинаковыми атомами, связанными между собой одинарной ковалентной связью. Металлический радиус – это радиус, который равен половине расстояния между атомами металла в узлах металлической решётки. Ионный радиус – это часть расстояния между катионом и анионом. Предложил в 1920 А. Ланде. Ван-дер-Вальсовый радиус – это радиус, который равен половине расстояния между центрами двумя атомов, несвязанных друг с другом химически. 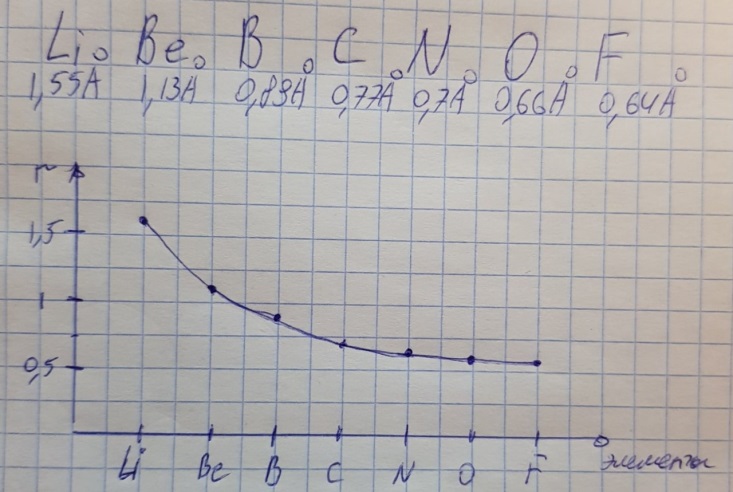 Изменение атомных радиусов по периоду и группе: 1.По периоду: (слева направо): n=const , Zэфф. ядра увеличивается, тогда радиус уменьшается. 2.По группе: (сверху вниз): n увеличивается, тогда увеличивается и радиус: 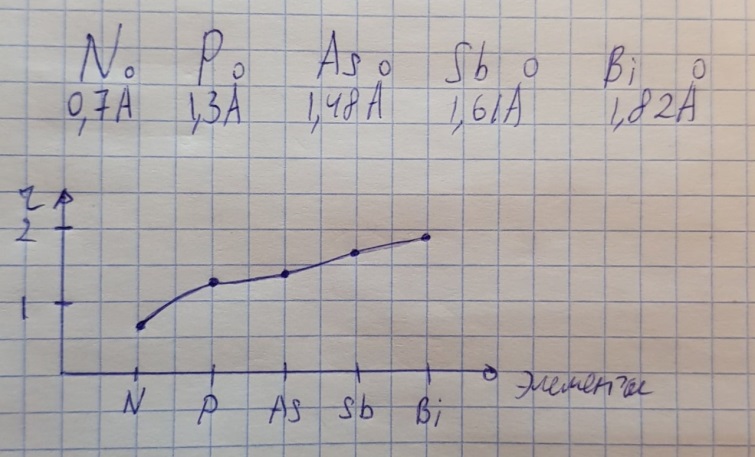 Для переходных (d и f) элементов: для переходных элементов 5 и 6 го периода приблизительно равны из-за эффекта f сжатия, вторичной периодичности). Радиус катионов: При переходе от атома к катиону Zэфк увеличивается, следовательно радиус катиона меньше, чем радиус атома. Радиус для изоэлектронных частиц тоже самое. Для элементов одной группы, но разных подгрупп, радиус непереходного элемента больше чем переходного. 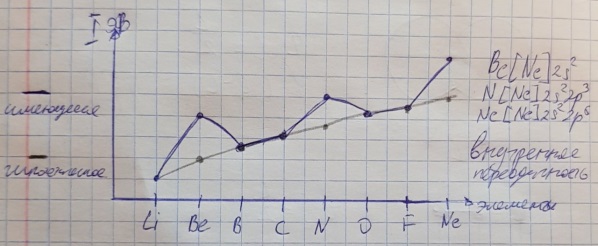 Энергия ионизации – это гипотетическое количество энергии, которое необходимо затратить на удаление электрона от свободного элемента в газовой фазе в основном состоянии. Энергия ионизации – это гипотетическое количество энергии, которое необходимо затратить на удаление электрона от свободного элемента в газовой фазе в основном состоянии.Изменение энергии ионизации: 1.По периоду: n=const, Z увеличивается, энергия ионизации I увеличивается, но некоторые элементы имеют максимумы из-за внутренней периодичности: 2 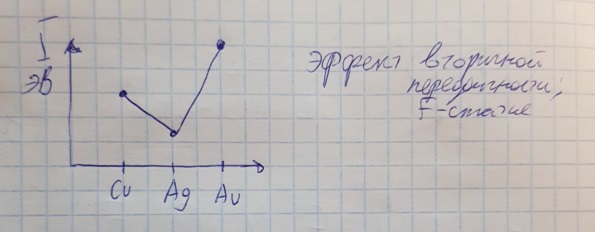 .По группе: n увеличивается, радиус увеличивается, следовательно энергия ионизации уменьшается, но у некоторых элементов есть максимумы из-за вторичной периодичности, f и d сжатия: .По группе: n увеличивается, радиус увеличивается, следовательно энергия ионизации уменьшается, но у некоторых элементов есть максимумы из-за вторичной периодичности, f и d сжатия: 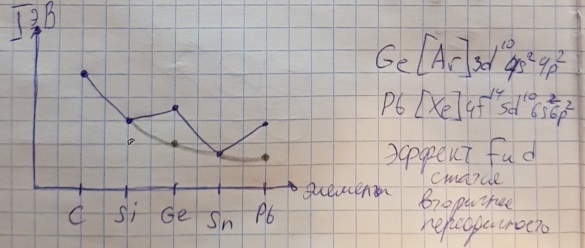  3.Для переходных элементов: эффект вторичной периодичности, f сжатия: 3.Для переходных элементов: эффект вторичной периодичности, f сжатия: Билет 16. Энергия сродства к электрону. Относительная электроотрицательность (шкалы ОЭО). Закономерности изменения этих величин в зависимости от положения элемента в периодической системе. Э 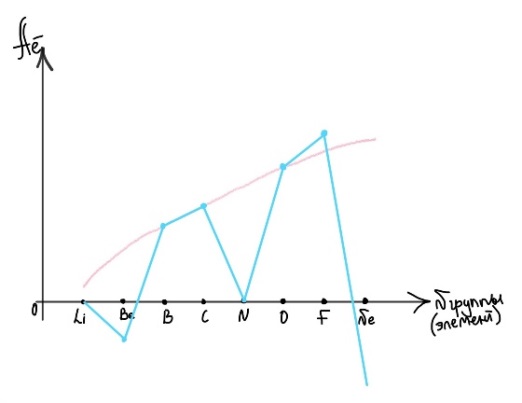 нергия сродства к электрону – это энергетический эффект присоединения электрона к свободному атому в газовой фазе в основном состоянии, сопровождающийся образованием аниона. Измеряется Ае- в кДж/моль (эВ/моль). Сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации отрицательно заряженного иона (аниона) Э-. (Ае- = -I) нергия сродства к электрону – это энергетический эффект присоединения электрона к свободному атому в газовой фазе в основном состоянии, сопровождающийся образованием аниона. Измеряется Ае- в кДж/моль (эВ/моль). Сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации отрицательно заряженного иона (аниона) Э-. (Ае- = -I)П  о периоду Zэфф↑; r↓; Ae-↑ о периоду Zэфф↑; r↓; Ae-↑Наличие минимумов в изменениях энергии сродства к электрону по периоду связана с явлением внутренней периодичности. По группе: n↑; r↑; Ae-↓ Для фтора пониженное значение связанно с эффектом межэлектронного отталкивания в следствии аномально малых радиусов для II периода. Для элементов Br и At немного завышенные значения связаны с явлением вторичной периодичности. Для переходных по группе: Cu→Ag→Au Ae-↑. Вместо уменьшения – увеличение, что связано с явлением вторичной периодичности. F-сжатие, но, при этом, высокая проникающая способность 6s-элементов. Относительная электроотрицательность – условная расчетная величина, позволяющая оценить способность атома хим. элемента оттягивать электронную плотность от другого атома в хим. соединении. Очевидно, что эта способность зависит от энергии ионизации атома и его сродства к электрону. Шкалы ОЭО: шкала Полинга, шкала Малликена, шкала Оллреда-Рохова. Л. Полинг предлагал использовать ОЭО как меру способности атома оттягивать электроны от другого атома в хим. соединении. Сравнивание энергии гетероядерных связей с энергией гомоядерных связей. EА-B, EA-A, EB-B. EА-B = (EA-A + EB-B)/2, а Мера разности ОЭО (∆А-В)= EА-B -( EA-A + EB-B)/2. ∆А-В = 0,26 – (ХА-Х)2 X(H)=2,1, все остальные элементы считаются по водороду. А ОЭО фтора равна 4,0. В периодах наблюдается общая тенденция роста электроотрицательности элементов, а в подгруппах – ее падения. Наименьшими значениями электроотрицательности характеризуются s-элементы I группы, а наибольшим - p-элементы VII группы. С 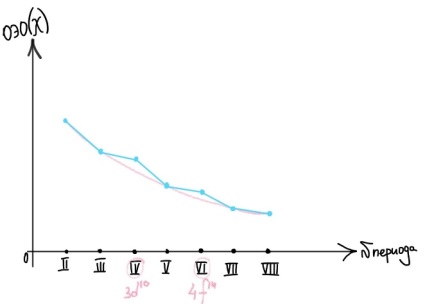 огласно определению Малликена электроотрицательность атома может быть выражена как полусумма его энергии ионизации и сродства к электрону: огласно определению Малликена электроотрицательность атома может быть выражена как полусумма его энергии ионизации и сродства к электрону: Х 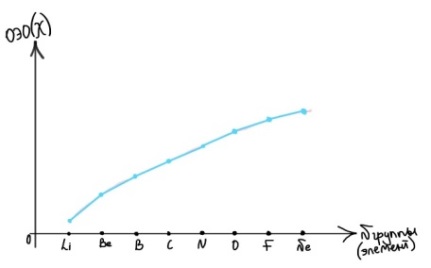 =1/2(I+Ae-), Х=ЭО(элемента)/ЭО(Li) =1/2(I+Ae-), Х=ЭО(элемента)/ЭО(Li) Мерой Относительной электроотрицательности по Оллеру-Рохову является сила, действующая на электрон на расстоянии ковалентного радиуса. ОЭО=(e2*Zэфф)/r2 По периоду: n=const; Z↑; r↓; X ↑ По группе: n↑; r↑; X↓ Наличие максимумов в изменениях электроотрицательности по группе являются следствием вторичной периодичности. Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Она зависит от многих факторов, в частности от валентного состояния элемента, типа соединения, в которое входит, и пр. Тем не менее это понятие полезно для качественного объяснения свойств химической связи и соединений. Билет 17. Горизонтальная, вертикальная и диагональная аналогии в свойствах атомов химических элементов. Характерные степени окисления и координационные числа химических элементов в соединениях. 17 билет. Вертикальная аналогия определяет сходства элементов, расположенных в одном вертикальном ряду (группе, подгруппе) Обусловлена одинаковым количеством валентных электронов и схожим строением. Определяется в аналогии стехиометрического состава элемента. HF HCl HBr HI ; H2O H2S H2Se H2Te ; CO2 SiO2 CrO2 SnO2 PbO2; Совпадают только простейшие формулы, а не физические и химические свойства. Имеют «общий состав». Горизонтальная аналогия основана на сходстве хим элементов, их свойств и соединений в рамках периода. Горизонтальная аналогия элементов II периода: аномально малое значение радиуса. IV и VII объединены по свойствам в следствии явления вторичной периодичности. Диагональное сходство обусловлено близостью радиусов элементов, расположенных на одной диагонали и….. C Be P. Al CO2 Se BeO Ge P2O5 I Al2O3 SeO6 GeO2 I6O7 Кислые оксиды. Амфотерные оксиды5 Степень окисления – формальный заряд атома хим. элемента в соединении, вычисляемый из положения об ионном строении соединений. H+Cl- (степень окисления) H+0,17Cl-0,17 (физический заряд) Cs+0,9F-0,9 Правила определения степени окисления: Максимальная степень окисления = N группы (Cl-7, S-6) Минимальная степень окисления = Nгр-8 (Cl-1; S-2) Промежуточные степени окисления соответственно правилу четности Менделеева (N-2; N-4 и тд) Непереходные По периоду: Zэфф ↑ ∆Es-p ↑ устойчивость соединений высшей степени окисления уменьшается, а окислительные способности наоборот. SiO44->PO43->SO42->ClO4- По группе: проявление вторичной периодичности для элементов 4 и 6 периода. ClO4->BrO4- Tl+3, Pb+4, Bi+5 – сильнейшие окислители (Tl(NO3)3; Pb3O4; Pb2O3; PbO2; KBiO3) Au+H2SO4→\ Au+H2SeO4→ Au2(SeO4)3+SeO2+H2O Переходные По периоду: увеличивается стабильность d-орбитали по мере заполнения ее электронами, следствие, устойчивость соединений с высшей степенью окисления уменьшается. Sc2O3>TeO2>V2O5>CrO3>Mn2O7>[FeO4] Устойчивость уменьшается, а окислительная способность увеличивается По группе: устойчивость высших степеней окисления увеличивается, а окислительные свойства ослабевают [FeO4]<[RuO4] Координационное число определяется числом частиц, непосредственно окружающих атом или ион в хим. соединении. Леганд=окружение/партнер/сосед Для соединений с преимущественно ковалентной связью координационное число является числом сигмо связей с легандами или партнерами. К.ч (Na+)=6 в NaCl К.ч(Cs+)=8 в CsCl. К.ч (центра атома)=r(центра атома) и Zиона. К.ч=1/r(леганды)
Радиус ↑, к. ч. ↑
Радиус ↑, к. ч. ↑ Б 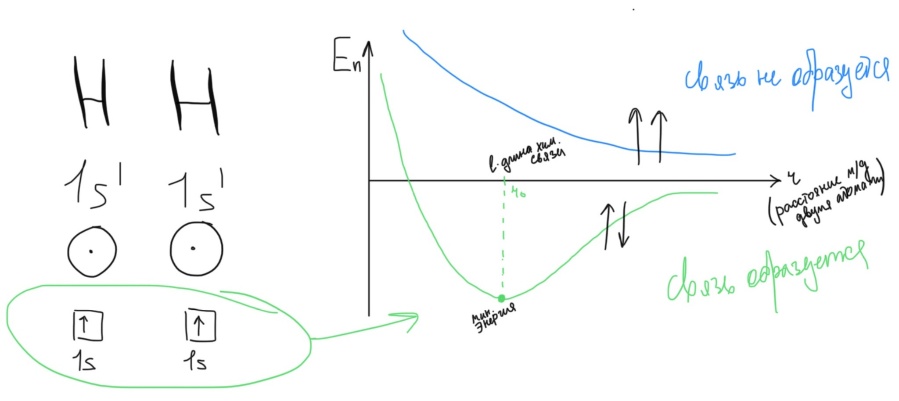 илет 18. Понятие о химической связи и её основных характеристиках: длина, энергия, полярность, направленность, насыщаемость. Общая характеристика моделей химических связей. илет 18. Понятие о химической связи и её основных характеристиках: длина, энергия, полярность, направленность, насыщаемость. Общая характеристика моделей химических связей.Хим. связь – явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается понижением потенциальной энергии систем. Хим связь – совокупность сил, обуславливающих взаимодействие между атомами. 1916 год (Льюис) теория хим связи. Хим связь образуется за счет объединения электронов в электронные пары. Эта теория легла в основу современной теории ковалентной связи. 1916 год (Коссель) При взаимодействии атомов один отдает электрон, другой его принимает, а хим связь образуется за счет электростатического напряжения образующихся ионов. Эта теория легла в основу современной теории ионной связи. Типы хим связи: Внутримолекулярная -ковалентная (связь, которая образуется за счет объединения электронов в общие электронные пары) -ионная (связь, которая осуществляется за счет электростатического напряжения противоположно заряженных ионов) - 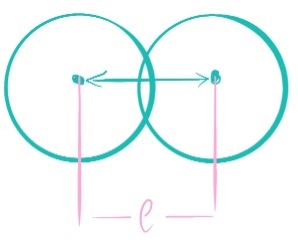 металлическая (связь, которая осуществляется между атомами и катионами металлов в узлах кристаллической решётки и относительно свободными электронами (электронным газом)) металлическая (связь, которая осуществляется между атомами и катионами металлов в узлах кристаллической решётки и относительно свободными электронами (электронным газом))Межмолекулярная -водородная -вандервальсовы силы Длина связи. [А° или нм]. Расстояние между центрами ядер взаимодействующих атомов, когда силы притяжения и отталкивания уравновешены, а потенциальная энергия системы минимальна. Э 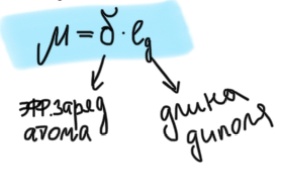 нергия связи. [кДж/моль] Определяется количеством энергии, которое необходимо затратить для разрыва связи одного моль вещества с образованием изолированных атомов. Или. Определяется количеством энергии, которая выделится при образовании одного моль вещества из изолированных атомов. нергия связи. [кДж/моль] Определяется количеством энергии, которое необходимо затратить для разрыва связи одного моль вещества с образованием изолированных атомов. Или. Определяется количеством энергии, которая выделится при образовании одного моль вещества из изолированных атомов. H+H→H2 +435 кДж/моль или H2→H+H -435 кДж/моль С+4Н→СН4+1647кДж/моль Eсв.(С-Н)=1647/4≈411кДж/моль П 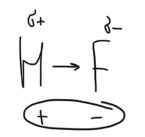 олярность связи. Определяется разностью в значениях электроотрицательности взаимодействующих атомов. Ковалентная связь: ковалентная-полярная(∆ОЭО>0), ковалентная-неполярная(∆ОЭО=0). Количественной мерой полярности связи служит величина дипольного момента хим связи. Μ-дипольный момент хим связи [Кл*м]. 1D(Дебай)=3,33•10-30Кл*м олярность связи. Определяется разностью в значениях электроотрицательности взаимодействующих атомов. Ковалентная связь: ковалентная-полярная(∆ОЭО>0), ковалентная-неполярная(∆ОЭО=0). Количественной мерой полярности связи служит величина дипольного момента хим связи. Μ-дипольный момент хим связи [Кл*м]. 1D(Дебай)=3,33•10-30Кл*мНаправленность связи. Одно из свойств хим связи. Направленность является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Ковалентная связь направлена в пространстве, ионная и металлическая не направлены. Насыщаемость связи. Одно из свойств хим связи. Способность атома образовывать определенное количество связей и способность атома образовывать соединения определенного стехиометрического состава. Ковалентная связь максимально насыщаема (Н2, не Н3), а ионная и металлическая связь не насыщаемы. Билет 19. Метод молекулярных орбиталей (МО). Основные положения метода МО. Приближение линейной комбинации атомных орбиталей (ЛКАО). Понятие о связывающих, разрыхляющих и несвязывающих МО. Построение МО для двухатомных гомоядерных соединений элементов I и II периодов. Порядок связи, энергия ионизации, оптические и магнитные свойства. Метод молекулярных орбиталей – квантовохимический метод описания химической связи, рассматривающий молекулу и другие многоатомные системы, как многоядерный атом, в котором электроны заселяются по молекулярным орбиталям. Основные положения: Химические соединения рассматриваются как единая система, состоящая из положительно заряженных ядер и электронов. Движение каждого электрона в соединении в эффективном электрическом поле, создаваемом всеми ядрами и электронами, описывается одноэлектронной волновой функцией – молекулярной орбиталью (МО). Нахождение МО проводят на основе линейной комбинации атомных опбиталей, так называемое приближение МО ЛКАО. При формировании МО участвуют валентные орбитали исходных атомов. (Валентное приближение) Количество МО должно соответствовать суммарному числу исходных АО, участвующих в ЛКАО, а количество электронов на МО должно соответствовать суммарному числу электронов на исходных АО. Распределение электронов по МО осуществляется согласно принципу минимума энергии, принципу Паули и правилу Хунда. В линейную комбинацию для формирования МО могут вступать АО подходящие по симметрии, то есть характеризующиеся наибольшим перекрыванием. Поэтому по симметрии различают сигмо, пи и дельта МО. В линейную комбинацию для формирования МО должны вступать исходные АО, близкие по энергии. Образующиеся МО по энергии подразделяются на: связывающие (их Е ниже Е исходных АО), разрыхляющие (их Е выше Е исходных АО) и несвязывающие (их Е совпадает с Е исходных АО). Для изображения энергетического состояния МО и распределения электронов по МО используют аналитические диаграммы. П 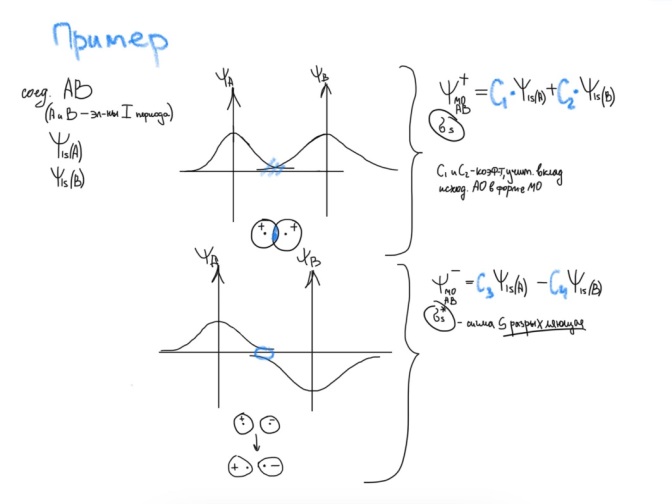 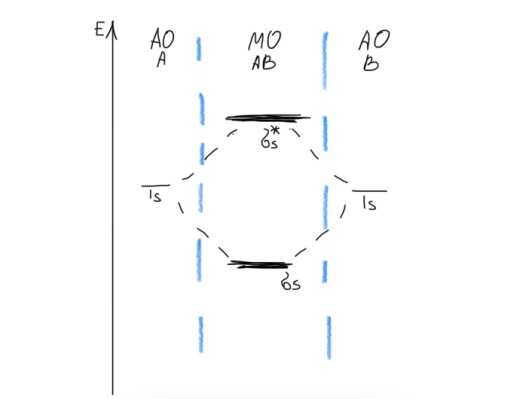 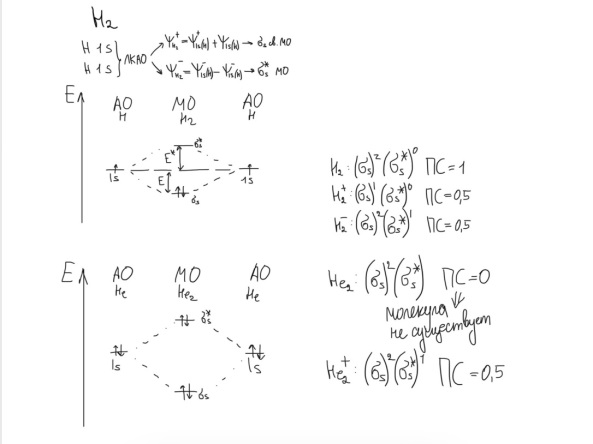 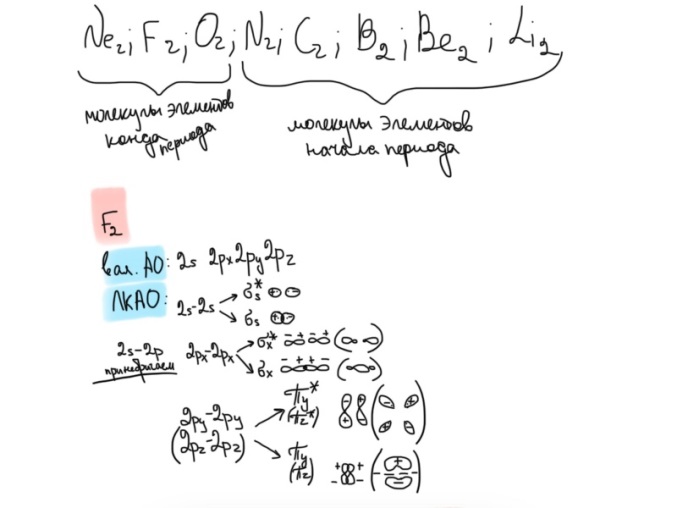 остроение МО для двухатомных гомоядерных соединений I периода. остроение МО для двухатомных гомоядерных соединений I периода.П 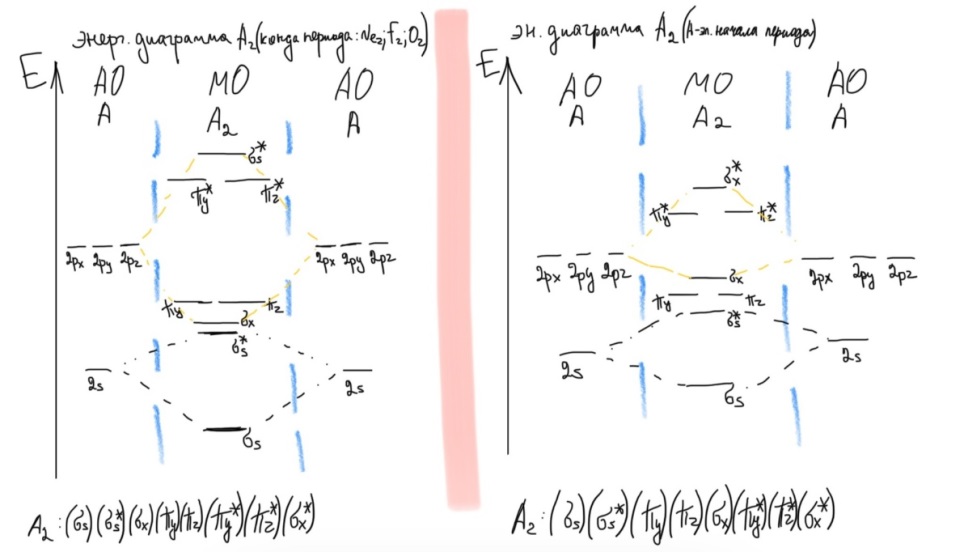 остроение МО для двухатомных гомоядерных соединений II периода. По периоду слева направо энергетический зазор между s и p орбиталями увеличивается, поэтому для элементов начала периода при формировании двухатомных молекул в следствии малого энергетического зазора будет происходить межэлектронное отталкивание между электронами на сигмаs разрыхляющих и сигмаs связывающих МО, электронная плотность которых сосредоточена в одном объеме пространства – на линии, связывающей центры атомов. Количественной характеристикой устойчивости или прочности молекул служит величина порядка связей (ПС). ПС=(число электронов на связывающих орбиталях – число электронов на разрыхляющих орбиталях)/2*n (число партнеров). Чем выше ПО, тем выше энергия связей, устойчивость и прочность, но ниже длина связей. Энергия ионизации – количество энергии, которую необходимо затратить для удаления электрона от свободного атома в газовой фазе в основном состоянии. 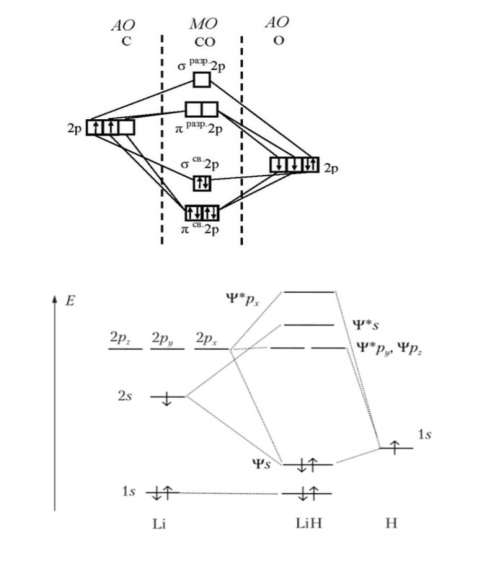 Оптические и магнитные свойства. ММО объясняет окраску соединений, которая обусловлена переходом электронов с ВЗМО (высших заполненных) на НСМО (низшие свободные) под воздействием видимого света. Также ММО объясняет магнитные свойства молекул. (Если есть неспаренные электроны – парамагнитные свойства, если же все электроны в парах – диамагнитные свойства). Билет 20. Энергетические диаграммы МО двухатомных гетероядерных молекул и ионов, образованных элементами II-ого периодов. Порядок связей, степень ионности и ковалентности связи. Специфической особенностью гетероядерных соединений является смещение электронной плотности к более ЭО-му атому и, как следствие, появление на ряду с ковалентной составляющей связи определенные степени ионности. При изображении энергетических диаграмм МО гетероядерных соединений энергия исходных АО наиболее электроотрицательного атома будет ниже, чем энергия ао менее электроотрицательного атома, что приводит к различному вкладу ао в связывающие и разрыхляющие мо. Для гетерогенных структур в основном используются энергетические диаграммы элементов начала периода, особенно если в состав молекулы входит хотя бы один элемент начала периода. Порядок связей - определяется разностью числа электронов на связывающих и разрыхляющих МО к удвоенному количеству партнеров; чем больше ПС, тем более устойчива структура Степень ионности - чем больше ОЭО, тем больше степень ионности Билет 21. Основные положения метода валентных связей (МВС). Механизмы образования двухцентровых, двухэлектронных химических связей (привести примеры). Основные положения МВС: Электронное строение химических элементов рассматривается как совокупность отдельных двуцентровых двуэлектронных связей, локализованных между двумя соседними атомами. Каждая индивидуальная хим связь между двумя атомами образуется за счет объединения электронов в электронные пары, при этом происходит перекрывание волновых функций АО и понижение общей энергии системы. В зависимости от симметрии распределения плотности общей электронной пары, двуцентровые двуэлектронные связи подразделяются на сигма, пи и дельта связи. Энергия каждой двуцентровой двуэлектронной связи будет больше в случае наибольшего перекрывания (хим связь образуется в направлении наибольшего перекрывания АО) Есигма>Епи>Едельта Количество двуцентровых двуэлектронных связей между соседними атомами определяет кратность связи. Между двумя атомами возможно образование 1сигма, 2пи и 1 дельта связей. Максимальная К=4 (для переходных), для непереходных 3. Количественной мерой способности атома к образованию связей является валентность, которая определяется количеством двуцентровых двуэлектронных связей между партнерами. О=С=О В(С)=4, а К=2. СF4 В=4, SiF6²- B=6. Max валентность атома определяется числом валентных орбиталей. Сигма больше пи, а пи больше дельта. Кол-во двухц. и двухэл между соседними атомами определяет кратность связи. Каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Таким образом, в представлении теории валентных связей химическая связь локализована между двумя атомами, т. е. она двухцентровая и двухэлектронная. Max K ( кратность связи )=4. Механизмы : Обменный : В образовании связи участвуют одноэлектронные атомные орбитали, то есть каждый из атомов предоставляет общее пользование одному из электронов. HCl Донорно-акцепторный. Образование пары происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора. Донор-тот, кто отдает свою электронную пару. Акцептор-тот, кто принимает.NH4+ Билет 22. Направленность и насыщаемость двухцентровых, двухэлектронных химических связей. Образование σ-, π- и d- связей. Кратность связей. Понятие о валентности атомов химических элементов. Дипольный момент отдельных связей и всего химического соединения. Насыщаемость – способность атома образовывать определённое кол-во связей и способность атома к образованию соединений определённого стехиометр.состава. Ковалентная хс насыщаема, ионная- нет Направленность: Ковалентная – перекрывание АО; Ионная – не направлена- сферическо-электрическое поле действует во всех напрвлениях; Ме связь – не направлена. 1. Сигма-связь – связь, которая образуется при перекрывании АО по линии, связывающие центры атомов. 2. Пи-связь – связь, которая образуется при перекрывании АО перпендикулярно линии, связывающие центры атомов. 3. Дельта-связь – связь, которая образуется при перекрывании всех 4-ёх лопастей d-орбиталей. Кратность связей – число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу. Например, в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара. Валентность - способность атомов химических элементов образовывать определённое число химических связей. Дипольный момент – это векторная величина. Понятия «дипольный момент связи» и «дипольный момент молекулы» совпадают только для двухатомных молекул. Дипольный момент молекулы равен векторной сумме дипольных моментов всех связей. Таким образом, дипольный момент многоатомной молекулы зависит от ее строения. Полярность определяется суммарным вектором дипольных моментов всех хим.связей. Если молекула имеет симметричное положение в пространстве и не содержит в центральном атоме НЭП – неполярная Если центральный атом содержит на гибридных орбиталях НЭП или имеет разные атомы-партнёры, то такие - полярные В угловой молекуле Н2О полярные связи Н–О расположены под углом 104,5o. Векторная сумма дипольных моментов двух связей Н–О выражается диагональю параллелограмма. В результате дипольный момент молекулы воды m не равен нулю. Б 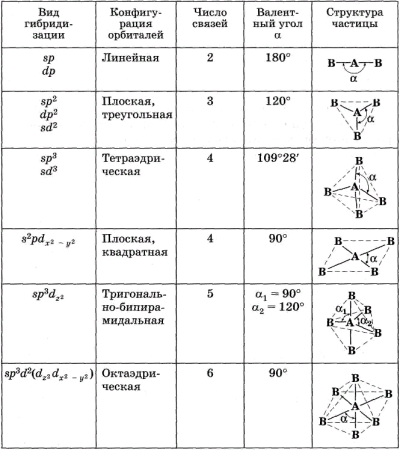 илет 23. Модель гибридизации атомных орбиталей. Типы гибридизации и геометрия соединений (привести примеры). Факторы, влияющие на эффективность гибридизации. Правило Джилеспи. Метод отталкивания валентных электронных пар и геометрия молекул. илет 23. Модель гибридизации атомных орбиталей. Типы гибридизации и геометрия соединений (привести примеры). Факторы, влияющие на эффективность гибридизации. Правило Джилеспи. Метод отталкивания валентных электронных пар и геометрия молекул.G, Nсигма, N НЭП Тип гибридизации Тип молекулы Геометрическая модель гибридных орбиталей Валентные углы, Факторы, влияющие на эффективность гибридизации: По периоду: если энергетический зазор между орбиталями увеличивается, то эффективность гибридизации уменьшается По группе: если радиус атома и диффузность АО увеличивается, то эффективность гибридизации уменьшается Правило Джилеспи Для непереходных элементов тип гибридизации центр. атома определяется по числу сигма- связей центр. атома с партнёрами и по числе неподелёyных электронных пар центр. атома. Для переходных элементов тип гибридизации центр. атома или иона определяется числом сигма- связей центр. атома с партнёрами (комплексные соединения) Метод отталкивания валентных электронных пар и геометрия молекул. НЭП, находящаяся на гибридных орбиталях центр. атома занимают больший объём в пространстве, чем связывающие электрон. пары, поэтому вызывается эффект межэлектронного отталкивания, приводящая к уменьшению валентного угла. Чем больше НЭП, тем меньше угол. Билет 24. Применение МВС для описания электронного строения комплексных соединений. Внутри- и внешнеорбитальные комплексы. Важнейшие типы гибридизации и пространственное строение комплексов. Сравнительная характеристика ТКП и МВС при описании комплексных соединений. Лиганды своим электрическим полем влияют на характер распределения электронов на валентных орбиталях центрального атома, это влияние определяется последовательностью, которое называется спектрохимический ряд лигандов. П 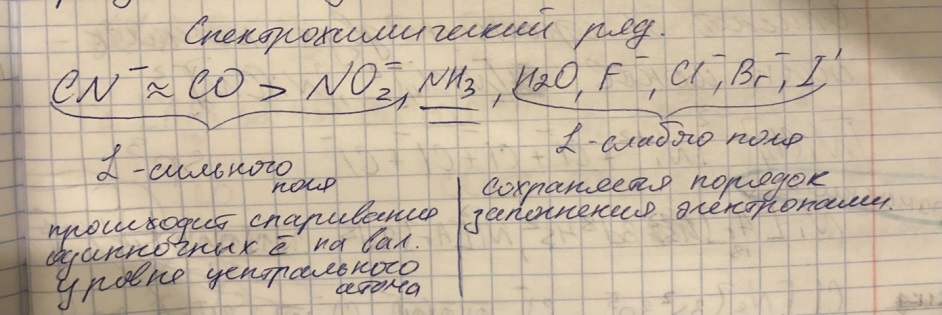 ри наличии на валентном уровне неспаренных электронов, возникает взаимодействие сложного комплексного иона с магнитным полем; внешнее магнитное поле втягивает структуру (парамагнитные комплексы). ри наличии на валентном уровне неспаренных электронов, возникает взаимодействие сложного комплексного иона с магнитным полем; внешнее магнитное поле втягивает структуру (парамагнитные комплексы).Если на валентных орбиталях все электроны спарены, эти структуры отталкиваются магнитным полем и называется диамагнитным комплексом. Ешне и внутриорбитальные КС. Например: [CoCN6]3-  Внутриорбитальные комплексы отличаются высокой устойчивостью. Если на образование σ-связей комплексообразователь поставляет только орбитали внешнего уровня, то осуществляется sр3d2 гибридизация. Её называют внешней, а образующиеся комплексы внешнеорбитальными. Такие комплексы образуют d-элементы с полностью заселёнными dподуровнями. Важнейшие типы гибридизации и пространственное строение комплексов. (таблица выше) Сравнительная характеристика ТКП и МВС при описании комплексных соединений. Теория кристаллического поля. • Многие растворы комплексных соединений – цветные. • Теория кристаллического поля объясняет цветность растворов комплексных соединений. • Теория кристаллического поля основана на предположении, что между комплексообразователем (его d- орбиталями) и лигандами осуществляется электростатическое взаимодействие с учетом пространственного распределения электронной плотности dорбиталей комплексообразователя. Теория кристаллического поля (ТКП) основана на предположении, что связи между иономкомплексообразователем и лигандами носят ионный или иондипольный характер. В рамках метода валентных связей считается, что между комплексообразователем и лигандами существует чисто ковалентная связь, которая реализуется по донорно акцепторному механизму. Лиганды представляют электронные пары, а ядро комплекса свободные орбитали. Орбитали центрального атома, участвующие в образовании связи гибридизуються. Тип гибридизации определяется числом, природой и электронной структурой лигандов. Гибридизация электронных орбиталей комплексообразователя определяет геометрию комплекса. Билет 25. Основные положения метода гипервалентных связей. Факторы, определяющие прочность гипервалентных связей. Валентные возможности и характерные степени окисления непереходных элементов. Метод гипервалентных связей (ГВС) – это метод, который рассматривает электронное строение элемента на основании совокупности 2-ух центровых 2-ух электронных связей, 3-ёх центровый 4-ёх и 2-ух электронных связей без участия d-обиталей центрального атома. Е 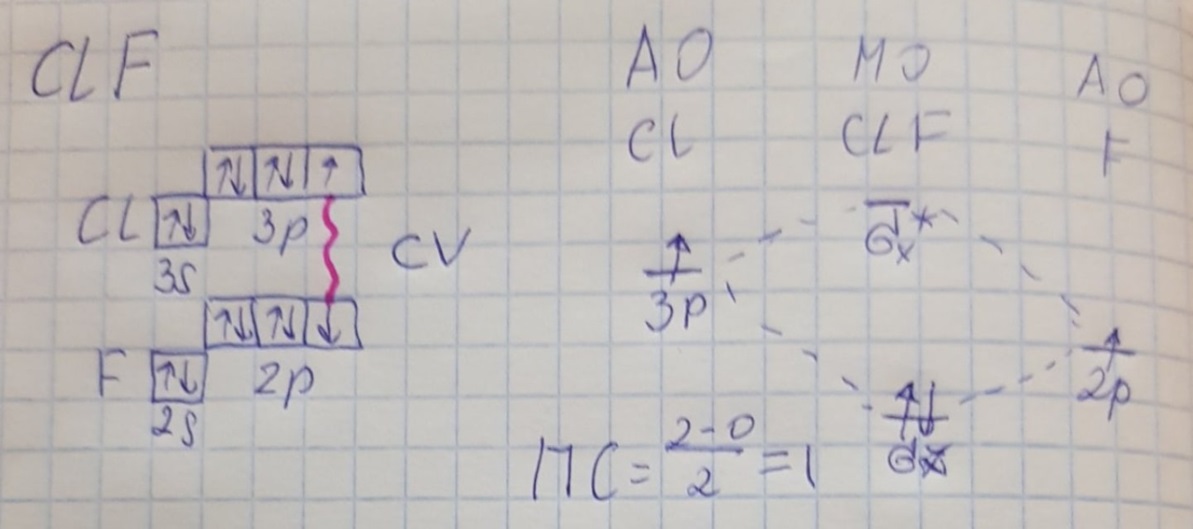 сть 3 типа взаимодействия, приводящие к образованию соединений непереходных элементов: сть 3 типа взаимодействия, приводящие к образованию соединений непереходных элементов:1.Ковалентные двухцентровые двухэлектронные химические связи (CV), образуются при участии p атомной орбитали центрального атома содержащей 1 неспаренный электрон и 1 атомной орбитали партнёра содержащей 1 неспаренный электрон. 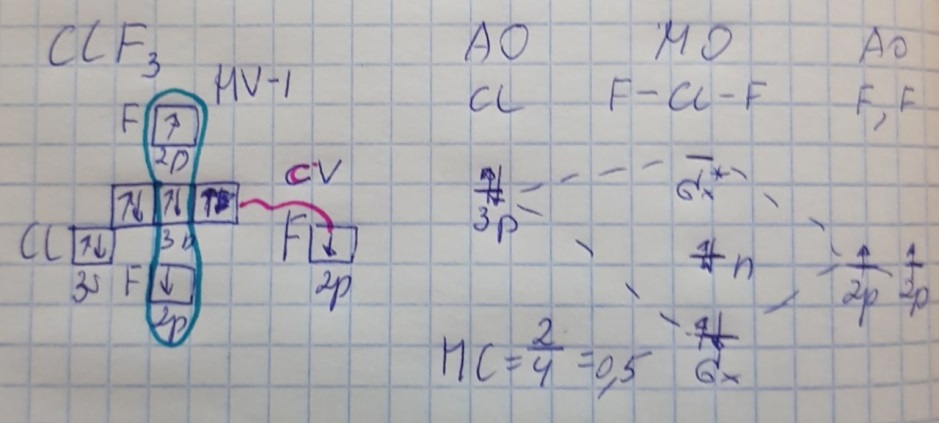 2 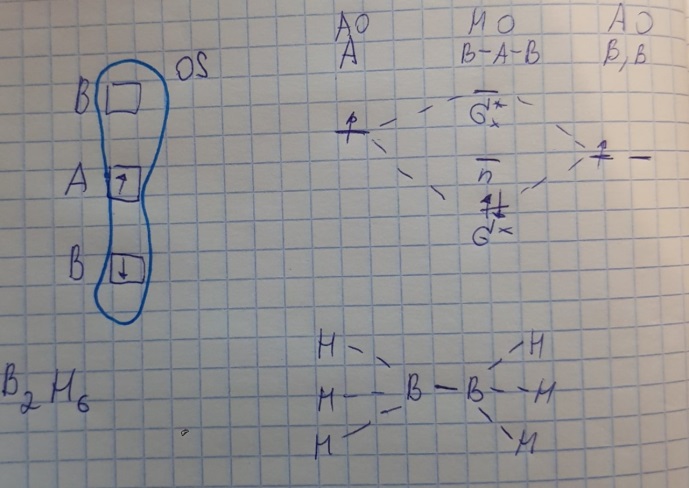 .Гипервалентные трёхцентровые четырёхэлектронные химические связи (HV), образуются при участии p атомной орбитали центрального атома содержащей спаренную электронную пару и 2-ух атомов партнёров содержащих на своих орбиталях по 1 неспаренному электрону. .Гипервалентные трёхцентровые четырёхэлектронные химические связи (HV), образуются при участии p атомной орбитали центрального атома содержащей спаренную электронную пару и 2-ух атомов партнёров содержащих на своих орбиталях по 1 неспаренному электрону. 3.Гипервалентные двухцентровые двухэлектронные, орбитально-избыточные химические связи (OS), образуются за счёт того, что центральный атом предоставляет атомную орбиталь с 1 неспаренным электроном и 2-ух атомов партнёров, у одного из которых атомная орбиталь с 1 неспаренным электроном, а у ругого атомная орбиталь без электрона. Поскольку энергия -связывающей МО, преимущественно локализованной на лигандах, в основном определяется энергетическим положением атомных орбиталей лигандов, то энергия гипервалентной Х-А-Х связи тем больше, чем больше энергетический зазор между исходными атомными орбиталями центрального атома и лигандов, т. е. чем больше разница в относительных электроотрицательностях между А и Х. Тем прочнее связь. (Теория) Гипервалентная связь тем прочнее, чем больше разница относительной электроотрицательности между центральным атомом и атомом партнёром. Валентные возможности и характерные степени окисления непереходных элементов. Надо уточнить у ЕИ будет ли этот вопрос. Я прикрепил файл по Гипервалентным связям. Билет 26. Модель ионной связи. Энергия ионной связи, координационные числа и стереохимия соединений. Поляризация ионов. 1.Основные положения метода ионных связей: - связь образуется за счет электростатического притяжения противоположно заряженных ионов - не направлена (ионы притягиваются к противоионам в любом направлении) - не насыщаема (один ион может притягивать неограниченное количество ионов) - ионные молекулы склонны к ассоциации ( соединению друг с другом) - поляризация (влияние ионов друг на друга, приводящее к деформации электронных оболочек ионов) - в природе не существует 100% ионных соединений - соединения с ионной связью – твердые кристаллические вещества, имеющие высокие температуры плавления и кипения (расвторимы в воде) 2.Энергия ионной связи – энергия, которую необходимо затратить для разрыва связей 1 моль вещества с образованием изолированных атомов. Она зависит от размеров ионов и их заряда. Чем меньше ионы и больше заряды, тем больше энергия. Координационное число – число связей, окружающих атом или ион в химическом соединении. Оно возрастает с увеличением размера катиона (по мере приближения отношения радиуса катиона к радиусу аниона к единице) 4 – квадрат 6 – октаэдр 8 – куб 3.Поляризация ионов – относительное смещение ядра и внешних электронов данного иона под действием электрического поля противоположно заряженного иона · Поляризуемость – склонность иона к деформации эл.оболочек под действием эл.поля другого иона (характерна для анионов) Чем больше радиус и больше отрицательный заряд, тем больше поляризуемость · Поляризующее действие – способность иона деформировать эл.оболочку другого иона (характерна для катионов) Чем меньше радиус и больше заряд, тем больше поляризующее действие Чем больше ПД катиона и больше П аниона, тем больше ковалентная составляющая (способность к деформации) Чем меньше ПД катиона и меньше П аниона, тем больше ионная составляющая (способность к деформации ниже) Билет 27. Факторы, определяющие поляризующее действие и поляризуемость. Явление самополяризации. Применение поляризационных представлений для предсказания характера изменений кислотно-основных свойств гидроксидов, а также формы существования и устойчивости в водных растворах металлокомплексов. |
