химия экзамен. все билеты химия учить. Виды энергии Механическая Тепловая Электрическая Световая
 Скачать 3.4 Mb. Скачать 3.4 Mb.
|
ПБилет 30. Энергия стабилизации кристаллическим полем. Применение ТКП для описания свойств комплексных соединений: стереохимии, окислительно-восстановительных свойств и устойчивости к реакциям замещения лигандов, оптических и магнитных свойств металла на величину энергии расщепления. Основные положения теории кристаллического поля Комплексное соединение существует и устойчиво благодаря электростатическому взаимодействию между центральным иона комплексообразователя и отрицательно заряженными лигандами или лигандами с высоким дипольным моментом. 1 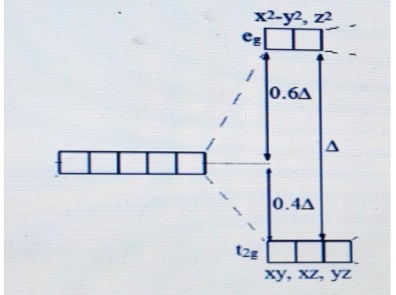 . Лиганды рассматривается как точечные заряды и точечные диполи без учёта их внутреннего строения . Лиганды рассматривается как точечные заряды и точечные диполи без учёта их внутреннего строения 2. Центральный ион комплексообразователь (ионы dэлементов) рассматривается с учетом его электронной структуры и её изменения под действием электрического поля лигандов. 3. Распределение электронов по валентным орбиталям центрального иона происходит в соответствии с принципом минимум энергии и принципом Паули. 4. Параметром расщепления кристаллическим полем — является разность энергии между расщеплёнными орбиталями, обозначается� или 10Dq. П 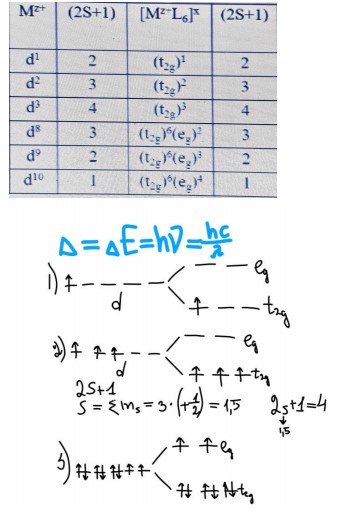 оскольку среднея энергия d орбиталей при переходе от сферически симметричного поля лигандов к октаэдрическому полю остаются неизменными, то относительное понижение энергии трёхкратно вырожденных t2g орбиталей происходит на величину 0,4� , а повышение энергии egорбиталей на 0,6� . Факторы, от которых зависит величина параметра расщепления кристаллическим полем: 1. Главное квантовое число: 2. Степень окисления металла: с увеличением степени окисления металла величина Δ увеличивается. Природа лиганда: наиболее распространенные лиганды могут быть расположены в ряду спектрохимическом ряду лигандов, по возрастанию величины дельта для их комлексов с ионами металлов в их обычном низшем окислительном состоянии. - оскольку среднея энергия d орбиталей при переходе от сферически симметричного поля лигандов к октаэдрическому полю остаются неизменными, то относительное понижение энергии трёхкратно вырожденных t2g орбиталей происходит на величину 0,4� , а повышение энергии egорбиталей на 0,6� . Факторы, от которых зависит величина параметра расщепления кристаллическим полем: 1. Главное квантовое число: 2. Степень окисления металла: с увеличением степени окисления металла величина Δ увеличивается. Природа лиганда: наиболее распространенные лиганды могут быть расположены в ряду спектрохимическом ряду лигандов, по возрастанию величины дельта для их комлексов с ионами металлов в их обычном низшем окислительном состоянии. -4. Геометрия лигандного окружения: величина параметра дельтаt для тетраэдрических комплексов составляет примерно 40-50% от величины Дельта 0 для аналогичных октаэдрических комплексов, что близко к теоретическому значению дельта t = 4/9 дельта 0. Высокоспиновые КС образуются легкими dэлементами и лигандами слабого порядка, а низкоспиновые наоборот, при чем если тяжелый d-элемент, но на лиганд все равно. С легким d-элементом с лигандом сильного поля тоже являются высокоспиновыми. d1 d2 d3 d8 d9 d10. для них порядок неизменный. для d4 d5 d6 d7 есть высокоспиновые и низкоспиновые комплексы, которые напрямую зависят от энергии межэлектронного отталкивания если D < Eм.о., то заполнение электронами t2g и eg орбиталей происходит в соответствии с правилом Хунда и спиновая мультиплетность таких Высокоспиновых комплексов совпадает с мультиплетностью свободного иона металла; если же D > Eм.о., то первоначально происходит полное заполнение электронами t2g орбиталей и только потом eg орбиталей; спиновая мультиплетность таких низкоспиновых комплексов уменьшается по сравнению со свободным ионом металла. Билет 31. Водородная связь и её основные характеристики. Описание водородной связи в рамках модели гипервалентных связей. Внутри- и межмолекулярная водородная связь. Влияние водородной связи на свойства химических соединений (характер изменения температур кипения и плавления в ряду водородных соединений элементов р-элементов, изменение плотности воды с температурой, процессы самоионизации NH3, H2O, HF). Билет 32. Ван-дер-ваальсовое межмолекулярное взаимодействие. Факторы, влияющие на эффективность дисперсионного, индукционного и ориентационного взаимодействия (привести примеры). |

 рименение поляризационных представлений для предсказания характера
рименение поляризационных представлений для предсказания характера 

