Методичка ОВР. Высшего профессионального образования
 Скачать 238.62 Kb. Скачать 238.62 Kb.
|
|
НАПРАВЛЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Направление самопроизвольного протекания ОВР определяется так же, как и у всех других реакций – по знаку изменения свободной энергии Гиббса (ΔG0х.р). Если в результате реакции свободная энергия системы убывает, то такая реакция термодинамически разрешена (ΔG0х.р<0). Для окислительно-восстановительных реакций существует взаимосвязь между изменением свободной энергии и электродвижущей силой (ЭДС): ΔG0х.р = -nFΔЕ (1) В этом уравнении n-число электронов, участвующих в ОВР, F 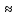 96500Кл/моль = 26,8 А∙час/моль – число Фарадея (эту величину часто называют одним фарадеем), ΔЕ – ЭДС окислительно-восстановительной системы. 96500Кл/моль = 26,8 А∙час/моль – число Фарадея (эту величину часто называют одним фарадеем), ΔЕ – ЭДС окислительно-восстановительной системы.Для стандартных условий: ΔG0х.р = -nFΔЕ0. Условие самопроизвольности реакции ΔG0х.р<0. В ур. (1) n и F -константы, следовательно, окислительно-восстановительная реакция термодинамически разрешена, если ΔЕ>0. В свою очередь, ЭДС рассчитывается как разность потенциала окислителя (Еок) и восстановителя (Eвосс): ΔЕ= Еок – Eвосс > 0. Из этого соотношения следует, что ОВР будет протекать самопроизвольно в прямом направлении, если Еок > Eвосс. Реальные ОВР начинают протекать самопроизвольно с заметной скоростью, если ЭДС системы превышает 0,4 В. ВЛИЯНИЕ ВНЕШНИХ ФАКТОРОВ НА ВЕЛИЧИНУ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА Величина окислительно-восстановительного потенциала (ОВ-потенциала) зависит от химической природы материала электрода, температуры, концентрации и природы потенциалопределяющих частиц в растворе. Эта зависимость выражается уравнением Нернста: 13 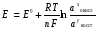 (2) (2)В этом уравнении Е – электродный потенциал (В); Е0- стандартный электродный потенциал (В); R = 8,31  универсальная газовая постоянная; Т-температура (К); n – число моль электронов в полуреакции; F–число Фарадея; aокисл-активность окисленной формы потенциалопределяющих частиц (моль/л); aвосст – активность восстановленной формы потенциалопределяющих частиц (моль/л). универсальная газовая постоянная; Т-температура (К); n – число моль электронов в полуреакции; F–число Фарадея; aокисл-активность окисленной формы потенциалопределяющих частиц (моль/л); aвосст – активность восстановленной формы потенциалопределяющих частиц (моль/л).Введем несколько упрощений: 1) при стандартной температуре 298К и переходе к десятичным логарифмам, получим 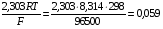 В; В; 2) для разбавленных растворов активности с достаточным приближением могут быть заменены концентрациями (aокисл=[окисл],aвосст =[восст]). В результате для стандартной температуры уравнение принимает следующий вид: 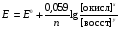 (3) (3) где «х» и «y» коэффициенты перед окисленной и восстановленной формой потенциалопределяющих частиц в ОВ-полуреакции. Например, для полуреакции окисления ионов Mn2+ Mn2++4H2O - 5  = MnO4- + 8H+, = MnO4- + 8H+,в которой слева – восстановленная форма потенциалопределяющих частиц, а справа – окисленная форма, уравнение Нернста для стандартной температуры будет иметь следующий вид:  Подлогарифмическое выражение является константой равновесия реакции: 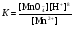 , поэтому уравнение (3) может быть представлено в , поэтому уравнение (3) может быть представлено в 14 следующем виде: 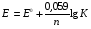 . (4) . (4)Если электродная система состоит из металлического электрода, опущенного в раствор, содержащий одноименные ионы Me0 - n  = Me+n, то уравнение Нернста при стандартной температуре приобретает следующий вид: = Me+n, то уравнение Нернста при стандартной температуре приобретает следующий вид: 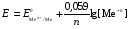 (5) (5)Для окислительно-восстановительных реакций исходя из соотношения ΔG0х.р = -nFΔЕ и lnK =- ΔG0х.р/RT можно вычислить значения константы равновесия: lnК= 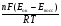 (6) (6)Еок – потенциал окислителя, Евосс- потенциал восстановителя. Для стандартной температуры и десятичных логарифмов: lgК=  . (7) . (7)ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ ПРИМЕР 1 Для реакции 2KBr + PbO2 + 4HNO3 = Pb(NO3)2 + Br2 + 2KNO3 + 2H2O установить направление возможного протекания ее при стандартных условиях. РЕШЕНИЕ . Запишем уравнение реакции в ионно-молекулярной форме: 2Br- + PbO2 + 4H+ = Pb2+ + Br2 + 2H2O. Затем представим его в виде полуреакций, с указанием табличных значений ОВ-потенциалов: 2Br- - 2ē = Br2 E0(Br2/Br-) = 1,065 В, восстановитель PbO2 + 4H+ + 2ē = Pb2+ + 4H2O E0(Pb2+/PbO2) = 1,449 В Окислитель 15 Потенциал окислителя Е0ок больше, чем потенциал восстановителя Е0восс, следовательно, приведенная реакция будет самопроизвольно протекать слева направо. ПРИМЕР 2. Могут ли в стандартных условиях одновременно находиться в растворе хлориды двухвалентного олова и трехвалентного железа? РЕШЕНИЕ. Представим данную систему в виде реакции SnCl2 + FeCl3 = SnCl4 + FeCl2 Определим по таблице значения стандартных электродных потенциалов полуреакций. Sn2+ - 2  = Sn4+ Е0восс = +0,151 В = Sn4+ Е0восс = +0,151 В2 Fe3+ +  = Fe2+ Е0ок = +0,771 В = Fe2+ Е0ок = +0,771 ВSn2+ +2Fe3+ = Sn4+ + 2Fe2+ В данном примере Еок > Eвосс, т.е. реакция в стандартных условиях будет протекать самопроизвольно в прямом направлении и, следовательно, указанные хлориды будут реагировать между собой, поэтому одновременное нахождение их в растворе невозможно. ПРИМЕР 3. Рассчитать константу равновесия окислительно-восстановительной системы при стандартных условиях: 10Br- + 2MnO4- + 16H+ = 5Br2 + 2Mn2+ + 8H2O, если E0(Br2/Br-) = 1,065В; E0(MnO4-/Mn2+) = 1,507В. РЕШЕНИЕ. Представим данную реакцию в виде полурекций окисления и восстановления: 2Br- -2ē = 5Br2 Е0восс = 1,065 В, MnO4- + 8H+ + 5ē = Mn2+ + 4H2O, E0ок = 1,507В Константа равновесия К окислительно-восстановительной реакции с окислительно-восстановительными потенциалами связана следующим соотношением: 16 lgК=  . .Окислителем в данной реакции является MnO4-, а восстановителем – Br-. В окислительно-восстановительном процессе участвуют 10 электронов. Отсюда: lgK = 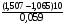 = 76,27, = 76,27,K =1,86.1076. ПРИМЕР 4. Рассчитайте равновесный потенциал электрода, на котором протекает реакция PbO2+ 4 H+ + 2ē ↔ Pb2+ + 2H2О, если  моль/л, а рН=5. моль/л, а рН=5.РЕШЕНИЕ. Потенциал окислительно-восстановительного электрода определяем по уравнению: 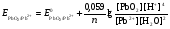 . .Концентрация 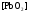 (как твердого вещества) и (как твердого вещества) и 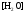 принимаются постоянными и включены в принимаются постоянными и включены в  =+1,449 В, n=2 –число электронов. С учетом этого, =+1,449 В, n=2 –число электронов. С учетом этого,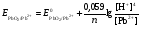 Исходя из того, что рН =-lg[H+] или [H+]= 10-рН , данное уравнение принимает вид: 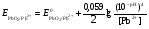 Подставляя значения Е0 и концентраций ионов, получаем 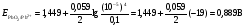 ПРИМЕР 5. Рассчитайте ЭДС окислительно-восстановительной системы 17 3Fe2+ + NO3- + 4H+ = NO + 3Fe3+ + 2H2O, если [Fe2+]=10-3 моль/л, [Fe3+]=10-2 моль/л, [NO3-]=10-1 моль/л, а рН=3. РЕШЕНИЕ. Выразим данную ОВ-систему в виде окислительно-восстановительных полурекций с указанием стандартных ОВ-потенциалов: а) Fe2+ - ē →Fe3+ 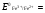 +0,771 В, +0,771 В,б) NO3- + 4H+ + 3ē → NO + 2H2O  +0,960 В. +0,960 В.Для реакции (а) определим ОВ-потенциал по уравнению (3): 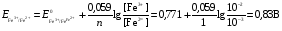 Для реакции (б) используем уравнение Нернста с учетом рН-среды: 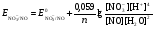 . .Имея ввиду, что активности [NO] и [H2O] являются постоянными и включены в значение Е0, а [H+]=10-рН, рассчитаем ОВ-потенциал реакции (б) по уравнению: 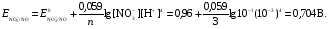 Затем рассчитаем ЭДС приведенной окислительно-восстановительной системы: ЭДС= ΔЕ =Еокс – Евосст= 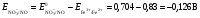 Так как ΔЕ <0, следовательно, реакция в прямом направлении протекать не может. ПРИМЕР 6.Могут ли в стандартных условиях KClO3 и КBr одновременно находиться в щелочном растворе? Если нет, то укажите возможные продукты окисления и восстановления. РЕШЕНИЕ. В бромиде калия КBr бром имеет низшую степень окисления -1 (Br-1), следовательно, он может проявлять только восстановительные свойства. В щелочной среде возможны следующие реакции окисления Br-1: а) Br-1 + 6ОН- - 6ē = BrО3-1 + 3Н2О Е0 = +0,61В б) Br-1 + 2ОН- - 2ē = BrО-1 + Н2О Е0 = +0,76В. 18 В ионе ClO3- хлор находится в промежуточной степени окисления +5. В случае совместного нахождения в растворе с восстановителем (КBr), KClO3 будет проявлять только окислительные свойства. В щелочном растворе возможно восстановления ClO3- по реакции: ClO3- + 3Н2О +6е = Cl- + 6ОН- Е0 = +0,63В. Сравнивая потенциалы окислителя и восстановителя, можно сделать вывод, что реакция окисления Br-1 по реакции (б) не может протекать, потому что Еок < Eвосс. Окисление же Br-1 в присутствии KClO3 по реакция (а) возможно: Br-1 + 6ОН- - 6ē = BrО3-1 + 3Н2О + ClO3- + 3Н2О +6ē = Cl- + 6ОН- Br-1 + 6ОН- + ClO3- + 3Н2О = BrО3-1 + 3Н2О + Cl- + 6ОН- KClO3 + КBr = КBrО3+ КCl Таким образом, KClO3 и КBr одновременно находиться в щелочном растворе не могут, а вероятные продукты реакции - KCl и К BrО3. ПРИМЕР 7. Может ли пероксид водорода H2O2 проявлять окислительные и восстановительные свойства? На основании стандартных электродных потенциалов привести примеры возможных реакций. РЕШЕНИЕ. Пероксид водорода H2O2 имеет в своем составе кислород в промежуточной степени окисления (-1), поэтому он может проявлять как окислительные, так и восстановительные свойства. Например, в кислой среде восстановление H2O2 протекает по реакции: H2O2 + 2H+ + 2ē = 2H2O E0 =1,776 B. Окисление H2O2 протекает по реакции: H2O2 -2ē = О2 + 2Н+ E0 =0,682 B. Чтобы в ОВ-реакции H2O2 проявлял окислительные свойства, надо по окислительно-восстановительным потенциалам выбрать восстановитель, у которого потенциал был меньше 1,776 В. Например, ион I- для которого: 2 I-1 - 2ē = I2 Е0 = +0,536В. 19 Таким образом: H2O2 + 2H+ + 2ē = 2H2O 2 I-1 - 2ē = I2 H2O2 + 2H+ + 2 I-1 = I2 + 2H2O. Чтобы в ОВ-реакции H2O2 проявлял восстановительные свойства, надо по окислительно-восстановительным потенциалам выбрать окислитель, у которого потенциал был больше 0,682 В. Например, ион ClO3- для которого: 2ClO3- + 12H+ + 10е = Cl2 + 6 H2O Е0 = +1,47В. Таким образом: H2O2 -2ē = О2 + 2Н+ 5 2ClO3- + 12H+ + 10ē = Cl2 + 6 H2O 5H2O2 -2ClO3- + 12H+ = 5О2 + 10Н+ + Cl2 + 6 H2O. Сократив в правой части ионы водорода (Н+), получаем: 5H2O2 -2ClO3- + 2H+ = 5О2 + Cl2 + 6 H2O. ПРИМЕР 8. Какой из металлов никель или кадмий легче взаимодействует с разбавленной HCl? РЕШЕНИЕ. Запишим уравнения реакции взаимодействия этих металлов с HCl: а) Ni + 2 HCl → NiCl2 + H2 Ni – 2ē = Ni2+ E0 = -0,25 B 2Н+ + 2ē =Н2 Е0 = 0,0В б) Cd + 2 HCl → CdCl2 + H2 Cd – 2ē = Cd 2+ E0 = -0,403 B 2Н+ + 2ē =Н2 Е0 = 0,0В Рассчитаем для обеих реакций изменение свободной энергии Гиббса по формуле ΔGх.р.0= -nF (Е0окс – Е0восст). Для реакции (а) ΔGх.р. = -2.96500.(0,0 + 0,25)= -48250 Дж. Для реакции (б) ΔGх.р. = -2.96500.(0,0 + 0,403)= -77779 Дж. 20 Так как в реакции (б) убыль свободной энергии Гиббса больше, чем в реакции (а), следовательно, кадмий легче взаимодействует с HCl. ПРИМЕР 9. На основании окислительно-восстановительных потенциалов реакций восстановления иона ClО3- определите, в какой среде, нейтральной или кислой, ClО3- проявляет более сильные окислительные свойства. РЕШЕНИЕ. Представим возможные реакции восстановления иона ClО3- в нейтральной и кислой средах: C1О3- + 3H2O + 6ē = Cl- + 6ОH- E0 =0,63 B 2C1О3- + 12H+ +10ē = Cl2 + 6Н2О E0 =1,47 B Процесс протекает тем глубже, чем отрицательнее ΔGхр. Из соотношения ΔG0х.р = -nF(Е0ок – E0восс ) следует: чем выше потенциал окислителя, тем меньше ΔG0хр. В кислой среде ОВ-потенциал иона ClО3- больше, значит, в кислой среде он проявляет более сильные окислительные свойства. Задания 1. Можно ли при стандартных условиях восстановить ионы Fe3+ ионами таллия Tl+ по реакции 2Fe3+ + Tl+ = 2Fe2+ + Tl3+ ? 2. Могут ли при стандартных условиях находиться одновременно в растворе селенистая кислота H2SeO3 и йодистоводородная HI ? 3. Какие из приведенных реакций могут самопроизвольно протекать в нейтральном водном растворе? а) MnO4- + Cl-→ MnO2 + Cl2; б) MnO4- + Br-→ MnO2 + Br2; в) MnO4- + I- → MnO2 + I2. 21 4. Можно ли при стандартных условиях окислить хлором сульфат железа (II) в сульфат железа (III)? 5. Можно ли металлическим цинком восстановить хлорид железа (III) в хлорид железа (II)? 6. Сопоставьте устойчивость растворов гидроксидов железа (II) и кобальта (II) к окислению кислородом воздуха по реакциям: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 4Co(OH)2 + O2 + 2H2O = 4Co(OH)3 7. Может ли при стандартных условиях идти реакция 2Fe2+ + 2Hg2+ = 2Fe3+ + Hg22+? 8. Определите возможность самопроизвольного протекания реакции при стандартных условиях 2KMnO4 + 16HF = 2MnF2 + 5F2 + 2KF + 8H2O 9. Определите возможность самопроизвольного протекания реакции при стандартных условиях 2KMnO4 + 16HBr = 2MnBr2 + 5Br2 + 2KBr + 8H2O 10. Определите возможность самопроизвольного протекания реакции при стандартных условиях 2FeO42- + 8H+ + 2Br- → Fe3+ + Br2 + 4H2O 11. Определите возможность самопроизвольного протекания реакции при стандартных условиях AsO43- + 2H2O + 2I- = AsO2- + I2 + 4OH- 12. Вычислите константу равновесия реакции 2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O 13. Определите направление реакции при стандартных условиях 2KMnO4 + 5H2S + 3H2SO4 = 2MnSO4 + 2S + K2SO4 + 8H2O 22 14. Какие из приведенных ниже систем Co3+ + ē = Co2+; Pb4+ + 2ē = Pb2+; I2 + 2ē = 2I- будут восстановителем, если в качестве окислителя использовать кислый раствор KMnO4 (pH=1) MnO4- + 8H+ + 5ē = Mn2+ + 4H2O 15. Может ли KNO2 быть восстановителем? окислителем? Используя таблицу значений стандартных окислительно-восстановительных потенциалов, приведите схемы возможных реакций. 16. Можно ли в стандартных условиях окислить ионы двухвалентного железа (Fe2+) ионами Sn4+ по схеме 2Fe2+ + Sn4+→ 2Fe3+ + Sn2+ 17. Вычислите константу равновесия реакции H3AsO4 + 2HI = HAsO2 + I2 + 2H2O. Можно ли считать это равновесие практически полностью смещенным вправо? 18. Какой из металлов (цинк, марганец или хром) легче взаимодействует с разбавленной HCl ? Ответ дайте на основании расчета. 19. Определите направление процессов при стандартных условиях. I2 + H2O = HIO3 + HI, I2 + KOH = KIO3 + KI + H2O. 20. В водном растворе концентрация [Hg2+]=10-2 моль/л, [(Fe3+]=10-2 моль/л, [Fe2+]=10-3 моль/л. В каком направлении реакция 2FeCl3 + Hg = 2FeCl2 + HgCl2 протекает самопроизвольно? 21. Можно ли восстановить хлорид олова (IV) в хлорид олова (II) по реакциям SnCl4 + 2KI = SnCl2 + I2 + 2KCl SnCl4 + H2S = SnCl2 + S + 2HCl Обоснуйте ответ расчетом констант равновесия реакций. 23 22. Рассчитайте при стандартных условиях константу равновесия реакции 2KMnO4 + 5HBr + 3H2SO4 = 2MnSO4 + 5HBrO + K2SO4 + 3H2O. 23. Пользуясь величинами E0, определите направление реакции Cu2+ + 2Ag = Cu + 2Ag+ 24. Растворение цинка в разбавленной азотной кислоте может идти так: а) Zn + HNO3→ Zn(NO3)2 + NO + H2O б) Zn + HNO3→ Zn(NO3)2 + NO2 + H2O Пользуясь величинами Е0 указать, какой процесс более выгоден в стандартных условиях? 25. Приведите пример окислительно-восстановительной реакции, потенциал которой зависит от pH среды, напишите уравнение для расчета окислительно-восстановительного потенциала для этой реакции. 26. Можно ли в качестве окислителя в кислой среде использовать K2Cr2O7 в следующих процессах при стандартных условиях: а) 2F- - 2ē = F2 б) 2Cl- - 2ē = Cl2 в) 2Br- - 2ē = Br2 г) 2I- - 2ē = I2 Стандартный окислительно-восстановительный потенциал системы Cr2O72- + 14H+ + 6ē = 2Cr3+ + 7H2O равен 1,33 В. 27. Можно ли KMnO4 использовать в качестве окислителя в следующих процессах при стандартных условиях: а) HNO2 + H2O – 2ē = NO3- + 3H+ б) 2H2O – 2ē = H2O2 + 2H+ в) H2S – 2ē = S + 2H+ 28. В каком направлении будет протекать реакция CrCl3 + Br2 + KOH = K2CrO4 + KBr + H2O ? 29. Возможна ли реакция между KClO3 и КmnO4 в кислой среде? 30. Какой из окислителей(MnO2, PbO2, K2Cr2O7) является наиболее эффективным по отношению к HCl с целью получения Cl2? 24 31. Можно ли при стандартных условиях окислить в кислой среде Fe2+ в Fe3+ с помощью дихромата калия (K2Cr2O7)? 32. Можно ли действием хлората (V) калия (KClO3) в нейтральной среде окислить: а) Fe2+ до Fe3+ б) SO42- до S2O82- в) Mn2+ до MnO4- г) Sn2+ до Sn4+ д) SO32- до SO42- е) NO2- до NO3- Напишите уравнения окислительно-восстановительных реакций. 33. Окислительно-восстановительный потенциал реакции Cr2O72- + 14H+ + 6ē = 2Cr3+ + 7H2O равен +1,33 В. Какие из следующих процессов возможны, если в качестве окислителя использовать кислый раствор дихромата калия (K2Cr2O7)? а) 2Br- - 2ē = Br2 б) 2Cl- - 2ē = Cl2 в) H2S – 2ē = 2H+ + S г) Mn2+ + 4H2O – 5ē = MnO4- + 8H+ д) HNO2 + H2O – 2ē = NO3- + 3H+ 34. Будет ли протекать реакция, в которой Cr3+ окисляется до Cr2O72-, а разбавленная HNO3 восстанавливается до NO? 35. При окислении соляной кислоты диоксидом марганца или перманганатом калия образуется хлор. Процессы идут по схеме: MnO2 + HCl → MnCl2 + Cl2 + H2O KMnO4 + HCl→ MnCl2 + Cl2 + KCl + H2O В каком случае получится больше хлора, если для той и другой реакции взять равные количества соляной кислоты? 36. На основании значений окислительно-восстановительных потенциалов процессов восстановления перманганата-иона MnO4- в кислой, нейтральной и щелочной средах укажите: в каком случае ион MnO4- проявляет более высокую окислительную способность. 25 37. В каком направлении будет протекать реакция CuS + H2O2 + HCl = CuCl2 + S + H2O? 38. Можно ли при стандартных условиях окислить хлористый водород до Cl2 с помощью серной кислоты? 39. Вычислите окислительно-восстановительный потенциал для системы MnO4- + 8H+ + 5ē = Mn2+ + 4H2O, если [MnO4-]=10-5, [Mn2+]=10-2, [H+]=0,1 моль/л. 40. Рассчитайте ЭДС окислительно-восстановительной системы 6Fe2+ + ClO3- + 6H+ = Cl- + 6Fe3+ + 3H2O, если pH = 3, а концентрация ионов Fe2+, ClO3-, Cl- и Fe3+ соответственно равны моль/л: 10-2; 10-1; 1,0; 2,0. 41.Вычислите при стандартных условиях ЭДС окислительно-восстановительной системы, состоящей из электродов: S/H2S и NO3-/NO. Напишите уравнение протекающей реакции. 42. В подкисленный раствор смеси KCl, KBr и KI прибавлен раствор KMnO4. Какие галогенид-ионы могут быть окислены до свободного состояния действием перманганат-иона? Составить уравнения протекающих реакций. 43. В водном растворе концентрация [Hg2+]=0,01 моль/л, [Fe3+]=0,01 моль/л, [Fe2+]=0,001 моль/л. Какая из указанных реакций будет протекать: а) 2FeCl3 + Hg = 2FeCl2 + HgCl2 б) HgCl2 + 2FeCl2 = Hg + 2FeCl3 44. Вычислите константы равновесия для реакций: а) SnCl4 + 2TiCl3 = SnCl2 + 2TiCl4 б) SnCl4 + 2CrCl2 = SnCl2 + 2CrCl3 В какой из двух систем достигается более полное восстановление Sn4+ в Sn2+? 26 45. Какая кислота выполняет в реакции H2SeO3 + H2SO3 функцию окислителя, а какая – восстановителя ? 46. Методом ионно-электронных уравнений подберите коэффициенты в следующих окислительно-восстановительных реакциях. Укажите окислитель и восстановитель. Какой из элементов окисляется, какой восстанавливается? 1) Al + K2Cr2O7 + H2SO4→ Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O 2) Al + KMnO4 + H2SO4→ Al2(SO4)3 + MnSO4 + K2SO4 + H2O 3) MnO2 + KClO3 + KOH→ K2MnO4 + KCl + H2O 4) Bi2O3 + Br2 + KOH→ KBiO3 + KBr + H2O 5) SnCl2 + K2Cr2O7 + HCl → SnCl4 + CrCl3 + KCl + H2O 6) MgI2 + H2O2 + H2SO4→ I2 + MgSO4 + H2O 7) FeSO4 + KClO3 + H2SO4→Fe2(SO4)3 + KCl + H2O 8) KNO2 + K2Cr2O7 + H2SO4→ KNO3 + Cr2(SO4)3 + K2SO4 + H2O 9) MnO2 + O2 + KOH→ K2MnO4 + H2O 10) SO2 + FeCl3 + H2O→ H2SO4 + FeCl2 + HCl 11) H2S + K2Cr2O7 + H2SO4→ S + Cr2(SO4)3 + K2SO4 + H2O 12) H2SO3 + HIO3→ H2SO4 + HI 13) Zn + KMnO4 + H2SO4→ ZnSO4 + MnSO4 + K2SO4 + H2O 14) KMnO4 + KBr + H2SO4 → MnSO4 + Br2 + K2SO4 + H2O 15) SO2 + KMnO4 + H2O → K2SO4 + MnO2 + H2SO4 16) KI + KMnO4 + KOH → I2 + K2MnO4 + H2O 17) MnO2 + H2SO4→ MnSO4 + O2 + H2O 18) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O 19) KNO2 + KMnO4 + KOH → KNO3 + K2MnO4 + H2O 20) K2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O 21) NaCrO2 + H2O2 + NaOH→ Na2CrO4 + H2O 22) P + HNO3 + H2O → H3PO4 + NO 23) KMnO4 + H2S + H2SO4 → S + MnSO4 + K2SO4 + H2O 27 24) Fe2O3 + KNO3 + KOH→ K2FeO4 + KNO2 + H2O |
