Химия практикум Задачи.. химия. Химия практикум
 Скачать 142.64 Kb. Скачать 142.64 Kb.
|
|
Химия практикум. 1. В окислительно-восстановительных реакциях перекись водорода может проявлять как окислительные, так и восстановительные свойства, потому что кислород в ней имеет промежуточную степень окисления -1. а)H2O2 + Ag2O → 2Ag + O2↑ + H2O 2O- - 2e → O20 | 2 | 1восстановитель Ag+ + 1e → Ag0 | 1 | 2 окислитель б)H2O2 + 2KI → I2↓ + 2KOH 2I- - 2e → I20 | 1 | 1 восстановитель O- + 1e → O2- | 1 | 1 окислитель 2. Какую массу карбоната натрия необходимо добавить к 400 л воды, чтобы устранить жесткость, равную 3 м-экв? Na2CO3 это соль двухвалентная, Эквивалентность равна 2, эквивалентная масса равна половине молярной массы Mэкв=106/2=53 г/моль экв. m(Na2CO3)=400л·0,003моль экв./л·53г/моль экв.=63,6 г 3. Для олова наиболее характерна степень окисления +4, а для свинца +2. Sn + 4HNO3(конц. ) = SnO2↓ + 4NO2↑ + 2H2O Sn0 - 4e → Sn+4 4 1 восстановитель N+5 + 1e → N+4 1 4 окислитель Pb + 2HNO3(конц. ) = Pb(NO3)2 + 2NO2↑ + H2O Pb0 - 2e → Pb+2 2 1 восстановитель N+5 + 1e → N+4 1 2 окислитель 4. Способы получения диоксид углерода в промышленности. Диоксид углерода в промышленности получают из продуктов разложения природных карбонатов (например известняк): CaCO3 → CaO + CO2↑ Далее смесь газов пропускают через раствор карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат: K2CO3 + H2O + CO2 → 2KHCO3 Далее гидрокарбонат калия нагревают, и тем самым высвобождают углекислый газ: 2KHCO3 → K2CO3 + CO2↑ + H2O В пищевых целях используется газ, образующийся при спиртовом брожении: C12H22O11 + H2O -брожение→ 4C2H5OH + 4CO2↑ Также углекислый газ получают на установках разделения воздуха, как побочный продукт получения чистого кислорода, азота и аргона. Способы получения диоксид углерода в лабораторных условиях. Небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой: CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O Превращения: 2NaHCO3 → Na2CO3 + CO2↑ + H2O Ca(OH)2 + CO2 → CaCO3↓ + H2O CaCO3 + CO2 + H2O → Ca(HCO3)2 5. При постепенном прибавлении раствора KI к раствору Hg(NO3)2 образующийся вначале осадок растворяется. Какое комплексное соединение при этом получается? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций. 2KI + Hg(NO3)2 → HgI2↓ + 2KNO3 2K+ + 2I- + Hg2+ + 2NO3- → HgI2↓ + 2K+ + 2NO3- Hg2+ + 2I- → HgI2↓ Образуется комплекс тетраиодомеркурат (II) калия 2KI + HgI2 → K2[HgI4] 2K+ + 2I- + HgI2 → 2K+ + [HgI4]2- HgI2 + 2I- → [HgI4]2- 6. Хром получают методом алюмотермии из его оксида (III), а вольфрам восстановлением вольфрамового ангидрида (VI) водородом. Составьте электронные и молекулярные уравнения соответствующих реакций Cr2O3 + 2Al -t→ Al2O3 +2 Cr Al 0- 3e → Al3+ Cr3+ + 3e → Cr0 WO3 + 3H2 -t→ W + 3H2O H20 - 2e → 2H+ W6+ + 6e → W0 7. K2Cr2O7 + 4H2SO4 + 3H2O2= Cr2(SO4)3 + K2SO4 + 7H2O + 3O2 2NaCrO2+H2O2+4NaOH+3H2O=2Na3Cr(OH)6+3O2 8. 1) FeS + 2HCl = FeCl2 + H2S 2)2 H2S+3O2 →2SO2+2H2O 3) SO2 + 2NaOH = Н2O + Na2SO3 4) 8 Na2SO3 + S8 = 8 Na2S2O3 5) Na2S2O3 + 3 H2SO4 = 3 H2O + Na2SO4 + 4 SO2 9. Какой объём раствора NaOH (w=30% , p =1.328 г/см) необходимо добавить к 0.5л. 0.2 н. раствора Pl(NO3)2 что бы его полностью перевести в тетрагидроксоплюмбит Решение : Pb(NO3)2 + 4NaOH = Na2[Pb(OH)4] + 2NaNO3; в данной реакции ф.э. Pb(NO3)2 = 1/4, т.к. к.ч. Pb2+ = 4 ([Pb(OH)4]2-), следовательно, 0.2 Н р-р Pb(NO3)2 соответствует = 0.2*(1/4) = 0.05 моль/л; в 0.5 л 0.05 М раствора 0.05*0.5 = 0.025 моль Pb(NO3)2, для реакции с которым требуется 0.025*4 = 0.1 моль NaOH; V р-ра NaOH = (40*0.1):0.3:1.328 = 10.04 см3; 10. Определите массовую долю примесей в образце карбида кальция если при полном разложении образца водой из 1.8 кг. Образовалось 560л. ацетилена 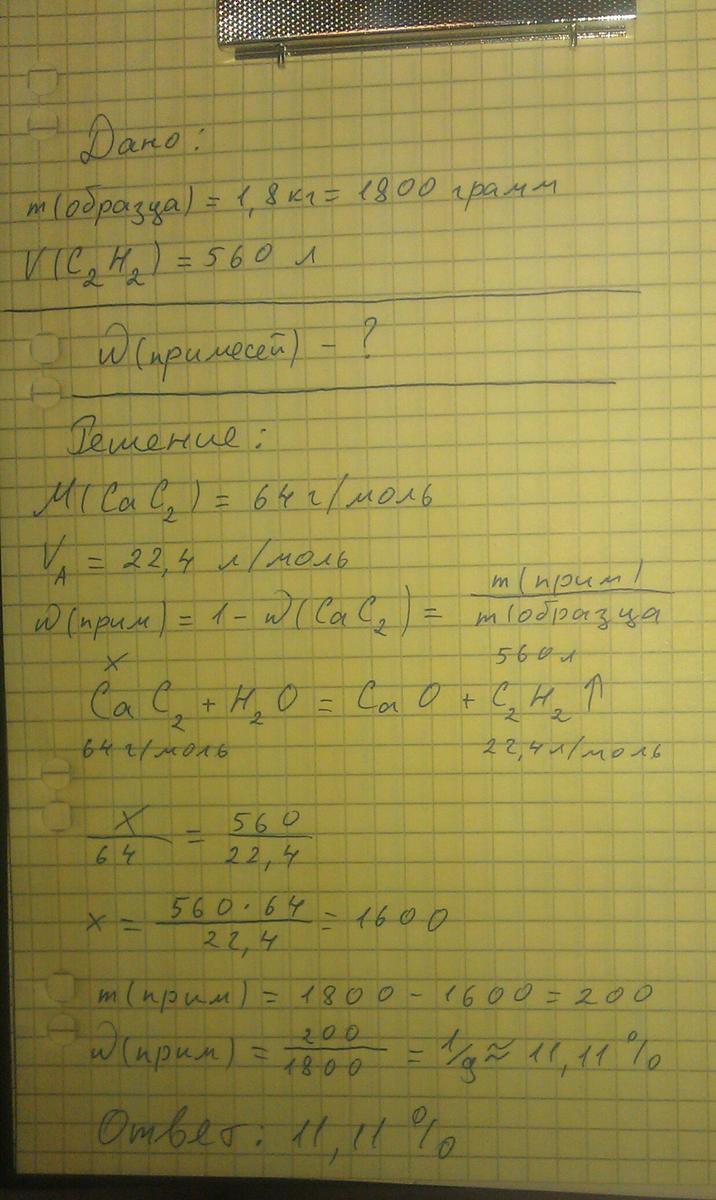 11. M(MnO2*nH2O) = 55+32 + 18*n w(Mn) = 0.445 55/(87+18n) = 0.445 87+18n=123.6 n=2 Значит, MnO2 *2H2O 12. w Cu = 0.496/0.8 = 0.62 или 62%, латунь растворили в разб. HNO3, тогда: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O и 3Zn + 8HNO3 = 3Zn(NO3)2 + 2NO + 4H2O; электролиз раствора Cu(NO3)2: 2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3. 13. Индий, галлий и таллий в свободном состоянии представляют собой серебристо-белые металлы с низкими температурами плавления, устойчивые к окислению кислородом воздуха. Воду они не разлагают, но легко растворяются в кислотах, а галлий и индий – также и в щелочах, т.е. химия галлия и индия напоминает химию алюминия. Таллий отличается тем, что для него более характерны соединения, в которых его степень окисления равна +1. Соединения таллия (I) сходны, с одной стороны, с соединениями щелочных металлов, с другой – с соединениями серебра. Так, Tl2O энергично соединяется с водой, образуя TlOH – сильное, хорошо растворимое в воде основание. Большинство солей таллия (I) хорошо растворимо в воде, но соли галогеноводородных кислот, как и соответствующие соли серебра, нерастворимы и отличаются светочувствительностью, однако, TlF, как и AgF, хорошо растворим в воде. Поскольку в главных подгруппах с увеличением порядкового номера элемента устойчивость высшей степени окисления уменьшается, соединения трёхвалентного таллия, в отличие от всех остальных элементов подгруппы, проявляют достаточно сильные окислительные свойства, превращаясь в соединения таллия (I) Эти элементы принадлежат к числу редких. Получают их главным образом из цинковых концентратов после выплавки из них цинка. В свободном состоянии эти элементы представляют собой серебристо-белые мягкие металлы с низкими температурами плавления. На воздухе они довольно стойки, воду не разлагают, но легко растворяются в кислотах, а галлий и индий-также и в щелочах. Кроме максимальной степени окисленности, равной +3, они могут проявлять и меньшую. Оксиды и гидроксиды галлия (III) и индия (II) амфотерны; гидроксид же таллия Tl(OH)3 обладает только основными свойствами. СольTlCl подобно AgCl почти нерастворима в воде и отличается светочувствительностью. Металлическим галлием пользуются для наполнения кварцевых термометров, служащих для измерения высоких температур до 10000 С. Добавление галлия к алюминию получают сплавы, хорошо поддающиеся горячей обработке; сплавы галлия с золотом применяют в ювелирном деле. Индий используют вместо серебра для покрытия рефлекторов, которые со временем не тускнеют, и потому их коэффициент отражения остается постоянным. Индий применяется также для покрытия вкладышей подшипников и в качестве одного из компонентов сплава для плавких предохранителей. Галлий и индий применяются в полупроводниковой электронике в качестве присадок к германию и в виде интерметаллических соединений. Галогениды таллия хорошо пропускают инфракрасные лучи. Поэтому они используются в оптических приборах, работающих в инфракрасной области спектра. Карбонат таллия служит для изготовления стекол с высокой преломляющей способностью. Сульфид таллия используется в фотоэлементах. Металлический таллий-компонент многих свинцовых сплавов: подшипниковых, кислотоупорных, легкоплавких. Таллий и его соединения весьма токсичны. 14. Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия). Металл средней активности, восстановитель. Основные степени окисления — +2, +3 Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Химические свойства простого вещества — железа:Ржавление и горение в кислороде 1) На воздухе железо легко окисляется в присутствии влаги (ржавление): 4Fe + 3O2 + 6H2 O → 4Fe(OH)3 Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II, III): 3Fe + 2O2 → Fe3O4 3Fe+2O2→(Fe IIFe2 III)O4 (160 °С) 2) При высокой температуре (700–900°C) железо реагирует с парами воды: 3Fe + 4H2O –t°→ Fe3O4 + 4H2 3) Железо реагирует с неметаллами при нагревании: 2Fe+3Cl2→2FeCl3 (200 °С) 2Fe + 3Br2 –t°→ 2FeBr3 Fe + S –t°→ FeS (600 °С) Fe+2S → Fe+2(S2-1) (700°С) 4) В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НСl и Н2SO4, при этом образуются соли железа(II) и выделяется водород: Fe + 2HCl → FeCl2 + H2 (реакции проводятся без доступа воздуха, иначе Fe+2 постепенно переводится кислородом в Fe+3 ) Fe + H2SO4(разб.) → FeSO4 + H2 В концентрированных кислотах–окислителях железо растворяется только при нагревании, оно сразу переходит в катион Fе3+: 2Fe + 6H2SO4(конц.) –t°→ Fe2(SO4)3 + 3SO2 + 6H2O Fe + 6HNO3(конц.) –t°→ Fe(NO3)3 + 3NO2 + 3H2O (на холоде концентрированные азотная и серная кислоты пассивируют железо). Железный гвоздь, погруженный в голубоватый раствор медного купороса, постепенно покрывается налетом красной металлической меди 5) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей. Fe + CuSO4 → FeSO4 + Cu 6)Амфотерность железа проявляется только в концентрированных щелочах при кипячении: Fе + 2NaОН (50 %) + 2Н2O= Nа2[Fе(ОН)4]↓+ Н2↑ и образуется осадок тетрагидроксоферрата(II) натрия. Техническое железо — сплавы железа с углеродом: чугун содержит 2,06-6,67 % С, сталь 0,02-2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Мn, Ni, Сr), что придает сплавам железа технически полезные свойства — твердость, термическую и коррозионную стойкость, ковкость и др. Доменный процесс производства чугунаДоменный процесс производства чугуна составляют следующие стадии: а) подготовка (обжиг) сульфидных и карбонатных руд — перевод в оксидную руду: FeS2→Fe2O3 (O2,800°С, -SO2) FeCO3→Fe2O3 (O2,500-600°С, -CO2) б) сжигание кокса при горячем дутье: С(кокс) + O2 (воздух) →СO2 (600—700°С) СO2 + С(кокс) ⇌ 2СО (700—1000 °С) в) восстановление оксидной руды угарным газом СО последовательно: Fe2O3→(CO) (FeIIFe2 III)O4→(CO) FeO→(CO) Fe г) науглероживание железа (до 6,67 % С) и расплавление чугуна: Fе(т)→(C(кокс) 900—1200°С)Fе(ж) (чугун, t пл 1145°С) В чугуне всегда в виде зерен присутствуют цементит Fe2С и графит. Производство сталиПередел чугуна в сталь проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева; температура процесса 1700-2000 °С. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (СО2, SО2), либо связываются в легко отделяемый шлак — смесь Са3(РO4)2 и СаSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов. Получение чистого железа в промышленности — электролиз раствора солей железа, например: FеСl2→ Fе↓ + Сl2↑ (90°С) (электролиз) (существуют и другие специальные методы, в том числе восстановление оксидов железа водородом). Чистое железо применяется в производстве специальных сплавов, при изготовлении сердечников электромагнитов и трансформаторов, чугун — в производстве литья и стали, сталь — как конструкционный и инструментальный материалы, в том числе износо-, жаро- и коррозионно-стойкие. Оксид железа(II) FеО. Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Fе2+ O2-. При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций: 4FеО ⇌(FeIIFe2 III) + Fе (560—700 °С , 900—1000°С) FеО + 2НС1 (разб.) = FеС12 + Н2O FеО + 4НNO3 (конц.) = Fе(NO3)3 +NO2↑ + 2Н2O FеО + 4NаОН =2Н2O + Nа4FеO3(красн.) триоксоферрат(II) (400—500 °С) FеО + Н2 =Н2O + Fе (особо чистое) (350°С) FеО + С(кокс) = Fе + СО (выше 1000 °С) FеО + СО = Fе + СO2 (900°С) 4FеО + 2Н2O(влага) + O2 (воздух) →4FеО(ОН) (t) 6FеО + O2 = 2(FeIIFe2 III )O4 (300—500°С) Получение в лаборатории: термическое разложение соединений железа (II) без доступа воздуха: Fе(ОН)2 = FеО + Н2O (150-200 °С) FеСОз = FеО + СO2 (490-550 °С) Оксид дижелеза (III) – железа(II) (FeIIFe2III )O4 . Двойной оксид. Черный, имеет ионное строение Fe2+(Fе3+)2(O2-)4. Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок (железный сурик), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий (чернение, воронение). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe3O4 не рекомендуется. Уравнения важнейших реакций: 2(FeIIFe2 III )O4 = 6FеО + O2 (выше 1538 °С) (FeIIFe2 III )O4 + 8НС1 (разб.) = FеС12 + 2FеС13 + 4Н2O (FeIIFe2 III )O4 +10НNO3 (конц.) =3Fе(NO3)3 + NO2↑+ 5Н2O (FeIIFe2 III )O4 + O2 (воздух) = 6Fе2O3 (450-600°С) (FeIIFe2 III )O4 + 4Н2 = 4Н2O + 3Fе (особо чистое, 1000 °С) (FeIIFe2 III )O4 + СО =ЗFеО + СO2 (500—800°C) (FeIIFe2 III )O4 + Fе ⇌4FеО (900—1000 °С , 560—700 °С) Получение: сгорание железа (см.) на воздухе. В природе — оксидная руда железа магнетит. Оксид железа(III) Fе2О3. Амфотерный оксид с преобладанием основных свойств. Красно-коричневый, имеет ионное строение (Fе 3+)2(O2-)3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Fе2O3 nН2О. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла. Уравнения важнейших реакций: 6Fе2O3 = 4(FeIIFe2 III )O4 +O2 (1200—1300 °С) Fе2O3 + 6НС1 (разб.) →2FеС13 + ЗН2O (t) (600°С,р) Fе2O3 + 2NaОН (конц.) →Н2O+ 2NаFеO2 (красн.) диоксоферрат(III) Fе2О3 + МО=(МIIFе2III)O4 (М=Сu, Мn, Fе, Ni, Zn) Fе2O3 + ЗН2 =ЗН2O+ 2Fе (особо чистое, 1050—1100 °С) Fе2O3 + Fе = ЗFеО (900 °С) 3Fе2O3 + СО = 2(FeIIFе2III)O4 + СO2 (400—600 °С) Получение в лаборатории — термическое разложение солей железа (III) на воздухе: Fе2(SO4)3 = Fе2O3 + 3SO3 (500-700 °С) 4{Fе(NO3)3 9 Н2O} = 2FеaO3 + 12NO2+ 3O2 + 36Н2O (600-700 °С) В природе — оксидные руды железа гематит Fе2O3 и лимонит Fе2O3 nН2O Гидроксид железа (II) Fе(ОН)2. Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Fе — ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов. Уравнения важнейших реакций: Fе(OН)2 = FеО + Н2O (150-200 °С, в атм.N2) Fе(ОН)2 + 2НС1 (разб.) =FеС12 + 2Н2O Fе(ОН)2 + 2NаОН (> 50%) = Nа2[Fе(ОН)4] ↓(сине-зеленый) (кипячение) 4Fе(ОН)2 (суспензия) + O2 (воздух) →4FеО(ОН)↓ + 2Н2O (t) 2Fе(ОН)2 (суспензия) +Н2O2 (разб.) = 2FеО(ОН)↓ + 2Н2O Fе(ОН)2 + КNO3 (конц.) = FеО(ОН)↓ + NO↑+ КОН (60 °С) Получение: осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере: Fе2+ + 2OH (разб.) = Fе(ОН)2↓ Fе2+ + 2(NH3Н2O) = Fе(ОН)2↓+ 2NH4 Метагидроксид железа FеО(ОН). Амфотерный гидроксид с преобладанием основных свойств. Светло-коричневый, связи Fе — О и Fе — ОН преимущественно ковалентные. При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Fе2O3 nН2O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в FеО(ОН). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Fе(ОН)2. Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе. Соединение состава Fе(ОН)3 не известно (не получено). Уравнения важнейших реакций: Fе2O3 . nН2O→(200-250 °С, —H2O) FеО(ОН)→( 560-700° С на воздухе , -H2O) →Fе2О3 FеО(ОН) + ЗНС1 (разб.) =FеС13 + 2Н2O FeO(OH)→Fe2O3.nH2O -коллоид (NаОН (конц.)) FеО(ОН)→Nа3[Fе(ОН)6] белый , Nа5[Fе(OН)8 желтоватый (75 °С, NаОН( т)) 2FеО(ОН) + Fе(ОН)2=( FeIIFe2 III )O4 + 2Н2O (600—1000 °С) 2FеО(ОН) + ЗН2 = 4Н2O+ 2Fе (особо чистое, 500—600 °С) 2FеО(ОН) + ЗВr2 + 10КОН = 2К2FеO4 + 6Н2O + 6КВr Получение: осаждение из раствора солей железа(Ш) гидрата Fе2О3 nН2O и его частичное обезвоживание (см. выше). В природе — оксидная руда железа лимонит Fе2O3 nН2О и минерал гётит FеО(ОН). Феррат калия К2FеО4. Оксосоль. Красно-фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель. Качественная реакция — образование красного осадка феррата бария. Применяется в синтезе ферритов — промышленно важных двойных оксидов железа (III) и других металлов. Уравнения важнейших реакций: 4К2FеO4= 4КFеO2 + 3O2 + 2К2O (700 °С) 4К2FеO4 + 6Н2O (гор.) =4FeО(ОН)↓ + 8КОН + 3O2↑ FеО42- + 2OН+ (разб.) =4Fе3+ + 3O2↑+10Н2O FеО42- + 2(NH3. Н2O) →2FеО(ОН)↓ + N2↑+ 2Н2O+ 4OН— FеО42- + Ва2+ = ВаFеO4 (красн.)↓ (в конц. КОН) Получение: образуется при окислении соединений железа, например метагидроксида FеО(ОН), бромной водой, а также при действии сильных окислителей (при спекании) на железо Fе + 2КОН + 2КNO3 = К2FеO4 + 3КNO2+ H2O (420 °С) и электролизе в растворе: электролиз Fе + 2КОН (конц.) + 2Н2O→ЗН2↑ + К2FеO4 ( электролиз) (феррат калия образуется на аноде). Качественные реакции на ионы Fе2+ и Fе3+ Обнаружение ионов Fе2+ и Fе3+в водном растворе проводят с помощью реактивов К3[Fе(СN)6] и К4[Fе(СN)6] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, КFеIII[FеII (СN)6]. В лаборатории этот осадок называют берлинская лазурь, или турнбуллева синь: Fе2+ + К+ + [Fе(СN)6]3- = КFеIII[FеII (СN) 6]↓ Fе3+ + К+ + [Fе(СN)6]4- = КFеIII[FеII (СN) 6]↓ Химические названия исходных реактивов и продукта реакций: К3FеIII[Fе(СN) 6]- гексацианоферрат (III) калия К4FеIII[Fе (СN) 6]- гексацианоферрат (II) калия КFеIII[FеII (СN) 6]- гексацианоферрат (II) железа (Ш) калия Кроме того, хорошим реактивом на ионы Fе3+ является тиоцианат-ион NСS—, железо (III) соединяется с ним, и появляется ярко-красная («кровавая») окраска: Fе3+ + 6NСS— = [Fе(NСS)6]3- Этим реактивом (например, в виде соли КNСS) можно обнаружить даже следы железа (III) в водопроводной воде, если она проходит через железные трубы, покрытые изнутри ржавчиной. |
