ВЛИЯНИЕ ДЛИНЫ СВЕТОВОЙ ВОЛНЫ НА СТРУКТУРНЫЕ ИЗМЕНЕНИЯ ОБЛУЧАЕМОЙ ВОДЫ.. Статья 2021_Штраус_docx doc. Влияние длины световой волны на структурные изменения облучаемой воды
 Скачать 117 Kb. Скачать 117 Kb.
|
|
УДК 4.896+544.032.6 ВЛИЯНИЕ ДЛИНЫ СВЕТОВОЙ ВОЛНЫ НА СТРУКТУРНЫЕ ИЗМЕНЕНИЯ ОБЛУЧАЕМОЙ ВОДЫ. Аннотация: В работе методом исследования температурной зависимости кинематической вязкости показано, что при действии на дистиллированную воду световым потоком разной длины волны происходит изменение структурной организации воды. На основании анализа литературных данных сделано предположение, что наблюдаемый эффект связан с разрушением сложных структурных образований – кластеров. Найдены термодинамические параметры, характеризующие структурную организацию воды и найдены зависимости этих параметров от длины волны светового облучения. Ключевые слова: кинематическая вязкость, температурные зависимости вязкости, энергия активации вязкого течения, дистиллированная вода, кластерная структур, энтропия состояния. INFLUENCE OF LIGHT WAVE LENGTH ON STRUCTURAL CHANGES IN IRRADIATED WATER. Strauss Sophia Alekseevna Korneeva Alexandra Yurievna Konnova Valeria Denisovna Scientific adviser: Komova Ninel Nikolaevna Abstract: In this work, by studying the temperature dependence of the kinematic viscosity, it is shown that when distilled water is exposed to a light flux of different wavelengths, the structural organization of water changes. Based on the analysis of literature data, it was assumed that the observed effect is associated with the destruction of complex structural formations - clusters. Thermodynamic parameters characterizing the structural organization of water are found and the dependences of these parameters on the wavelength of light irradiation are found. Key words: kinematic viscosity, temperature dependence of viscosity, activation energy of viscous flow, distilled water, cluster structures, entropy of state. Вода - самая важная жидкость для нашего существования и играет важную роль в физике, химии, биологии и геонауках. Вода является самым уникальным соединением по ряду необычных аномальных свойств. В нормальных условиях при температуре, близкой к температуре окружающей среды, это обычная простая жидкость, но при охлаждении такие её параметры, как сжимаемость, объёмная плотность, вязкость, поверхностное натяжение начинают изменяться. Эти особенные свойства воды связаны со способностью молекул воды образовывать до четырех четко определенных водородных связей, определяющих различные локальные структурные организации [1-3]. Способность образовывать до четырех водородных связей (Н-связей) в дополнение к ненаправленным взаимодействиям, наблюдаемым в простых жидкостях, приводит к таким необычным свойствам. Такое поведение воды обусловило возникновение жизни на планете Земля. С точки зрения термодинамики вода представляет собой особенный объект. Вода - это ассоциированная жидкость с большой диэлектрической проницаемостью и большим дипольным моментом у молекул. Последнее её свойство и приводит к самоорганизованности воды. Температурная зависимость изобарной теплоемкости (CP) и изотермической сжимаемости (κT) сначала уменьшаются с понижением температуры, но чуть выше температуры окружающей среды наблюдается изменение этой тенденции. При этом как теплоемкость, так и сжимаемость начинают увеличиваться при дальнейшем охлаждении, что приводит к минимуму при 308 K (35 ° C) и 319 K (46 ° C) соответственно [4-6]. Для воды характерно образование за счет водородных связей (Н-связи) надмолекулярных динамичных структур – кластеров с характерным временем перестройки порядка 10–10 – 10–11 с. Равновесие и кинетика переходов между кластерами должны подчиняться известным законам химической кинетики. Константы реакций и энергии их активаций могут дать информацию о специфике механизма надмолекулярной организации молекул воды, ответственной за аномалию ее термодинамических свойств. Кинетические характеристики процессов в воде можно определить из анализа линейных аппроксимаций температурных зависимостей ее свойств. Для воды характерно образование за счет водородных связей (Н-связи) надмолекулярных динамичных структур – кластеров с характерным временем перестройки порядка 10–10 – 10–11 с. Термодинамика кластерных структур может вносить свою лепту в процесс самоорганизации живых систем. Равновесие и кинетика переходов между кластерами, в принципе, должны подчиняться известным законам химической кинетики. Константы реакций и энергии их активаций могут дать информацию о специфике механизма надмолекулярной организации молекул воды, ответственного за ту или иную аномалию ее термодинамических свойств. Кинетические характеристики процессов в воде можно определить из анализа линейных аппроксимаций температурных зависимостей ее свойств. В настоящей работе проанализированы температурные зависимости кинематической вязкости жидкой воды и исследовано влияние монохроматического облучения разной длины волны (400,536 и 625 нм) на температурную зависимость вязкости от температуры. На основе теории Эйринга динамическая вязкость (η) определяется следующим образом [7]: ρ – плотность жидкости, R – универсальная газовая постоянная, NA – число Авогадро, h – постоянная Планка, M – молярная масса жидкости, G*- энергия активации Гиббса вязкого течения. Учитывая, что G*=Н*-Т S* [8] , (3) где Н*-изменение энтальпии вязкого течения, T-абсолютная температура, S*-изменение энтропии вязкого течения. Подставляя (3) в (1), получим Параметры Н* и S* также зависят от температуры. Однако, для бесконечно малого температурного интервала эти параметры можно считать постоянными и, используя соотношение (4), по экспериментальным данным определить значения соответствующих величин. Активационные параметры, характеризующие процесс вязкого течения, представляют собой разность соответствующих термодинамических параметров активного (Ga, Ha, Sa) и начального (Gн, Hн, Sн) состояний молекул одного моля жидкости [9]: G*= Ga- Gн; Н* = Ha- Hн; S*= Sa- Sн Энергия активации Гиббса (G*) вязкого течения – это энергия, требуемая для перехода 1 моля молекул жидкости из начального состояния в текучее состояние при данных давлении и температуре. Энтальпия активации (Н* ) вязкого течения является энергетической характеристикой изменений в растворе [10]. Энтропия активации вязкого течения (S* ) характеризует структурные изменения, происходящие в жидкости. Чем больше структурированной будет начальное состояние жидкости, тем меньше станет энтропия начального состояния (Sн) и тем больше будет ее изменение (Sа– Sн) при течении. Большему значению S* соответствует более структурированное состояние системы [9]. Экспериментальная часть. Предметом исследования являлась дисциллированная вода. Измерение кинематической вязкости проводилось с использованием капиллярного вискозиметра ВПЖ-4 в термостате с поддерживаемой и контролируемой температурой. Для облучения образцов дисциллированной воды использовали светофильтры, которые вырезали из потока полихроматического света свет с длиной волны 400,536 и 625 нм. Результаты исследований представлены на рис.1 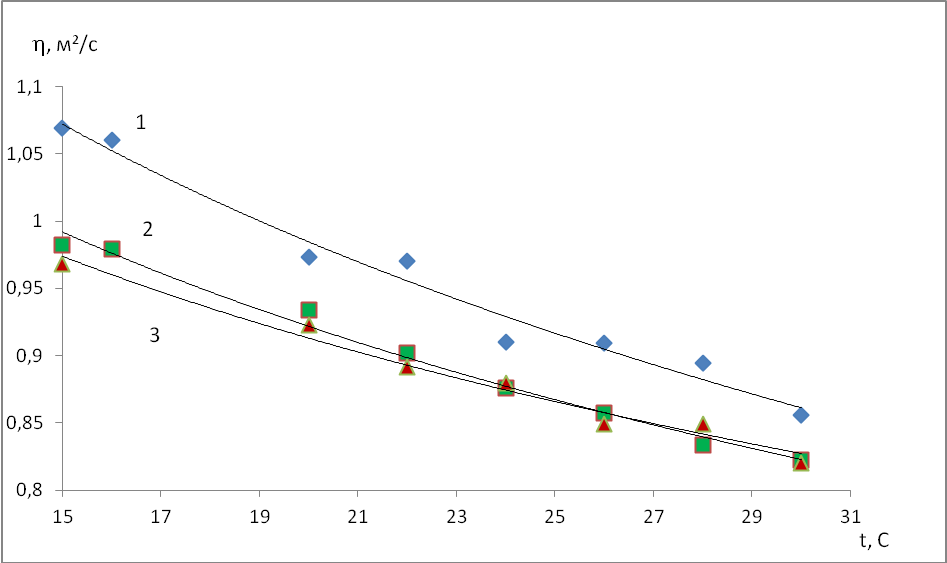 Рис. 1. Температурные зависимости кинематической вязкости воды при световом облучении в течение 5 мин. 1-полихроматический свет, 2-536 нм,3-620 нм. Рис. 1. Температурные зависимости кинематической вязкости воды при световом облучении в течение 5 мин. 1-полихроматический свет, 2-536 нм,3-620 нм.Представляя полученные данные в координатах уравнения (4) в виде графических зависимостей, найдены величины энтропии вязкого течения для образцов воды, подвергнутых облучению светом разных длин волн в течение 5 мин. Полученные значения сведены в таблицу. Значения энтропии вязкого течения дисцилированной воды, подвергнутой облучению светом видимого диапазона длин волн. Таблица.
Анализ полученных значений показывает, что в результате облучения происходят изменения в структуре воды, которое отражается в изменении энтропии системы. Исходя из полученных данных, можно заключить, что с увеличением длины световой волны видимого диапазона структурированность воды возрастает (рис.2). 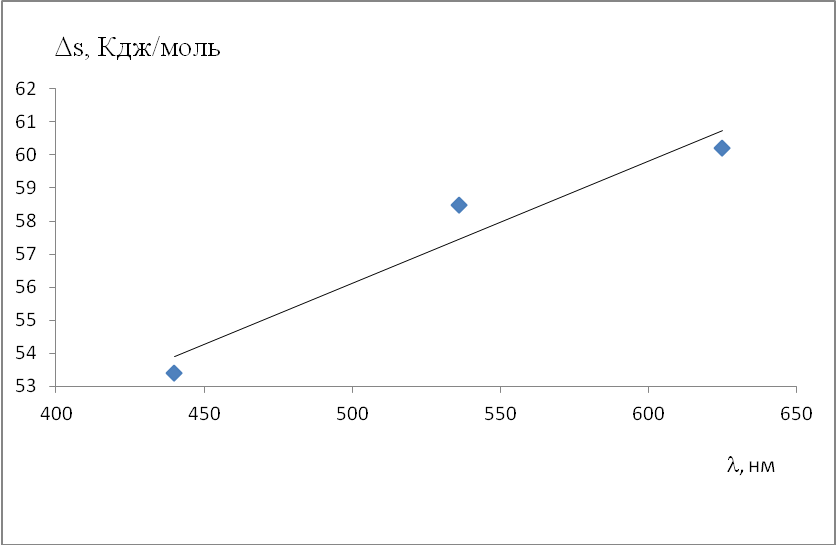 Рис.2. Зависимость энтропии вязкого течения облученной светом видимого диапазона от длины световой волны. Список литературы 1.Ball P. H2O: A Biography of Water Weidenfeld & Nicolson 1999. 152 p. 2. Kell, G. S. Isothermal compressibility of liquid water at 1 atm. //J. Chem. Eng. Data V.15. 1970P.119–122 . 2. Debenedetti, P. G. Supercooled and glassy water.// J. Phys. Condens. Matter V.15.2003. P/1669-1726 3. Kell, G. S. Isothermal compressibility of liquid water at 1 atm. J. Chem. Eng. Data V. 15. 1970. P.119–122 4. Speedy, R. J. & Angell, C. A. Isothermal compressibility of supercooled water and evidence for a thermodynamic singularity at −45 °C. //J. Chem. Phys. V.65.1976. P.851–858 5. Angell, C. A., Sichina, W. J. & Oguni, M. Heat capacity of water at extremes of supercooling and superheating.// J. Phys. Chem. V.86.1982.P. 998–1002 6. Kumar, P., Han, S. & Stanley, H. E. Anomalies of water and hydrogen bond dynamics in hydrophobic nanoconfinement.// J. Phys. Condens. Matter V.21.2009 P.504108 7. Masimov E.A., Pashayev B.G., Gasanov G.S., Gasanov N.G. Activation parameters of viscous flow of water, heavy water and extra heavy tritiated water.// Advances in Current Natural Sciences № 10, 2015. P.32-35 8. Масимов Э.А., Гасанов Г.Ш. // Термодинамика биологических систем. – Баку: Изд-во полиграфия «Леман»,2007. – 418 c. 9. Masimov E.A., Pashayev B.G., Hasanov H.Sh. // News of Baku university, series of physico-mathematical sciences. – 2010. – № 3. – Р. 109–116. 10. Масимов Э.А., Гасанов Г.Ш., Пашаев Б.Г. // Журнал физ. Химии. – 2013. – Т. 87, № 6. – С. 969–972. |
