Реферат. лекция 11. Внутренняя энергия газа. Работа и теплота как форма передачи энергии. Теплоемкость. Удельная теплоемкость. Уравнение теплового баланса Основные понятия
 Скачать 34.45 Kb. Скачать 34.45 Kb.
|
|
Внутренняя энергия газа. Работа и теплота как форма передачи энергии. Теплоемкость. Удельная теплоемкость. Уравнение теплового баланса Основные понятия: Термодинамическая система – физическая система, состоящая из большого числа частиц, которые совершают тепловое движение и взаимодействуют между собой. Термодинамические параметры – физические величины, однозначно описывающие состояние термодинамической системы. Равновесное состояние – состояние, в котором параметры термодинамической системы не меняются со временем. Термодинамический процесс – переход системы из начального состояния в конечное через последовательность промежуточных состояний. Внутренняя энергия – сумма кинетической энергии хаотического движения молекул, потенциальной энергия взаимодействия между молекулами и внутримолекулярной энергии. Работа и количество теплоты – способы изменения внутренней энергии тела. Теплоемкость – количество теплоты, затрачиваемое для повышения температуры тела на один кельвин. Обратимый процесс – процесс, при котором возможен обратный переход системы из конечного состояния в начальное через те же промежуточные состояния. Круговой процесс (цикл) – процесс, при котором система после ряда изменений возвращается в исходное состояние. Основные определения Термодинамика относится к феноменологическим теориям физики, которые имеют следующие общие черты: 1) они не рассматривают атомную структуру материи; 2) используют величины, которые определяются только для макроскопической системы; 3) построение теории основывается на известных опытных данных; 4) свойства вещества выражаются в форме характеристических параметров (плотность, вязкость и т.д.). Термодинамика изучает тепловые свойства макроскопических систем, не обращаясь к микроскопическому строению тел, составляющих систему. Она строится на базе нескольких основных принципов – начал термодинамики, которые представляют собой обобщение известных многочисленных опытных данных. Теоретическим изучением свойств вещества занимается статистическая физика, которая дала обоснование законов термодинамики и определила границу их применения. При изучении основ термодинамики необходимо знать следующие определения. Физическая система, состоящая из большого числа частиц – атомов или молекул, которые совершают тепловое движение и, взаимодействуя между собой, обмениваются энергиями, называется термодинамической системой. Состояние термодинамической системы определяется макроскопическими параметрами, важнейшими из которых являются: объем, давление и температура. Термодинамика рассматривает только равновесные состояния, т. е. состояния, в которых параметры термодинамической системы не меняются со временем. Если по координатным осям откладывать значения каких-либо двух параметров, то любое равновесное состояние системы может быть изображено точкой на этом графике. Термодинамическим процессом называется переход системы из начального состояния в конечное через последовательность промежуточных состояний. Если процесс протекает бесконечно медленно, то в этом случае состояние газа в каждый момент времени является равновесным, так что такой процесс будет состоять из последовательности равновесных состояний и будет называться равновесным. И 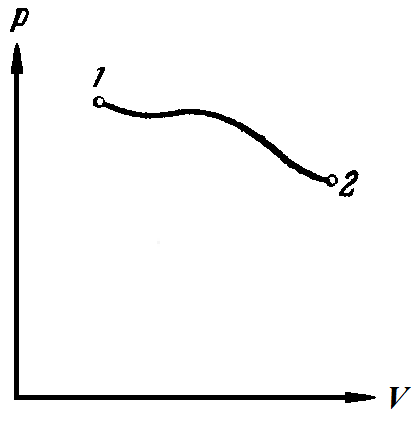 з сказанного следует, что равновесным может быть только бесконечно медленный процесс, поэтому равновесный процесс является абстракцией. з сказанного следует, что равновесным может быть только бесконечно медленный процесс, поэтому равновесный процесс является абстракцией. Равновесный процесс может быть изображен на графике соответствующей кривой (см. рис.). Понятия равновесного состояния и равновесного процесса играют большую роль в термодинамике. Все количественные выводы термодинамики строго применимы только к равновесным процессам. Внутренняя энергия системы. В понятие внутренней энергии включаются кинетическая энергия хаотического движения молекул, потенциальная энергия взаимодействия между молекулами и внутримолекулярная энергия. Внутренняя энергия системы тел равна сумме внутренних энергий каждого из тел в отдельности и энергии взаимодействия между телами, представляющей собой энергию межмолекулярного взаимодействия в тонком слое на границе между телами. Внутренняя энергия является функцией состояния системы. Изменение состояния системы характеризуется параметрами состояния р, V, Т. Одному и тому же состоянию системы соответствует определенное значение внутренней энергии U. При нагревании газа увеличивается скорость движения молекул и атомов, что приводит к увеличению внутренней энергии; следовательно, внутренняя энергия зависит от температуры. При изменении давления или удельного объема меняются межмолекулярные расстояния, т. е. потенциальная энергия взаимодействия атомов или молекул тоже изменяется, а значит, изменяется и внутренняя энергия. Началом отсчета внутренней энергии считается такое состояние системы, при котором внутренняя энергия равна нулю. Обычно считают, что внутренняя энергия равна нулю при Т = 0 К. При переходе системы из одного состояния в другое практический интерес представляет изменение внутренней энергии U, поэтому выбор начала отсчета внутренней энергии не имеет значения. Внутренняя энергия идеального газа. Газ, состоящий из отдельных атомов, а не молекул, называется одноатомным. К одноатомным газам относятся инертные газы – гелий, неон, аргон. В случае идеальных газов пренебрегают силами взаимодействия молекул, т. е. их потенциальная энергия полагается равной нулю, поэтому внутренняя энергия идеального газа представляет собой кинетическую энергию теплового движения молекул. Средняя кинетическая энергия поступательного движения молекулы (одноатомной) равна 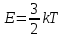 . Определим внутреннюю энергию идеального одноатомного газа массой m. Для этого среднюю энергию одного атома надо умножить на число атомов. В 1 моль содержится NA атомов, в газе массой то содержится = m/М моль, поэтому внутренняя энергия идеального одноатомного газа . Определим внутреннюю энергию идеального одноатомного газа массой m. Для этого среднюю энергию одного атома надо умножить на число атомов. В 1 моль содержится NA атомов, в газе массой то содержится = m/М моль, поэтому внутренняя энергия идеального одноатомного газа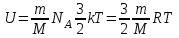 , , так как kNA = R. Внутренняя энергия идеального газа пропорциональна массе газа и его термодинамической температуре. Молекула одноатомного газа принимается за материальную точку, так как масса атома сосредоточена в основном в ядре, размеры которого малы. Положение одноатомной молекулы в пространстве однозначно задается тремя координатами. Говорят, что одноатомный газ имеет три степени свободы (i = 3). Эта молекула движется только поступательно. Вследствие того что молекула находится в хаотическом движении, все направления ее движения являются равноправными, т. е. средняя кинетическая энергия хаотического теплового движения молекулы равномерно распределена между тремя степенями свободы. На каждую степень свободы поступательного движения одноатомной молекулы приходится одинаковая кинетическая энергия, равная 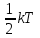 . .Молекула двухатомного газа представляет собой два атома, жестко связанных между собой. Эти молекулы не только движутся поступательно, но и вращаются. Такая молекула кроме трех степеней свободы поступательного движения имеет две степени свободы вращательного движения, т. е. i = 5. Если газ многоатомный, то i = 6. Внутренняя энергия многоатомного газа представляет собой кинетическую энергию всех движений частиц. Все степени свободы многоатомной молекулы являются равноправными, поэтому они вносят одинаковый вклад в ее среднюю кинетическую энергию: 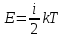 Внутренняя энергия многоатомного идеального газа массы m равна 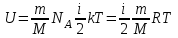 . .Теплоемкость. При сообщении системе теплоты Q ее температура изменяется на 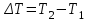 . Величина . Величина 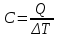 называется теплоемкостью. Теплоемкость измеряется количеством теплоты, затрачиваемым для повышения температуры тела на один кельвин. Нагревая тела с одинаковыми массами, но состоящие из различных веществ, можно обнаружить, что для повышения их температуры на 1 К требуются различные количества теплоты; следовательно, теплоемкость тела зависит от его природы. Теплоемкость зависит, очевидно, от массы тела. Теплоемкость, отнесенная к массе тела, называется удельной 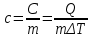 . .Зная теплоемкость вещества, можно определить количество теплоты, необходимое для нагревания тела массой m от температуры T1 до температуры T2: 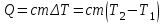 . .Теплоемкость зависит от условий, в которых телу сообщается теплота и изменяется его температура. Например, если газу сообщается количество теплоты Q и при этом газ расширяется, совершая работу, то его температура поднимается меньше, чем если бы при сообщении теплоты Q газ не расширился. Этот пример показывает, что выражение для теплоемкости не является определенным и может быть равным любому значению. Для придания теплоемкости определенного значения необходимо указать условия, о которых идет речь. Эти условия обозначаются в виде индексов у величин, входящих в выражение для теплоемкости. Теплоемкость при постоянном объеме определяется как 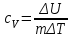 . . В термодинамике используется также теплоемкость при постоянном давлении, но выражение для нее приводить здесь не будем. |
