ауе. Внутренняя энергия и работа идеального газа
 Скачать 204.97 Kb. Скачать 204.97 Kb.
|
|
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ САЛАВАТСКИЙ ИНДУСТРИАЛЬНЫЙ КОЛЛЕДЖ ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА на тему: ВНУТРЕННЯЯ ЭНЕРГИЯ И РАБОТА ИДЕАЛЬНОГО ГАЗА Работу выполнил(а): Студент группы 1СВОД Валеев Тимур Абрамович Проверил(а): Преподаватель Физики Муратова Гульназ Галинуровна Салават-2022 Содержание Введение………………………………………………………………………….…...3 Модель идеального газа…………………………………………………….………..4 Идеальный газ, определение и свойства………………..…………………………..5 Среднеквадратичная скорость ……………...……..………………………………..5 Давление газа……………………………………….………………………………...7 Эксперимент………………………………………………………………...…..……8 Зависимость давления от других велечин…………………………..…………..….8 Зависимость давления от температуры…………………………………………………………..…..10 Основное уравнение МКТ…………………………………………………………………………..…..…...12 Хранение и транспортировка газов………………………………………………..15 Заключение…………………………………………………………………….……16 Литература………………………………………………………..…………….…...17 2 Введение Идеа́льный газ — теоретическая модель, широко применяемая для описания свойств и поведения реальных газов при умеренных давлениях и температурах. В этой модели, во-первых, предполагается, что составляющие газ частицы не взаимодействуют друг с другом, то есть их размеры пренебрежимо малы, поэтому в объёме, занятом идеальным газом, нет взаимных столкновений частиц. Частицы идеального газа претерпевают столкновения только со стенками сосуда. Второе предположение: между частицами газа нет дальнодействующего взаимодействия, например, электростатического или гравитационного. Дополнительное условие упругих столкновений между молекулами и стенками сосуда в рамках молекулярно-кинетической теории приводит к термодинамике идеального газа В различных расширенных моделях идеального газа предполагается, что частицы имеют внутреннюю структуру и протяжённые размеры, что можно представить частицы в виде эллипсоидов или сфер, соединённых упругими связями (например, двухатомные молекулы). Представление частиц газа в виде многоатомных молекул приводит к возникновению дополнительных степеней свободы, что побуждает учитывать энергию не только поступательного, но и вращательно-колебательного движения частиц, а также не только центральные, но и нецентральные столкновения частиц[1]. Модель широко применяется для решения задач термодинамики газов и аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с достаточной для практических расчётов точностью хорошо описывается моделью идеального газа. 3 Модель идеального газаВ физике есть такое понятие, как модель. Модель — это что-то идеализированное, она нужна в случаях, когда можно пренебречь некоторыми параметрами объекта или процесса. Идеальный газ — это модель реального газа. Молекулы идеального газа представляют собой материальные точки, которые не взаимодействуют друг с другом на расстоянии, но взаимодействуют при столкновениях друг с другом или со стенками сосуда. При работе с идеальным газом можно пренебречь потенциальной энергией молекул (но не кинетической). Важно знать: Модель идеального газа не может описать ситуацию, когда газ сжимают так сильно, что он конденсируется — переходит в жидкое состояние. В повседневной жизни идеальный газ, конечно, не встречается. Но реальный газ может вести себя почти как идеальный. Такое случается, если среднее расстояние между молекулами во много раз больше их размеров, то есть если газ очень разреженный. 4 Идеальный газ, определение и свойства. Газы, молекулы которых не обладают силами взаимодействия, а сами молекулы представляют собой материальные точки с ничтожно малыми объёмами, называются идеальными газами. Понятие об идеальном газе введено для упрощения изучения термодинамических процессов и получения более простых расчётных формул. Свойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения: Расстояние между молекулами значительно больше размеров молекул Молекулы газа очень малы и представляют собой упругие шары. Силы притяжения между молекулами пренебрежимо малы. Молекулы взаимодействуют только при соударениях. Молекулы движутся хаотично. Молекулы движутся по законам Ньютона. Среднеквадратичная скоростьПотенциальной энергией молекул газа пренебречь можно, а вот кинетической — никак нельзя. Потому что кинетическая энергия — это энергия движения, а мы не можем пренебрегать скоростью движения молекул. На графике показано распределение Максвелла — то, как молекулы распределяются по скоростям. Судя по графику, большинство молекул движутся со средним значением скорости. Хотя есть и быстрые, и медленные молекулы, просто их значительно меньше. 5 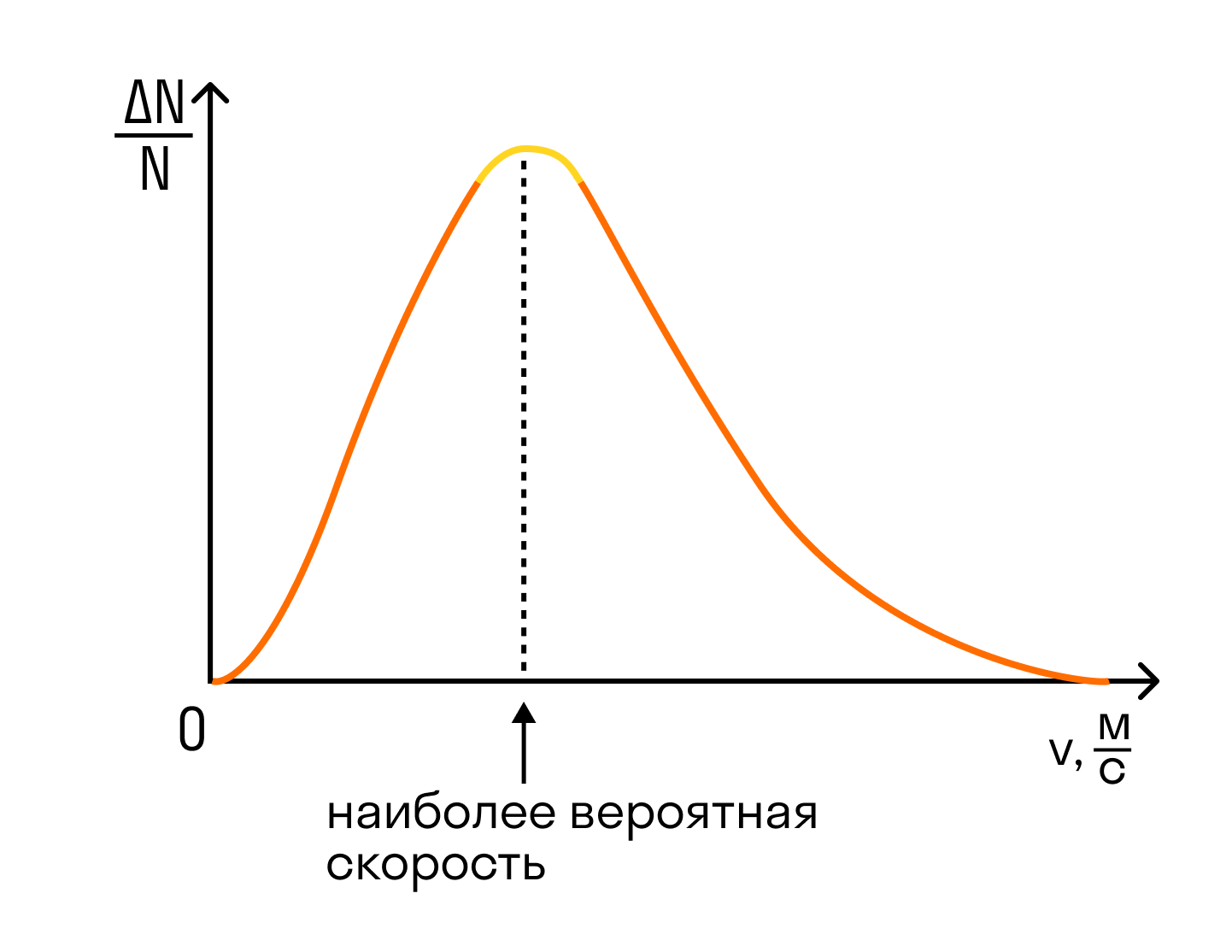 Но наш газ идеальный, а в идеальном газе случаются чудеса. Одно из таких чудес — то, что все молекулы идеального газа двигаются с одинаковой скоростью. Эта скорость называется средней квадратичной. Средняя квадратичная скорость 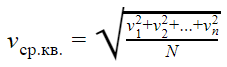 v1, v2, vn — скорости разных молекул [м/с] N — количество молекул [-] 6 Давление газа Давление газа возникает в результате беспорядочных ударов молекул о стенки сосуда, в котором находится газ. Используя модель идеального газа, можно вычислить давление газа на стенку сосуда. В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменной.  Приборы, измеряющие давление, называют манометрами. Манометры фиксируют среднюю по времени силу давления, приходящуюся на единицу площади его чувствительного элемента (мембраны) или другого приемника давления.  7 ЭкспериментЧтобы смоделировать давление газа, возьмите песок и лист бумаги, зажатый между двумя книгами. Песчинки будут выступать в роли молекул газа, а лист — в роли сосуда, в котором этот газ находится. Когда вы начинаете сыпать песок на лист бумаги, бумага отклоняется под воздействием множества песчинок. Так же и молекулы газа оказывают давление на стенки сосуда, в котором находятся.  Зависимость давления от других величинЗависимость давления от объемаВ механике есть формула давления, которая показывает, что давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается. Давление p = F/S F — сила [Н] S — площадь [м2 8 то есть если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы толкали грузовой автомобиль, — просто потому, что легковушка меньше грузовика. Из формулы давления следует, что давление на легковой автомобиль будет больше из-за его меньшей площади. Рассмотрим аналогичный пример с двумя сосудами разной площади.  Давление в левом сосуде будет больше, чем во втором, потому что его площадь меньше. А раз меньше площадь сосуда, то меньше и его объем. Значит, давление зависит от объема следующим образом: чем больше объем, тем меньше давление, и наоборот. При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):  9 Зависимость давления от объема называется законом Бойля-Мариотта. Она экспериментально проверяется с помощью такой установки:  Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается. Зависимость давления от температурыРассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Исследования в этой области впервые провел французский изобретатель Жак Шарль в XVIII веке. В ходе эксперимента газ нагревали в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Незначительным увеличением объема колбы при нагревании можно пренебречь, как и столь же незначительным изменением объема при смещении ртути в узкой манометрической трубке. Таким образом, объем газа можно считать неизменным. 10 Подогревая воду в сосуде, окружающем колбу, ученый измерял температуру газа термометром, а давление — манометром.  Эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда. С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейной:  Эта зависимость называется законом Шарля в честь ученого, открывшего ее. 11 Основное уравнение МКТ Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами: массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа или кратко — основным уравнением МКТ. В основе молекулярно-кинетической теории лежат три положения. Все вещества образованы из мельчайших частиц — молекул, которые состоят из атомов. Молекулы химического вещества могут быть простыми и сложными, то есть состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы. Атомы и молекулы находятся в непрерывном хаотическом движении. Частицы взаимодействуют друг с другом силами, которые имеют электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало. Мы уже выяснили, что причина давления газа на стенки — это удары молекул. Давление напрямую зависит от количества молекул — чем их больше, тем больше ударов о стенки и тем больше давление. А количество молекул в единице объема — это концентрация. Значит, давление газа зависит от концентрации. 12 Также давление пропорционально квадрату скорости, так как чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории для идеального газа имеет следующий вид. Основное уравнение МКТ p = nkT или p — давление газа [Па] n — концентрация [м-3] T — температура газа [К] m0 — масса одной молекулы [кг] v — средняя квадратичная скорость [м/с] Коэффициент 1/3 обусловлен трехмерностью пространства: во время хаотического движения молекул все три направления равноправны. Важный нюанс: средняя квадратичная скорость сама по себе не в квадрате! Ее формула указана выше, а в основном уравнении МКТ (да и не только в нем) она возведена в квадрат. Это значит, что формулу средней квадратичной скорости нужно подставлять не вместо v2, а вместо v— и потом уже возводить эту формулу в квадрат. Это часто провоцирует путаницу. Мы знаем, что кинетическая энергия вычисляется по следующей формуле: 13 Кинетическая энергия Ек = mv2/2 Ек — кинетическая энергия [Дж] m — масса тела [кг] v — скорость [м/с] Для молекулы газа формула примет вид: Средняя кинетическая энергия поступательного движения молекулы Ек = m0v2/2 Ек — средняя кинетическая энергия поступательного движения молекулы [Дж] m0 — масса молекулы [кг] v — скорость молекулы [м/с] Из этой формулы можно выразить m0v2 и подставить в основное уравнение МКТ. Подставим и получим, что давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Основное уравнение МКТ 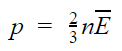 p — давление газа [Па] n — концентрация [м-3] E — средняя кинетическая энергия поступательного движения молекулы [Дж] 14 Хранение и транспортировка газов Если нужно перевезти значительное количество газа из одного места в другое или если газ необходимо длительно хранить, его помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным. Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем. Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или пытаться сделать в них отверстие — даже после использования. 15 Заключение Идеальный газ существует только в теории. В реальной жизни он не может существовать в принципе, так как точечные молекулы и отсутствие их взаимодействия на расстоянии аналогично их существованию вне пространства, то есть их не существованию. Ближе всех по своим свойствам к модели идеального газа приближаются газы при малом давлении (разреженные газы) и (или) высокой температуре. Модель идеального газа подходит для изучения методов исследования систем многих частиц, знакомства с соответствующими понятиями. В промежутках между столкновениями молекулы идеального газа движется по прямым. Законы столкновений и соударений о стенки сосудов, в которых находится газ, известны. Следовательно, если знать положения и скорости всех частиц идеального газа в какой-то момент времени, то можно найти их координаты и скорости в любой другой момент времени. Эта информация наиболее полно описывает состояние системы частиц. Однако количество частиц столь велико, что динамическое описание системы многих частиц непригодно для теории и бесполезно для практики. Это означает, что для изучения систем многих частиц информация должна быть обобщена, и ее относят не к отдельным частицам, а к их большим совокупностям. 16 Литература 1) Алмалиев А. Н., Копытин И. В., Корнев А. С., Чуракова Т. А. Термодинамика и статистическая физика: Статистика идеального газа. — Воронеж: Ворон. гос. ун-т, 2004. — 79 с 2) Г.Я. Мякишев., Б. Буховцев., Н. Н. Соцкий. Физика.10. Учебник для образовательных организаций М .: Просвещение, 2017. 3) Рымкевич А.П. Сборник задач по физике. 10-11 класс М.: Дрофа, 2009. 1) Интернет ресурс: https://ru.wikipedia.org 2) Интернет сайт: https://skysmart.ru/articles/physics/idealnyj-gaz 17 |
