|
|
Коллоквиум 1 биохимия ПИМУ. 1 колок по бх. Вовторых, аминокислоты очень плохо растворимы в неполярных растворителях типа петролейного эфира, диэтилового эфира, бензола и хорошо растворимы в воде. Втретьих
11)Биологический катализ. Термодинамические аспекты действия ферментов (энергетический барьер, энергия активации). Зависимость каталитических свойств ферментов от температуры и реакции среды. Температура и рН среды как факторы неспецифической регуляции активности ферментов.
Биологический катализ – это ускорение с помощью ферментов химических реакций, протекающих в живых организмах.
Ферменты – это биологические катализаторы белковой природы.
Катализаторы – это вещества, принимающие участие в химических реакциях, ускоряя их, но сами в них не расходующиеся.
Ферменты катализируют химические реакции, происходящие в организме.
Термодинамические аспекты действия ферментов:
А сейчас давайте попробуем разобраться в таком сложном вопросе, как механизм ферментативного катализа. Вам надо знать лишь самые азы, не углубляясь в тонкости, но я постараюсь донести суть на очень абстрактном примере. Что ферменты, что обычные катализаторы ускоряют термодинамически возможные реакции путём снижения энергии активации. Что она из себя представляет?
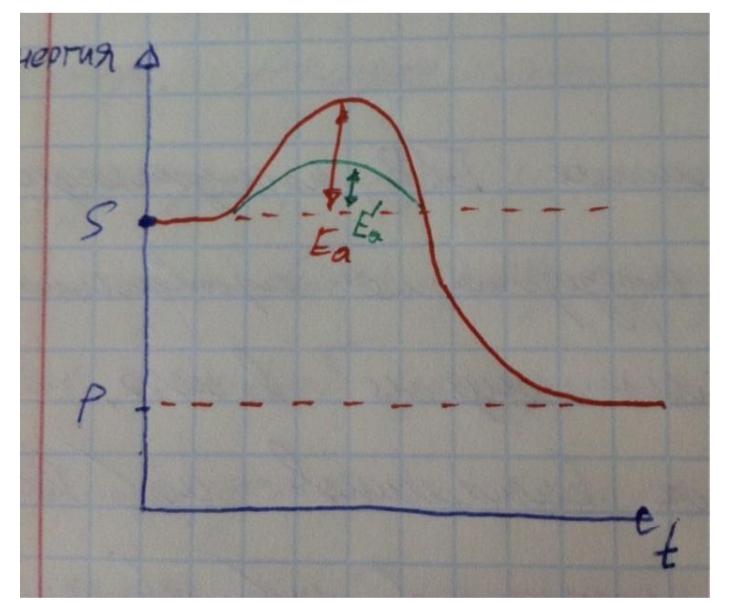
Смотрим на график. S – это субстрат, а точнее энергия субстрата, P – энергия продукта реакции.
Казалось бы, у субстрата свободной энергии больше, почему он не может сразу отдать её и превратиться в продукт, претерпев химическую реакцию?
А вот загвоздка в том, что для вступления в реакцию молекулам нужно приобрести больше энергии, ибо в «покое» они реагировать не собираются – им нужен пинок.
И вот как раз то количество энергии, которое надо сообщить молекулам субстрата, чтобы те начали вступать в реакцию, называется энергией активации (на графике отмечена стрелочкой красной).
А ферменты и обычные катализаторы уменьшают энергию активации, тем самым ускоряя реакцию.
Почему она ускоряется? Всё просто – чем меньше требуется энергии для запуска реакции, тем быстрее она пойдёт при прочих равных.
(Если толкать с равной силой тележки массой 50 и 100 кг, какая из них будет ехать быстрее? Тут так же.)
(Но как именно ферменты снижают энергию активации? С вас этого точно не спросят, но, если интересно, скажу абстрактно. Вот есть у вас молекула с двойной связью между атомами углерода. Вы хотите присоединить водород, но сам он туда не присоединится – двойная связь вполне устойчивая. Но если вы возьмёте эту молекулу и немного согнёте (активный центр располагает молекулу субстрата так, как ему надо; это то же самое, что сесть на кресло проктолога – оно придаст вам такую вынужденную форму, при которой врач сможет удобно выполнять свою работу) так, что в районе этой двойной связи появится напряжение, связь уже будет не такой уж и стабильной и захочет разорваться чисто по физическим соображениям, а мы ещё возьмём вещество, которое очень легко отдаёт водород (донор водорода, обычно НАДН2), и разместим его этими водородами максимально близко к углеродам субстрата, образующим двойную связь, то связь между углеродами порвётся и к ним присоединится по водороду. Вот так это работает, мы просто силой вынуждаем вещества вступать в реакции. Конечно, это частный случай и на деле всё сложнее, но для понимания сути этого должно хватить.)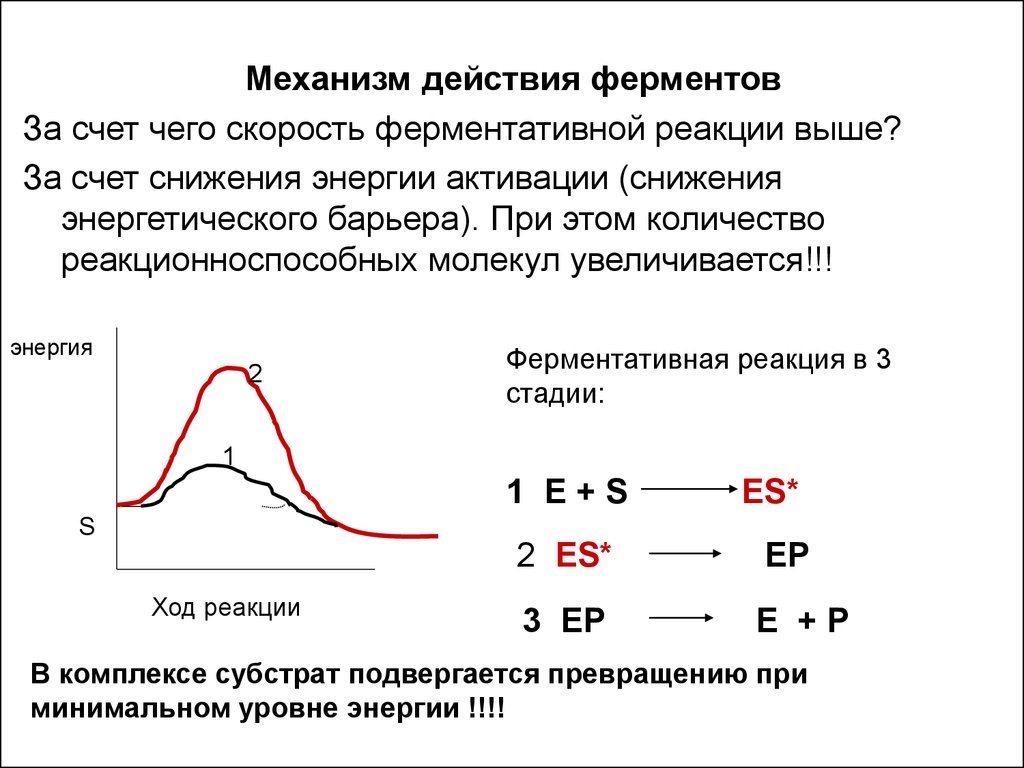 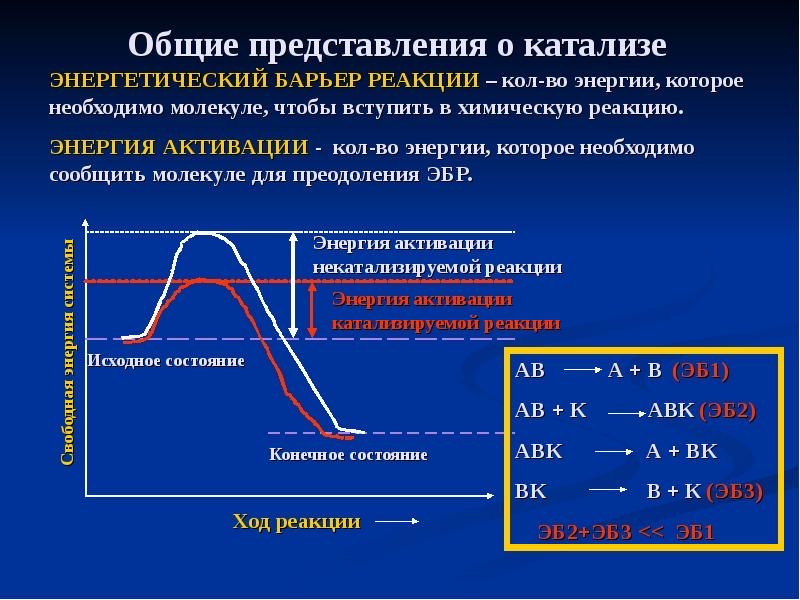
Зависимость каталитических свойств от температуры и реакции среды.
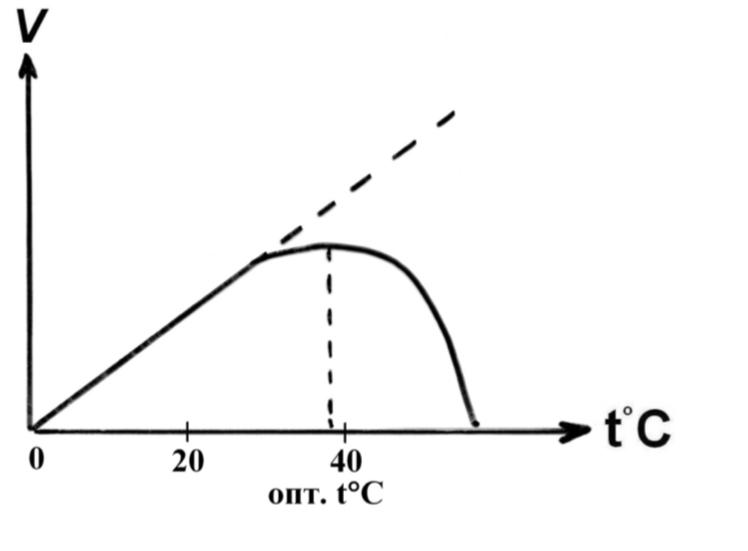
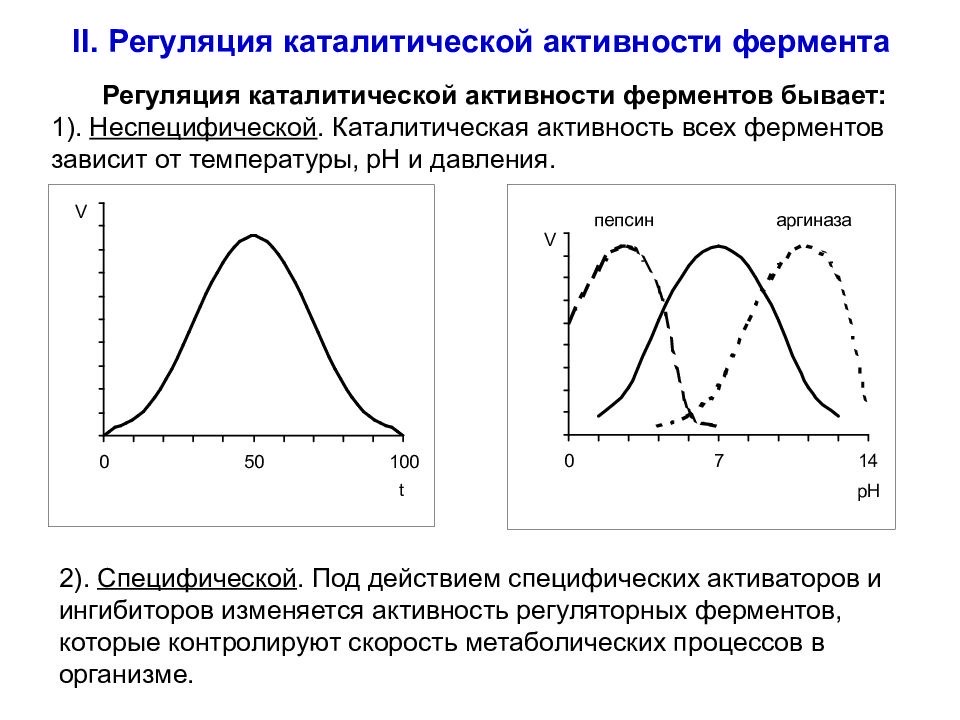
1) От температуры. Наибольшую активность тот или иной фермент проявляет при оптимальной температуре. Для Ф живого организма это значение находится в пределах +37,0 - +39,0 °С, в зависимости от вида животного. При понижении температуры, замедляется броуновское движение, уменьшается скорость диффузии и, следовательно, замедляется процесс образования комплекса между ферментом и компонентами реакции (субстратами). В случае повышения температуры выше +40 - +50 °С молекула фермента, которая является белком, подвергается процессу денатурации. При этом скорость химической реакции заметно падает
Зависимость скорости реакции от температуры:
Обратите внимание на обозначения на графике – вверх скорость, вбок температура. Скорость постепенно возрастает вместе с температурой, достигает максимума, затем падает. Почему так? Вспомните тему механизма ферментативного катализа, там мы говорили об энергии активации – количество энергии, которое необходимо сообщить молекулам субстрата, чтобы тот вступил в реакцию, так вот чем выше температура, тем выше изначальная энергия молекул и тем меньше нам придётся добавлять им энергии до способности реагировать, то есть чем горячее молекулы, тем ниже энергия активации и тем выше скорость ферментативных реакций, поэтому на графике с подъёмом температуры мы наблюдаем подъём скорости реакции. Но почему дальше идёт спад? Дело в том, что при высокой температуре ферменты денатурируют, теряют структуру и активность, переставая эффективно катализировать реакцию, скорость падает. Исходя из того, что слишком холодно и слишком жарко – плохо, мы заключаем, что есть термический оптимум, в основном он составляет +37,5 +/- 1 градус Цельсия.
При нагревании:
рвутся слабые связи в молекуле фермента (гидрофобные, ионные и водородные) =>
меняется конформация E =>
нарушается структура активного центра E =>
уменьшается активность E.
2) От pH cреды. Для большинства из них существует определенное оптимальное значение рН, при котором их активность максимальна. Поскольку в клетке содержатся сотни ферментов и для каждого из них существуют свои пределы опт рН. Так, в результате одной хим.реакции при участии определенного фермента рН оптимум которого лежит в пределах 7.0 – 7.2 образуется продукт, который является кислотой. При этом значение рН смещается в область 5,5 – 6.0. Активность фермента резко снижается, скорость образования продукта замедляется, но при этом активизируется другой фермент, для которого эти значения рН оптимальны и продукт первой реакции подвергается дальнейшему химическому превращению. 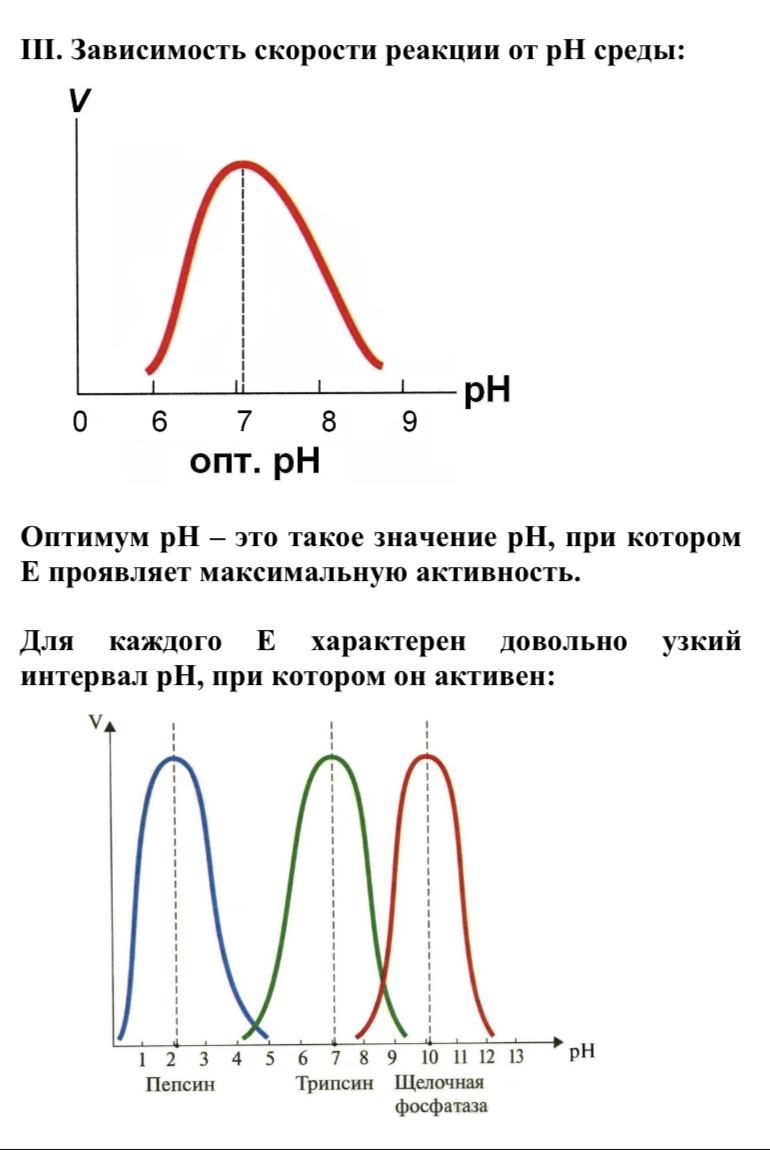

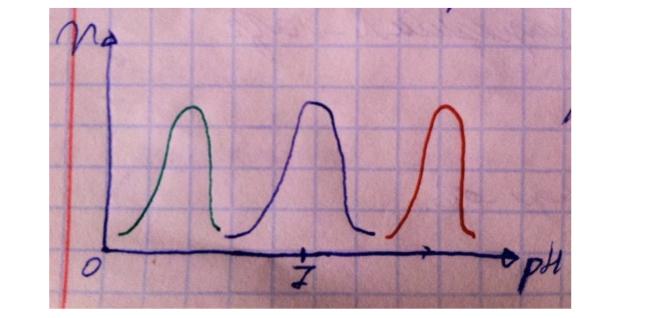
Здесь тоже есть свои оптимумы, на графике я изобразил оптимумы для трёх разных ферментов. Большинство ферментов нашего организма работают в нейтральной среде, т.е. их оптимум pH лежит в пределах от 6 до 8 (синий график), в пример можете привести ферменты гликолиза, например, гексокиназу.
Существуют ферменты, работающие в кислой среде, например, пепсин в желудке работает при pH от 1 до 2,5 (зелёный график), но ему так приходится, ибо для переваривание белков просто необходима кислая среда (они денатурируют, полипептидная цепь раскручивается и её пептидные связи становятся доступными для пептидаз).
Есть и уникальный фермент – щелочная фосфатаза – работающая в костях при pH между 9 и 10 (красный график). Все три типа ферментов с примерами хорошо запомните. Но почему активность ферментов так сильно зависит от pH? Из темы белков вспомните, что кислотность среды определяет уровень ионизации белков/ферментов, определяя их конформацию, гидратацию, растворимость и, в конечном итоге, активность.
У ферментов обычно есть всего одна нативная конформация, если изменить заметно кислотность (в любую сторону), структура нарушается, поэтому оптимумы по кислотности у ферментов узкие
Температура и рН среды как факторы неспецифической регуляции активности ферментов:
12. Основные отличия свойств ферментов от неорганических катализаторов. Специфичность действия ферментов. Виды специфичности, ее значение для организма. Принципы количественного определения ферментов. Единицы измерения ферментативной активности.
Ферменты — это белковые катализаторы, ускоряющие химические реакции в живых клетках.
Отличие ферментов от небиологических катализаторов:
1. Высокая эффективность действия (скорость ферментативных реакций в 106 – 1012 раз выше, чем соответствующих неферментативных реакций).
2. Высокая специфичность действия (фермент катализирует превращение одного конкретного субстрата, либо схожей группы субстратов).
3. Мягкие условия протекания ферментативных реакций (t
37 °C, нормальное атмосферное давление, pH, близкий к нейтральному).
4. Способность к регуляции.
Специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость ферментов. Различают субстратную и каталитическую специфичности фермента, которые определяются строением активного центра.
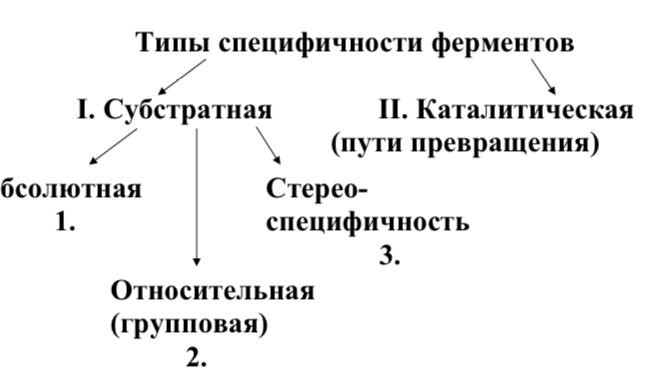
Под субстратной специфичностью понимается способность каждого фермента взаимодействовать лишь с одним или несколькими определенными субстратами.
Различают:
- абсолютную субстратную специфичность, если активный центр фермента комплементарен только одному субстрату;
- групповую субстратную специфичность, если фермент катализирует однотипную реакцию с небольшим количеством (группой) структурно похожих субстратов;
- стереоспецифичность, если фермент проявляет абсолютную специфичность только к одному из существующих стереоизомеров субстрата.
Каталитическая специфичность, или специфичность пути превращения субстрата, обеспечивает преобразование одного и того же субстрата под действием разных ферментов.
Это обеспечивается строением каталитических участков активных центров соответствующих ферментов.
Например, молекула люкозо-6-фосфата в клетках печени человека является субстратом четырех различных ферментов: фосфоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы. Однако за счет особенностей строения каталитических участков этих ферментов происходят различные превращения глюкозо-6-фосфата с образованием четырех различных продуктов. Специфичность пути превращения субстрата обеспечивает возможность преобразования одного и того же субстрата под действием разных ферментов. Молекула глюкозо-6-фосфата является субстратом разных ферментов, что приводит к образованию разных продуктов
Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете на количество материала, содержащего фермент.
Активность фермента =
Количество продукта или субстрата
Количество времени × Масса или объем пробы
В практике обычно используют:
• единицы количества вещества – моль (и его производные ммоль, мкмоль), грамм (кг, мг),
• единицы времени – минута, час, секунда,
• единицы массы или объема – грамм (кг, мг), литр (мл).
Активно используются и другие производные – катал (моль/с), международная единица активности (МЕ, Unit) соответствует мкмоль/мин.
Таким образом, активность фермента может выражаться, например, в ммоль/с×л, г/час×л, МЕ/л, кат/мл и т.д.
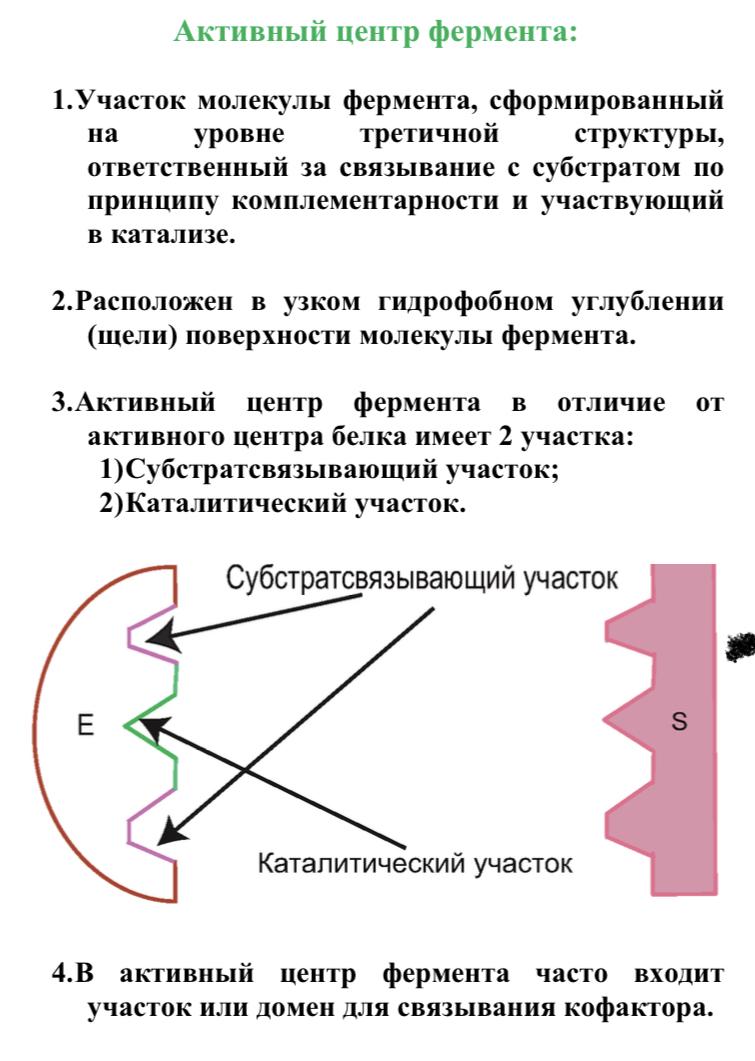
13. Активный центр фермента, его строение. Образование энзим-субстратного комплекса. Взаимодействие фермента и субстрата по принципу жесткого и индуцированного состояния активного центра (теория Фишера и теория Кошланда).
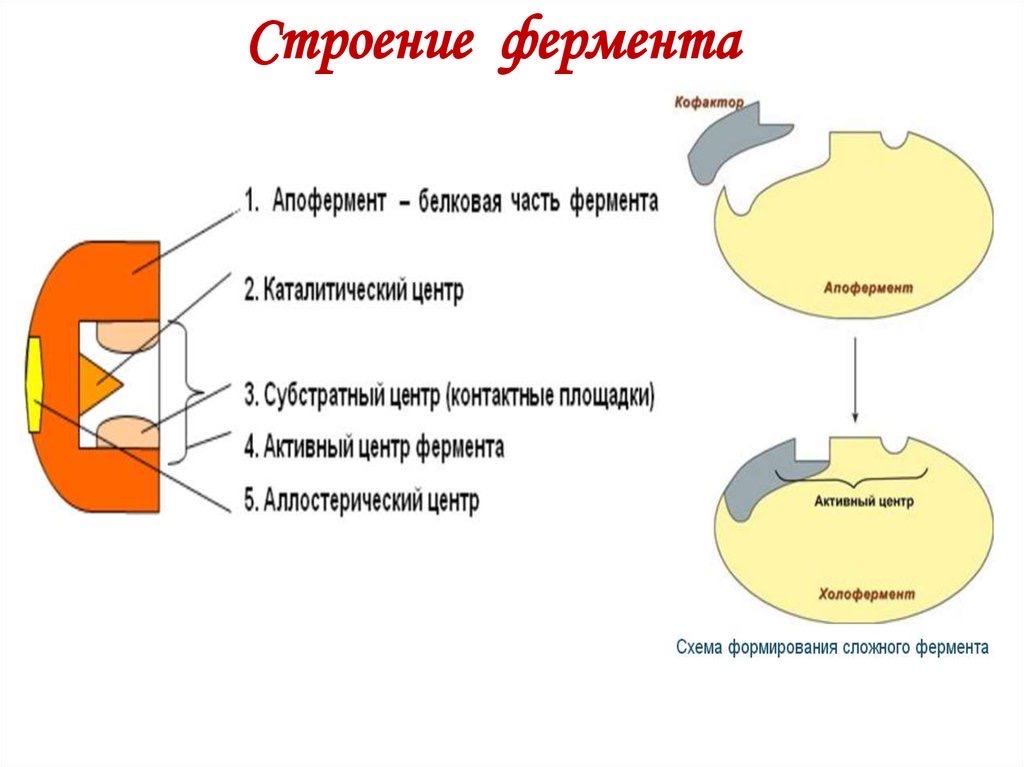
Активный центр ферментов - это определенный участок белковой молекулы, способный комплементарно связываться с субстратом и обеспечивающий его каталитическое превращение.
Структура активного центра сформирована радикалами аминокислот, также как и в случае активного центра любого белка. В активном центре фермента имеются аминокислотные остатки, функциональные группы которых обеспечивают комплементарное связывание субстрата (участок связывания), и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата (каталитический участок)
Образование энзим-субстратного комплекса:
1. В ходе катализа субстрат, связанный с активным центром фермента в фермент-субстратный (ES) комплекс, претерпевает химическое превращение в продукт, который затем высвобождается.
На этапе I происходит сближение и ориентация субстрата в области активного центра фермента.
На этапе II в результате индуцированного соответствия [изменение конформации субстрата (S) и активного центра фермен- та] образуется фермент-субстратный комплекс (ES).
На этапе III происходит дестабилизация связей в субстрате и образование нестабильного комплекса фермент-продукт (ЕР).
На этапе IV происходит распад комплекса (ЕР) с высвобождением продуктов реакции из активного центра и освобождением фермента.

1. Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую.
2. Дениел Кошланд предложил модификацию модели «ключ-замок». Ферменты, в основном, — не жесткие, а гибкие молекулы. Активный центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре. В отличие от модели «ключ-замок», модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния. Эта модель получила название «рука-перчатка».
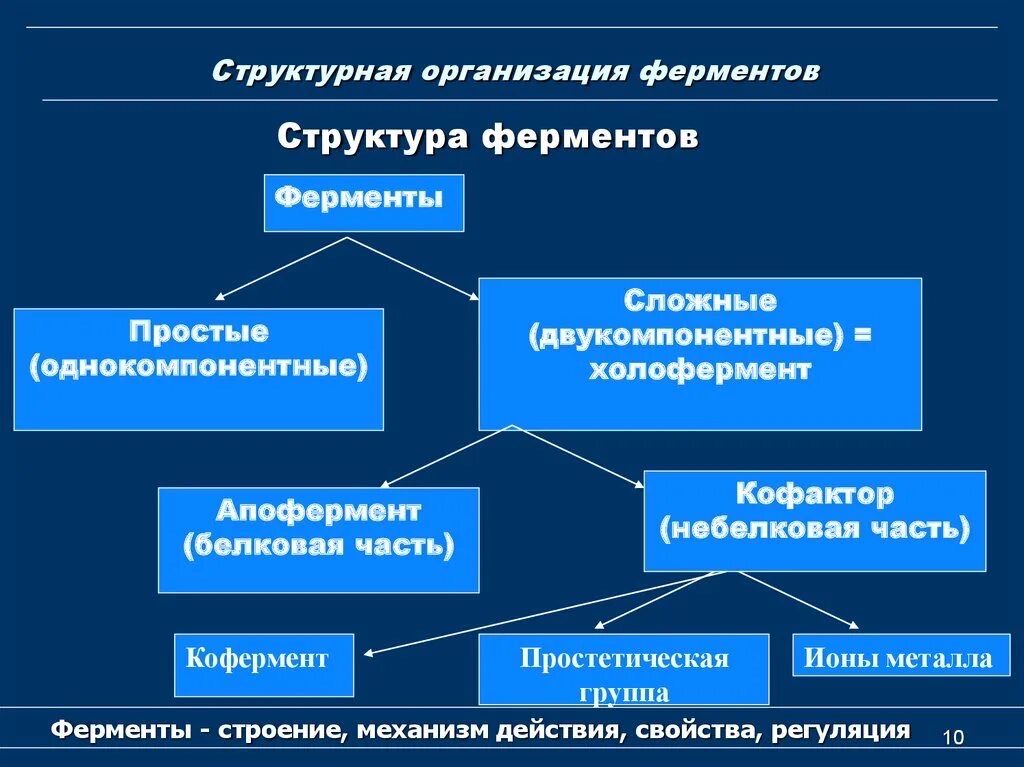
14. Ферменты, их молекулярная организация. Апофермент и кофактор (кофермент и простетическая группа). Номенклатура и классификация ферментов. Витамины и ионы металлов как кофакторы ферментов.
Ферменты, их молекулярная организация

Номенклатура и классификация ферментов.
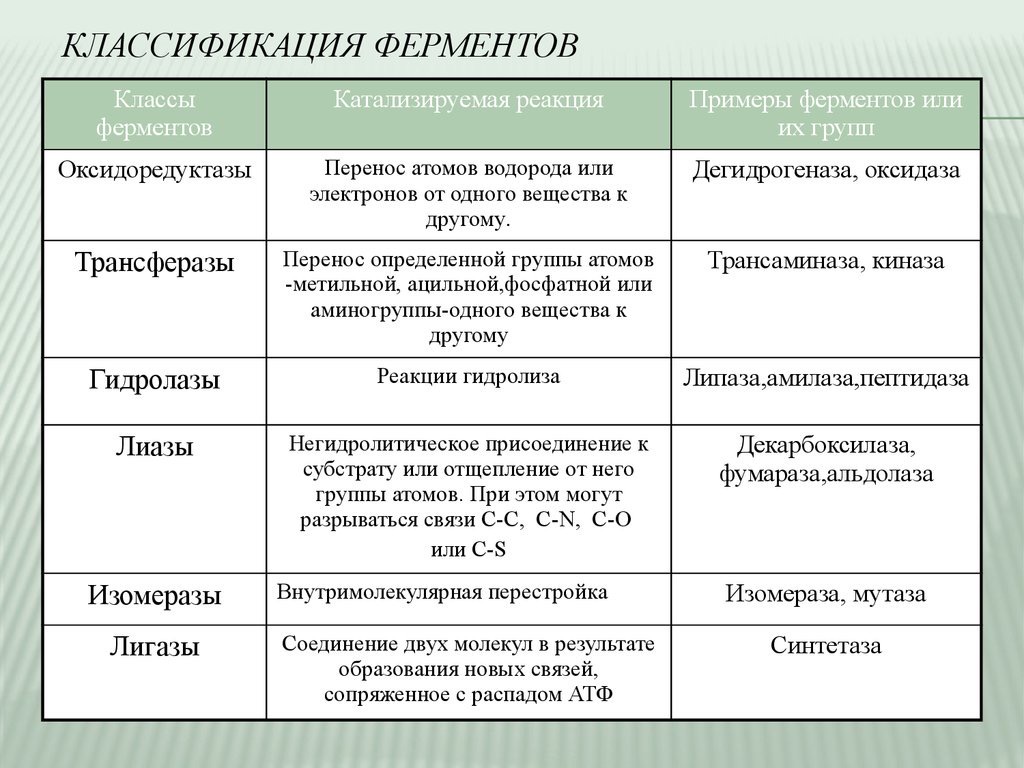
Но также ферменты классифицируют по специфичности относительно катализируемой реакции, выделяют
6 классов ферментов
Итак, первый класс – оксидоредуктазы. Суть этих ферментов в том, что они катализируют окислительно-восстановительные реакции, то есть забирают электроны у молекул-доноров и отдают электроны молекулам- акцепторам. Выделяют три подкласса, которые мы должны знать: дегидрогеназы (отщепляют электроны от молекул обычно с протонами заодно с помощью ФМН, ФАД, НАД, НАДФ, а потом переносят электроны и протоны на другую молекулу или фермент, пример – малатдегидрогеназа (в молекуле малата отщипляет два водорода, превращая гидроксильную группу в карбонильную)), оксидазы (переносят электроны с молекулы- субстрата на молекулу кислорода, превращая того в перекись или оксид/воду, пример – цитохромоксидаза), оксигеназы (переносят электроны на молекулу кислорода, при этом один атом кислорода идёт на образование молекулы воды, а второй атом включается в состав молекулы субстрата – монооксигеназы, а диоксигеназы включают оба атома кислорода в молекулу
субстрата, пример оксигеназ – фенилаланингидроксилаза/ фенилаланинмонооксигеназа). Пожалуйста, не путайте ОКСИДазы и оксиГЕНазы. Как составлять название этих ферментов? Пишите молекулу донор, потом название подкласса фермента, примеры я уже приводил.
Второй класс – трансферазы, переносят определённые группировки с одного субстрата на другой. Как формируется название фермента? Молекула-донор + название переносимой группировки + трансфераза, например, аспартат-амино-трансфераза.
23
Третий класс – гидролазы, ВСЕ эти ферменты простые (!), то есть у них нет никакой небелковой части, все они разружают молекулы субстрата присоединяя к ним молекулу воды, то есть осуществляют гидролиз. Название фермента – название молекулы-субстрата + аза, пример – нуклеотид-аза.
Четвёртый класс – лиазы, это ферменты, которые отщипляют какие-то группировки от молекулы субстрата, но не применяя воду. Название – молекула-субстрат + де/дез + название группировки + аза, пример – глутамат-де-карбоксил-аза, только не путайте с дегидрогеназами – они отщипляют водороды (протон + электрон), а не группировки, при этом меняют степени окисления.
Пятый класс – изомеразы, они переносят куски молекулы субстрата с одного места на другое в пределах этой молекулы, превращая субстрат в его изомер. Название фермента – название молекулы-субстрата + изомераза, пример – фосфотриозо-изомераза.
Шестой класс – лигазы/синтетазы, они присоединяют одну молекулу к другой с затратой энергии в форме АТФ. Название фермента – молекула- субстрат + синтетаза, пример – глутамин-синтетаза. Важно: бывает такое, что фермент объединяет две молекулы, но не расходует на это энергию АТФ, тогда он относится к трансферазам, но называется синтазой – не перепутайте с синтетазой. Название любого фермента кончается на –аза.
|
|
|
 Скачать 5 Mb.
Скачать 5 Mb.














