Коллоквиум 1 биохимия ПИМУ. 1 колок по бх. Вовторых, аминокислоты очень плохо растворимы в неполярных растворителях типа петролейного эфира, диэтилового эфира, бензола и хорошо растворимы в воде. Втретьих
 Скачать 5 Mb. Скачать 5 Mb.
|
|
Аминокислоты Составные части молекулы аминокислоты — аминогруппа NH2, карбоксильная группа COOH, радикал (различается у всех α-аминокислот), α-атом углерода (в центре). В структуре аминокислот боковая цепь, специфичная для каждой аминокислоты, обозначается буквой R. 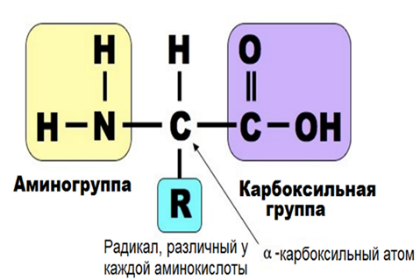 Свойства аминокислот: • Все они являются альфа-аминокислотами • Принадлежат к L-ряду • Хорошо растворимы в воде • Способны диссоциировать • Наличие ИЭТ Физические свойства ак: Хотя аминокислоты обычно изображают как соединения, содержащие амино- и карбоксильную группы (H2N CHR COOH), некоторые их свойства, как физические, так и химические, не согласуются с этой структурой. Присутствие в молекуле у одного атома углерода двух функциональных групп приводит к появлению ряда специфических свойств. Во-первых, в противоположность аминам и карбоновым кислотам аминокислоты представляют собой нелетучие кристаллические вещества, плавящиеся с разложением при близких и довольно высоких температурах, поэтому идентификации аминокислот по температурам плавления достаточно затруднительна. Во-вторых, аминокислоты очень плохо растворимы в неполярных растворителях типа петролейного эфира, диэтилового эфира, бензола и хорошо растворимы в воде. В-третьих, в водных растворах аминокислоты имеют высокие дипольные моменты. В-четвертых, константы кислотности и основности для групп СООН и NH2 необычайно малы. Так, для глицина константа кислотности Ka = 1,61010, а константа основности Kb = 2,51012; в то время как для большинства карбоновых кислот Ka 105 а для алифатических аминов Kb 104 . Все эти свойства вполне объяснимы, если принять во внимание тот факт, что аминокислоты существуют в виде диполярного иона, который образуется за счет отщепления протона от карбоксильной группы и присоединения его к аминогруппе. Диполярный ион часто называют внутренней солью. Классификация аминокислот 1) По полярности различают: гидрофобные(неполярные) и гидрофильные(полярные) - Гидрофобные имеют в своем составе радикалы: -CH3; - ароматические; не взаимодействуют с водой: аланин, валин, глицин, лейцин, изолейцин, фенилаланин, триптофан, метионин. - Гидрофильные (полярные) имеют в своем составе такие радикалы, как -OH, -COOH, -NH2, -SH, NH2-C=O. При этом из них диссоциируют только -COOH и -NH2, ну и -SH (при значении pH=8). В связи с этим гидрофильные делятся на заряженные и незаряженные. • Заряженные бывают отрицательно (-) заряжены и положительно (+) заряжены. (-) – имеют в своем составе дополнительную карбоксильную группу, она и дает отрицательный заряд: глутаминовая и аспарагиновая кислота. (+) – аргинин, лизин, гистидин • Незаряженные – цистеин, серин, треонин, тирозин. 2) По заменимости различают: - заменимые (аланин, аспартат, глутамат, аспарагин, глутамин, пролин, глицин, серин) - условно заменимые (тирозин, цистеин); - частично заменимые (гистидин, аргинин) - незаменимые (лейцин, изолейцин, лизин, триптофан, метионин, фенилаланин, валин и треонин);   Но сначала пару слов о заменимых и незаменимых аминокислотах, чтобы закончить с этим вопросом. Незаменимыми называются те аминокислоты, которые наш организм синтезировать никак не может – он получает их только с пищей, представители: валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, треонин, лизин. Есть условно заменимые – тирозин и цистеин – они могут синтезироваться в нашем организме, но только из незаменимых, поэтому они условно заменимы. Есть частично заменимые – это те, которые детский организм синтезирует сам, но недостаточно, поэтому их надо получать дополнительно с пищей. Ну и полностью заменимые: глицин, аланин, пролин, серин, глютамин, глутаминовая кислота, аспаргин, аспаргиновая кислота. Роль аминокислот в формирование нативной (правильной) структуры белка: Последовательность и соотношение аминокислот в первичной структуре определяет дальнейшее поведение молекулы: ее способность изгибаться, сворачиваться, формировать те или иные связи внутри себя. Например, замена глутаминовой кислоты на валин в структуре гемоглобина ведет к формированию неправильной формы эритроцитов, что вызывает серповидно-клеточную анемию. Поэтому последовательность аминокислот очень важна. Ступени структурной организации глобулярного белка. Первичная структура - порядок чередования аминокислотных остатков в линейной цепи, соединенных пептидной связью (глутатион, глюкагон). Связи - пептидные Вторичная структура - расположение полипептидной цепи в пространстве, образующаяся в результате взаимодействий между функциональными группами пептидной связи, с образованием спиральной структуры (α-спираль) или плоского слоя (β-складчатость), а также аморфных участков. Связи – пептидные, водородные Третичная структура - объемная организация вторичных структур в единую трехмерную конструкцию с определенной конформацией, образующаяся за счёт взаимодействий между радикалами аминокислот. Связи – водородные, гидрофобные, дисульфидные мостики, ионные. Четвертичная структура - количество и взаиморасположение полипептидных цепей олигомерного белка в пространстве. Первичная структура белка. Первичная структура белка – линейная последовательность аминокислотных остатков в полипептидной цепи, связанная между собой пептидными (ковалентными) связями. Тетрапептид:  Зависимость конформации и свойств белков от первичной структуры: формирование дальнейших структур будет зависеть от радикалов этих аминокислот, которые будут взаимодействовать между собой, изгибая полипептидную цепь, образуя трёхмерную нативную структуру. Вся информация о формировании пространственной структуре белка находится в полипептидной цепи. Биологическая роль пептидов: выполняют функцию биорегуляторов различных биологических и физиологических процессов регулируют тонус сосудов (вазопрессин, ангиотензин) моторику и секрецию ЖКТ (гастрин, холецистокинин) стимулируют секрецию гормонов гипофиза (АКТГ, соматотропный гормон) регулируют иммунитет (гормоны тимуса) Вторичная структура белка. Вторичная структура – пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: альфа-спираль и бэтта-складчатость. Связи, стабилизирующие вторичную структуру, - водородные, образуются между карбоксильным кислородом одной цепи и амидным азотом другой цепи. Альфа-спираль. Пептидный остов закручивается в виде спирали за счет образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп. Водородные связи ориентированы вдоль спирали. На один виток приходится 3,6 аминокислотных остатка. Радикалы снаружи, т.к. гидрофобны. Бэтта-складчатость. Формируется за счет образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы или между разными. «Лист, сложенный гармошкой». Водородные связи, образующиеся внутри одной полипептидной – внутрицепочечные, между разными – межцепочечные. Существует также так называемая «надвторичная структура» - локальная конформация, образующаяся в результате объединения нескольких участков одной полипептидной цепи, которые имеют вторичную структуру. К ней относится: супервторичная структура «альфа-спираль – поворот – альфа-спираль», формируется за счет межрадикальных взаимодействий. Еще пример «цинковый палец» - фрагмент ДНК-связывающего белка в форме «цинкового пальца». 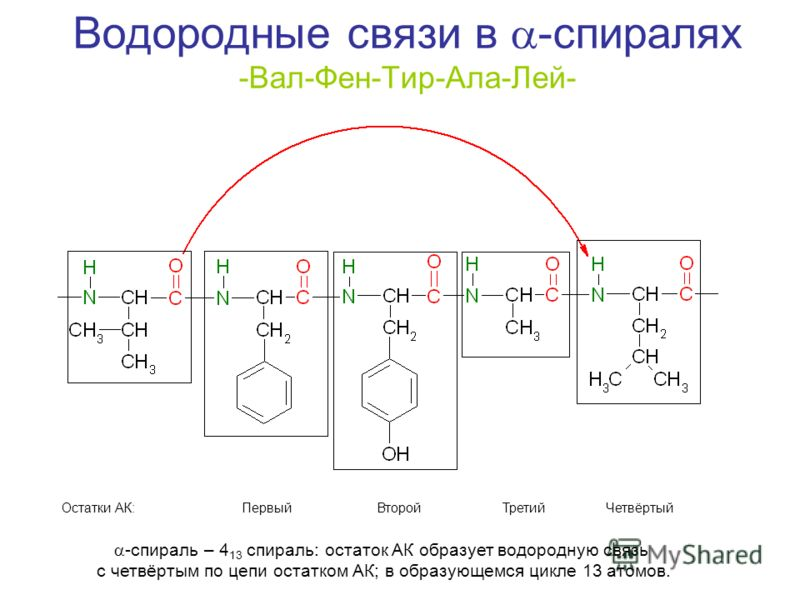  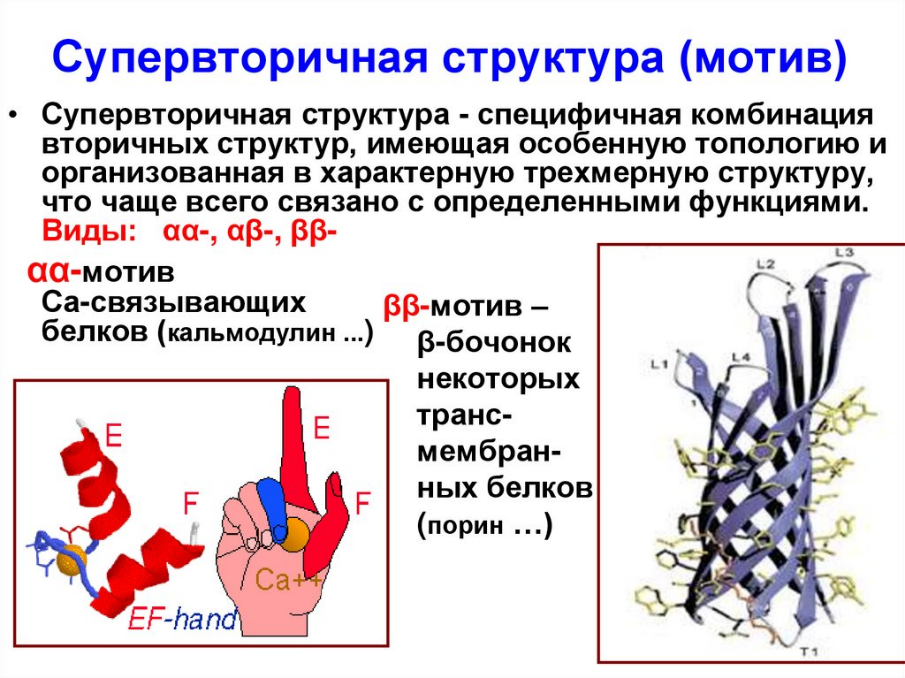 Третичная структура Третичная структура белка – это трехмерная пространственная структура, образующаяся за счет взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи. Связи, участвующие в формировании: гидрофобные взаимодействия – гидрофобные радикалы внутри глобулярной структуры, между ними возникают силы ван дер Ваальса (формируется гидрофобное ядро). Ионные связи и водородные связи – гидрофильные радикалы располагаются на поверхности белковой молекулы, все гидрофильные радикалы, оказавшиеся внутри гидрофобного ядра, взаимодействуют с друг другом с помощью ионных и водородных связей. Третичную структуру некоторых белков стабилизируют дисульфидные связи (взаимодействие -SH – групп двух остатков цистеина). Третичная структура – глобула, образуется одной полипептидной цепью, а четвертичная структура – это комплекс глобул, а несколько глобул, значит, и несколько полипептидных цепей, то есть только олигомерный белок. Домен - участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи конформацию глобулы. Характерны для белков, состоящих из более чем 200 аминокислот (полидоменные белки). Кластеры – это определенные зоны на поверхности молекулы белка, содержащие однотипные группировки и служащие для присоединения различных веществ к молекуле белка. Фолдинг – это процесс формирования нативной структуры белка. Осуществление фолдинга происходит с помощью фолдаз (ферменты, катализирующие сборку полипептидной цепи путем образования ковалентных промежуточных комлпексов) и шаперонов (вспомогательные специализированные белки, обеспечивающие фолдинг, рефолдинг и предотвращение реагрегации неправильно свернутых или частично развернутых белков). редупреждение агрегации новых белков, т. е. предупреждение «неправильных» внешних взаимодействий в ходе фолдинга — одна из важнейших задач шаперонов. б) Другая сопряженная задача — предупреждение «неправильных внутренних (в пределах одной пептидной цепи) взаимодействий. в) Третий аспект той же функции — лабилизация «неправильных» слабых связей (если они все-таки образовались), с тем, чтобы пептидная цепь не оказалась зафиксированной в «неправильной» конформации, а могла достичь наиболее оптимальной формы. В отличие от фолдаз речь идет о лабилизации не ковалентных, а слабых связей. Все вместе это и означает «обеспечение правильного фолдинга. 2) Следующая функция шаперонов — контроль за рефолдингом. Имеется в виду, что под действием самых разных причин (перегрева, облучения, действия оксидантов и т. д.) белки, относительно давно синтезированные и до того успешно функционировавшие, могут терять свою нативную конформацию, частично или полностью денатурировать, что, сопровождается склонностью к агрегации. 3) Третья функция шаперонов – участие в некоторых видах виутриклеточного транспорта белков: в частности, в лизосомы (для белков, «отслуживших» свой срок и не поддающихся рефолдингу) и в митохондрии. Четвертая функция – поддержание ряда белков в определенной конформации, в состоянии как бы незавершенного фолдинга. В этом случае, очевидно, шапероны не теряют связи с соответствующим белком после его сворачивания.  Четвертичная структура Четвертичная структура – это количество и взаиморасположение полипептидных цепей в пространстве. Протомеры – отдельные полипептидные цепи в белке (субъединицы). Олигмерный белок – белок, состоящий из четного количества протомеров. Связи, стабилизирующие, такие же, как и в третичной. У олигомерного белка конформация складывается из его вторичной, третичной, четвертичной структур. Примеры: гемоглобин, лактатдегидроденаза, цитохромоксидаза, глутаминсинтетаза. Основными силами, стабилизирующими четвертичную структуру, являются нековалентные связи между контактными площадками протомеров, которые взаимодействуют друг с другом по типу комплементарности – универсальному принципу, свойственному живой природе. Структура белка после его синтеза в рибосоме может частично подвергаться модификации (посттрансляционный процессинг): например, при превращении предшественников ряда ферментов или гормонов (инсулин). Принципы классификации белков В основе имеющихся классификаций обычно лежит один признак. Так, белки можно классифицировать по: Форме молекул (глобулярные – миоглобин; и фибриллярные – коллаген, кератин.) Молекулярной массе (низкомолекулярные, высокомолекулярные и т.д.) Химическому строению (наличие или отсутствие небелковой части) Выполняемым функциям (транспортные, защитные, структурные белки и др.) Локализации в клетке (ядерные, цитоплазматические, лизосомальные и др.) Биологические функции белков: Ферментативная Транспортная Энергетическая Регуляторная Защитная Рецепторная Структурная Сократительная Протеомика – наука, изучающая белковый набор организма, а также структуру белков (в т.ч. и пространственную) и их функции. 8. Белок-лигандные и белок-белковые взаимодействия Лиганд - молекула, которая связывается с белком в процессе выполнения его функций. Взаимодействие белка с лигандом высокоспецифично, осуществляется на основе комплементарности лиганда и активного центра белка. Белок – белковое взаимодействие – обозначает ситуацию, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент. Белок-белковые взаимодействия, а именно ассоциация и диссоциация. Существуют ферменты, представленные олигомерами, причём некоторые активны в третичной структуре, а в четвертичной неактивны, а другие, наоборот. Пример. Протеинкиназа-А имеет 2 каталитические и 2 регуляторные субъединицы, соединённые вместе, в такой форме фермент неактивен, но если к регуляторным субъединицам присоединится цАМФ (циклический аденозинмонофосфат), то они изменят конформацию и фермент продиссоциирует, став активным – активация диссоциацией. Есть фермент ацетил-КоА-карбоксилаза, который, будучи тетрамером, неактивен, но если на него подействовать лимонной кислотой, то он полимеризуется до состояния 20-ти субъединиц и становится активным – активация путём ассоциации. Данный способ регуляции является обратимым. Белок – лигандное – на белковых молекулах есть участки, к которым присоединяются лиганды – активный центр. Активный центр формируется из аминокислотных остатков, сближенных в результате формирования вторичной и третичной структур. Связи между белком и лагандом могут быть нековалентными и ковалентными. Высокая специфичность взаимодействия («узнавания») белка и лиганда обеспечивается комплементарностью структуры активного центра и лиганда. Под комплементарностью понимают химическое и пространственное соответствие активного белка и лиганда. Виды лигандов: 1) Лиганд белка-фермента - субстрат. 2) Лиганд траспортного белка - транспортируемое вещество (гемоглобин-кислород). 3) Лиганд антитела (иммуноглобулина) - антиген. 4) Лиганд рецептора гормона или нейромедиатора - гормон или нейромедиатор. Образование внутренней сферы комплексов происходит по донорно-акцепторному механизму. Комплексообразователь – акцептор, предоставляющий свободные орбитали. Лиганды – доноры, предоставляющие свободные пары электронов. 9. ИЭТ и физхим свойства Физико-химические свойства белков. Растворимость в воде. Большинство белков (глобулярных) хорошо растворимы, Фибрилярные белки (структурные) обычно нерастворимые. Ионизация и гидратация.. Чтобы белок был растворим в воде, его должен облепить слой или слои молекул воды, это облегчает движение и растворимость белковой частице в воде. Образование таких оболочек называется гидратацией. Чем больше оболочки, тем выше растворимость и, соответственно, стабильность белка. Радикалы полярных аминокислот, так как они притягивают воду, отвечают за это. Общий заряд на поверхности белка (ионизация) зависит от аминокислотного состава и кислотности среды. Осаждение. Механизм состоит в том, что добавляемые анионы и катионы солевого раствора снимают гидратную оболочку белков и заряд, являющие факторами устойчивости. Изоэлектрическая точка (значение pH, при котором поверхностный заряд белка равен нулю). Пропадёт ионизация, ослабнет гидратация, растворимость уменьшится, белок выпадет в осадок, его активность упадёт. Изоэлектрическая точка (pI) — кислотность среды (pH), при которой определённая молекула или поверхность не несёт электричекого заряда. Амфотерные молекулы (цвиттер-ионы) содержат как положительные, так и отрицательные заряды. Заряд различных функциональных групп таких молекул может меняться в результате связывания или, наоборот, потери протонов H+. 10. Факторы устойчивости белковой молекулы в растворе Факторы устойчивости: Гидратная оболочка – это слой молекул воды, определенным образом ориентированный на поверхности белков молекулы (не дает белкам соединяться и выпасть в осадок) Заряд белковой молекулы (определяется аминокислотным составом и pH среды) Молекулярная масса Форма молекулы Денатурация белка – это процесс разрушения слабых нековалентных связей в составе белка под действием различных химических и физических факторов, что ведет к нарушению пространственной структуры и нарушению функций, первичная структура белка не разрушается. Обратимая денатурация – когда структура белка и его функции могут полностью восстановиться при уборке денатурирующего агента. Может быть вызвана слабым нагреванием, высаливанием (действием солей щелочных, щелочно-земельных металлов и аммония), мочевиной, кратковременным действием этилового спирта и т.д. Необратимая денатурация – возвращение к прежнему состоянию белка невозможно, вызвана действием сильных минеральных и органических кислот, тяжелых металлов, кипячением, жестким излучением. Использование в науке и медицине: в медицине денатурирующие агенты часто применяют для стерилизации медицинского инструмента и материалов в автоклавах (высокая температура) и в качестве антисептиков (спирт, фенол, хлорамин) для обработки загрязненных поверхностей, содержащих патогенную микрофлору.   |
