Оволв. Водители ритма. Водители ритма нового поколения от электрических устройств до биологических пейсмейкеров
 Скачать 53.84 Kb. Скачать 53.84 Kb.
|
|
Водители ритма нового поколения: от электрических устройств до биологических пейсмейкеров Ослопов Владимир Николаевич – доктор медицинских наук, профессор кафедры пропедевтики внутренних болезней имени профессора С.С. Зимницкого Казанского государственного медицинского университета МЗ РФ. Казань,ул. Бутлерова, 49 Мамедова Аида Халидовна - студентка лечебного факультета Казанского государственного медицинского факультета. Казань, ул. Фучика,119 420140 osnebaa@mail.ru +7 (967) 772-22-61 Нафеева Динара Наиловна - студентка лечебного факультета Казанского государственного медицинского факультета. Казань, ул. Маяковского,11 Изобретение электрокардиостимулятора привело к революции в терапии заболеваний проводящей системы сердца. Спустя время электрокардиостимуляторы стали надежнее, меньше по размеру и легче по весу, однако проблемы инфицирования «инородного тела», ограниченного срок эксплуатации остались нерешёнными. Современная высокотехнологичная медицина стремится к созданию менее инвазивных электрокардиостимуляторов, но тем не менее, биологические кардиостимуляторы могут расширить терапевтический арсенал для лечения кардиологических пациентов, являясь наиболее физиологичными для человека. Были использованы различные генные и клеточные подходы для создания биологических кардиостимуляторов: подход функциональной реорганизации(использование аденовирусных векторов для гиперэкспрессии генов, кодирующих ионные каналы в кардиомиоцитах); гибридный подход (использование фибробластов для доставки генов ионных каналов, обеспечивающих автоматизм сердца); подход соматического репрограммирования (гиперэкспрессия транскрипционного фактора TBX18 с использованием аденовирусных векторов, который перепрограммировывает кардиомиоциты в индуцированные клетки синоатриального узла, создавая кардиостимуляторную активность); клеточный подход (трансплантация стволовых клеток в определенное место в сердце, создавая тем самым биологическую стимуляцию). Современные методы электрокардиостимулирования и разрабатываемые концепции биологического водителя ритма, наглядно показывают возможность устранения текущих проблем, связанных с использованием искусственного водителя ритма, путём замены его на биологический. Однако в практике возникает вопрос безопасности данных подходов. УДК 616-77 Ключевые слова: биологический водитель ритма, электрокардиостимулятор,генная терапия, клеточная терапия Для цитирования: Next-generation rhythm drivers: from electrical devices to biological pacemakers V.N. Oslopov, A.Kh. Mamedova, D.N. Nafeeva Kazan State Medical University, Kazan, Russia Abstract The invention of an electric pacemaker led to a revolution in the treatment of diseases of the conductive heart system. After a while, electric pacemakers became more reliable, smaller and lighter in weight, but the problem of infection with the "homogeneous body" and limited service life remained unresolved. Modern high-tech medicine strives to create less invasive electric pacemakers, but nevertheless, biological pacemakers can expand the therapeutic arsenal for the treatment of cardiac patients, being the most physiological for humans. Various gene and cellular approaches were used to create biological pacemakers: a functional reorganization approach (use of adenovirus vectors for hyperexpression of genes encoding ion channels in cardiomyocytes); hybrid approach (use of fibroblasts to deliver genes of ion channels that provide heart automation; somatic Modern methods of electrocardiostimulation and the concepts of the biological rhythm driver being developed clearly show the possibility of eliminating current problems associated with the use of an artificial rhythm driver by replacing it with a biological one. However, the question arises in practice about the security of these approaches. Keywords: biological rhythm driver, electric pacemaker, gene therapy, cell therapy For citation: Водители ритма нового поколения: от электрических устройств до биологических пейсмейкеров Возникновение электрического импульса происходит в синоатриальном узле, далее он распространяется в нисходящем направлении, возбуждая различные отделы сердца. При патологии проводящей системы происходит замедление сердечного ритма, что ведет к несоответствию между потребностью организма в кровообращении и его реальным поступлением. [1] Как решение этой проблемы, медицина прибегает к имплантации электронных кардиостимуляторов. Спустя время электрокардиостимуляторы стали надежнее, меньше по размеру и легче по весу, появились более совершенные двух- и трехкамерные модели. Современный ЭКС состоит из подкожного генератора, литий-ионной батареи и ряда проводов с электродами на наконечниках. Он способен отслеживать электрические импульсы предсердий и желудочков, частоту дыхания, скорость движения тела, что позволяет регулировать сердечный ритм с учетом физиологических потребностей. Несмотря на свою эффективность, пациенты с ЭКС имеют ряд ограничений в зонах с электромагнитным полем, что влияет на качество их жизни, также возможен риск инфицирования «инородного тела».[2] Биологические кардиостимуляторы, полученные переносом генов, слиянием клеток или трансплантацией стволовых клеток, предоставляют альтернативу электронным устройствам. Современная высокотехнологичная медицина стремится к созданию менее инвазивных электрокардиостимуляторов, но тем не менее, биологические кардиостимуляторы могут расширить терапевтический арсенал для лечения кардиологических пациентов, являясь наиболее физиологичными для человека.[3] Биологические кардиостимуляторы Различные биологические подходы для улучшения сердечной автономности были исследованы на протяжении многих лет, их целью является использование клеток, функционально схожих с клетками синоатриального узла(естественными клетками,стимулирующими работу сердца). [4] Были описаны различные генные и клеточные подходы для создания биологических кардиостимуляторов: 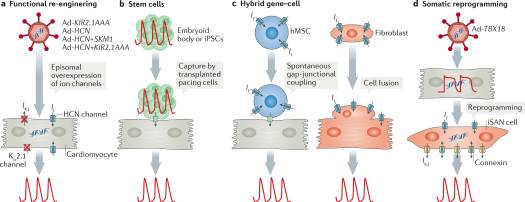 a) Подход функциональной реорганизации. Аденовирусные (Ad) векторы используются для гиперэкспрессии генов, кодирующих ионные каналы (один канал или комбинацию каналов) в кардиомиоцитах. Например, для увеличения числа управляемых циклическими нуклеотидами гиперполяризационно-активируемые каналы (the hyperpolarization-activated, cyclic nucleotide-gated (HCN) channels) и уменьшения количества калиевых каналов внутреннего выпрямления (Kir2.1) путем гиперэкспрессии доминантной отрицательной конструкции (KIR2.1AAA). [5] b) Стволовые клетки. Кластер стволовых клеток получают из эмбриональных стволовых клеток человека или индуцированных плюрипотентных стволовых клеток, которые трансплантируется в определенное место в сердце для захвата окружающего миокарда, создавая тем самым биологическую стимуляцию. c) В гибридном подходе клетки (мезенхимальные стволовые клетки человека (hMSCs) или фибробласты) используются для доставки генов ионных каналов (например, генов, кодирующих компоненты каналов HCN) для обеспечения автоматизма сердца.[6] Доставка с помощью мезенхимальных стволовых клеток человека требует соединения кардиомиоцитов и hMSC с помощью щелевого контакта, тогда как для доставки генов с помощью фибробластов необходимо слияние клеток.[7] d) При соматическом репрограммировании гиперэкспрессия T-box транскрипционного фактора TBX18 с использованием Ad-векторов перепрограммирует кардиомиоциты в индуцированные клетки синоатриального узла (iSAN), повторяя свойства SAN и, следовательно, создавая кардиостимуляторную активность. [8][9] Генные подходы. Самый ранний генный подход для повышения автоматизма сердца включал гиперэкспрессию генов, кодирующих β2-адренергические рецепторы человека в предсердиях мышей и свиньи. [10] Хотя этот подход не позволил создать биологический кардиостимулятор, скорость эндогенного SAN была увеличена за счет увеличения числа β2-адренергических рецепторов, доступных для связывания с эндогенными катехоламинами.[11] Первый биологический кардиостимулятор de novo был создан с помощью генной терапии, о чем было сообщено в 2002 году (REF 80). Стратегия заключалась в том, чтобы освободить «электрический тормоз», который подавляет автоматизм в желудочковых кардиомиоцитах путем ингибирования эндогенного калиевого канала внутреннего выпрямления. За счет гиперэкспрессии KIR2.1-доминантно-негативной конструкции (KIR2.1AAA) уменьшается количество функциональных калиевых ионных каналов внутреннего выпрямления (кодируемых семейством генов KIR2; также известных как KCNJ2) в миокарде морских свинок. Подавление IK1 вызывает самопроизвольную деполяризацию кардимиоцитов желудочков, тем самым генерируя биологическую активность кардиостимулятора. Последующие исследования показали, что избыточная экспрессия KIR2.1AAA не только влияла на потенциал покоя (вызывая спонтанную деполяризацию), но также приводила к увеличению продолжительности потенциала действия. [5] Диффузное подавление IK1 в миокарде желудочков может предрасполагать к аритмиям, это клинически наблюдается при семейном синдроме удлиненного интервала QT типа 7 (REF 82). Потенциальные проаритмические эффекты очагового подавления IK1 (что требуется для создания биологической активности кардиостимулятора) не были описаны в этих проверочных исследованиях на мелких животных.[12] Также рассматривают возможность экспрессии If каналов в нормальных рабочих кардиомиоцитах путём гиперэкспрессии Hcn2. Аденовирусные конструкции с мышиным Hcn2 доставляли открытой торакотомией в основание ушка левого предсердия; через 4 дня после инъекции анестезированные собаки имели спонтанные ритмы, которые возникли из левого предсердия после подавления синусового ритма посредством вагусной стимуляции. Клеточные подходы Человеческие эмбриональные стволовые клетки (ЭСК) могут дифференцироваться в самопроизвольно возбуждающиеся кардиомиоциты. Трансплантация in vivo полученных из ЭСК кардиомицитов морским свинкам привела к биологической активности кардиостимулятора, что подтвердилось оптическим картированием ex vivo. После аблации AV-узла у тех животных, которым ранее вводили кардиомиоциты, полученные из ЭСК, проявлялась спонтанная биологическая кардиостимуляторная активность в месте инъекции (продемонстрировано оптическим картированием). Учитывая человеческое происхождение этих клеток, иммуносупрессия была необходима для предотвращения отторжения.[11] SAN-подобные кардиомиоциты, полученные из индуцированных человеком плюрипотентных стволовых клеток (ИПСК), использовали для создания биологической активности кардиостимулятора in vitro и in vivo. В другом исследовании кардиомиоциты, полученные из iPSC, были внедрены в сердца собак при помощью открытой торакотомии. Биологическая активность кардиостимулятора наблюдалась только у 50% животных с частотой 40-50 ударов в минуту. [6] Современные технологии iPSC создают смешанную популяцию клеток с различными фенотипами и необходимо учитывать, что незрелые клетки способны дифференцироваться в клетки различных типов (например, тератомы), мигрировать по организму. Также встаёт вопрос о довольно продолжительном сроке создания ИПСК (до нескольких месяцев).[13] Гибридный генно-клеточный подход В гибридно генно-клеточном подходе используются клетки, несущие гены кардиостимуляторной активности (например, гены, кодирующие каналы HCN). Путём открытой торакотомии собакам с полной AV-блокадой были введены человеческие мезенхимальные стволовые клетки (hMSC), сконструированные для экспрессии канала кардиостимулятора HCN2. Проявилась биологическая кардиостимуляторная активность: частота желудочковых сокращений составляла 50–60 ударов в минуту, признаки клеточного или гуморального отторжения отсутствовали. Потенциальными преимуществами данного подхода являются: отсутсвие вирусного вектора (используется в большинстве подходов генной терапии) и отсутсвие необходимости в иммуносупрессии (учитывая низкую иммуногенность hMSCs). Недостатками этого подхода являются: довольно низкая частота сердечных сокращений; возможность миграции и дальнейшей дифференциации hMSCs.[6] В следующем гибридном подходе использовались инженерные сингенные фибробласты, экспрессирующие HCN1, инъецированные в сердца морских свинок, для индукции слияния клеток с окружающими эндогенными желудочковыми клетками. Образовавшиеся гетерокарионы фибробластов-миоцитов проявляли биологическую кардиостимуляторную активность в месте инъекции. Хотя эта альтернатива представляет собой невирусный подход, не связанный со стволовыми клетками, необходимы дополнительные доклинические исследования с использованием минимально инвазивной системой доставки клеток в миокард.[7] Соматические репрограммирующие подходы. Подход соматического репрограммирования заключается в гиперэкспрессии гена, кодирующего человеческий эмбриональный фактор транскрипции TBX18 в желудочковых кардиомиоцитах, индуцируя превращение кардиомиоцитов в клетки SAN (iSAN), которые напоминают эндогенные клетки кардиостимулятора SAN11. При таком подходе вся программа экспрессии генов изменяется, что приводит к изменениям в фундаментальной физиологии и морфологии клеток. Интересно, что клетки iSAN обладали многими фенотипическими и функциональными характеристиками нативных клеток SAN11.[8] Более того, соматическое репрограммирование in vivo с помощью TBX18 создало биологический ритм кардиостимулятора в сердцах морских свинок, который не только происходил из места инъекции, но также реагировал на катехоламины.[9] Заключение В настоящее время одним из методов лечения нарушений проводящей системы является применение электронных кардиостимуляторов. При успешном тестировании биологические кардиостимуляторы могут предоставить терапевтическую альтернативу современным ЭКС. Каждый из подходов (генный, клеточный, гибридно-клеточный, соматический репрограмирующий) имеют свои преимущества и недостатки, что предрасполагает к дальнейшему изучению, усовершенствованию их с целью внедрения биологического кардиостимулятора в клиническую практику. Литература: Андерсон Р. Х., Янни Дж., Бойетт М. Р., Чандлер Н. Дж. И Добжински Х. Анатомия проводящей системы сердца. Clin. Анат. 22, 99-113 (2009). [Anderson RH, Yanni J, Boyett MR, Chandler NJ & Dobrzynski H The anatomy of the cardiac conduction system. Clin. Anat. 22, 99–113 (2009).] Андерсон Р.Х. & Ho SY Архитектура синусового узла, атриовентрикулярной оси проводимости и межузлового миокарда предсердий. J. Cardiovasc. Электрофизиол. 9. С. 1233–1248 (1998). [Anderson RH & Ho SY The architecture of the sinus node, the atrioventricular conduction axis, and the х atrial myocardium. J. Cardiovasc. Electrophysiol. 9, 1233–1248 (1998)]. ван Верд Дж. Х. и Кристоффельс В. М. Формирование и функция проводящей системы сердца. Разработка 143, 197–210 (2016)[van Weerd JH & Christoffels VM The formation and function of the cardiac conduction system. Development 143, 197–210 (2016)] Cingolani E & Marbán E Воссоздание синусового узла путем соматического перепрограммирования: мечта сбылась? Rev. Esp. Кардиол. 68, 743–745 (2015).[Cingolani E & Marbán E Recreating the sinus node by somatic reprogramming: a dream come true? Rev. Esp. Cardiol. 68, 743–745 (2015)]. Miake J, Marban E & Nuss HB Биологический кардиостимулятор, созданный путем переноса генов. Nature 419, 132–133 (2002).[Miake J, Marban E & Nuss HB Biological pacemaker created by gene transfer. Nature 419, 132–133 (2002).] Плотников А.Н. и др. Ксенотрансплантаты мезенхимальных стволовых клеток взрослого человека, обеспечивающие платформу для устойчивой функции биологического водителя ритма в сердце собаки. Тираж 116, 2007. С. 706–713.[Plotnikov AN et al. Xenografted adult human mesenchymal stem cells provide a platform for sustained biological pacemaker function in canine heart. Circulation 116, 706–713 (2007).] Liechty KW et al. Мезенхимальные стволовые клетки человека, демонстрирующие сайт-специфическую дифференцировку после внутриутробной трансплантации овце. Nat. Med. 6. С. 1282–1286 (2000).[Liechty KW et al. Human mesenchymal stem cells engraft and demonstrate site-specific differentiation after in utero transplantation in sheep. Nat. Med. 6, 1282–1286 (2000).] Lloyd M et al. Оценка адаптивной стимуляции в кардиостимуляторе. Ритм сердца 14, 200–205 (2017). [Lloyd M et al. Rate adaptive pacing in an intracardiac pacemaker. Heart Rhythm 14, 200–205 (2017)]. Hu YF, Dawkins JF, Cho HC, Marban E & Cingolani E Биологический кардиостимулятор, созданный минимально инвазивным соматическим перепрограммированием у свиней с полной блокадой сердца. Sci. Transí Med 6, 245–94 (2014) [Hu YF, Dawkins JF, Cho HC, Marban E & Cingolani E Biological pacemaker created by minimally invasive somatic reprogramming in pigs with complete heart block. Sci. Transí Med 6, 245–94 (2014).] Edelberg JM, Aird WC & Rosenberg RD Повышение хронотропии сердца мышей за счет молекулярного переноса кДНК человеческого β2-адренергического рецептора. J. Clin. 101, 337–343 (1998). [Edelberg JM, Aird WC & Rosenberg RD Enhancement of murine cardiac chronotropy by the molecular transfer of the human β2 adrenergic receptor cDNA. J. Clin. Invest. 101, 337–343 (1998).] Эдельберг Дж. М., Хуанг Д. Т., Джозефсон М. Е. и Розенберг Р. Д. Молекулярное усиление сердечной хронотропии свиней. Сердце 86, 559–562 (2001)[Edelberg JM, Huang DT, Josephson ME & Rosenberg RD Molecular enhancement of porcine cardiac chronotropy. Heart 86, 559–562 (2001).] Tristani-Firouzi M et al. Функциональная и клиническая характеристика мутаций KCNJ2, связанных с LQT7 (синдром Андерсена). J. Clin. 110, 381–388 (2002).[Tristani-Firouzi M et al. Functional and clinical characterization of KCNJ2 mutations associated with LQT7 (Andersen syndrome). J. Clin. Invest. 110, 381–388 (2002).] Розен М.Р., Бринк П.Р., Коэн И.С. и Робинсон Р.Б. Гены, стволовые клетки и биологические кардиостимуляторы. Кардиоваск. Res. 64, 12–23 (2004). [Rosen MR, Brink PR, Cohen IS & Robinson RB Genes, stem cells and biological pacemakers. Cardiovasc. Res. 64, 12–23 (2004).] |
