Биохимия (зачет). Вопрос 1 Первичная структура белков
 Скачать 4.52 Mb. Скачать 4.52 Mb.
|
|
Существует две теории объяснения специфичности ферментов. Гипотеза Э. Фишера – гипотеза «ключа и замка» или гипотеза «шаблона». По Фишеру, фермент – это жесткая структура, АЦФ которого - точный «слепок» S-та. Если S подходит к Е как ключ к замку, то реакция произойдет. Если же S немного изменен («ключ»), то он не соответствует АЦФ («замку»), и реакция становится невозможной. Несмотря на логичность такого объяснения, гипотеза Фишера не объясняет, на чем тогда основаны абсолютная и относительная групповая специфичность. Например, цитохром-450 соединяется с таким большим количеством S-в, различных по строению. Эти внешние противоречия объясняет гипотеза Кошленда, или гипотеза вынужденного соответствия. По мнению Кошленда, молекула фермента не «жесткая», а гибкая структура и конфигурация фермента и его АЦФ начинают изменяться в момент присоединения фермента к S или другим лигандам. При образовании Е-S комплекса кроме геометрической комплементарности имеет место и электростатическая, которая осуществляется благодаря спариванию противоположно заряженных молекул Е и S. В действительности, видимо, имеют место оба варианта присоединения. 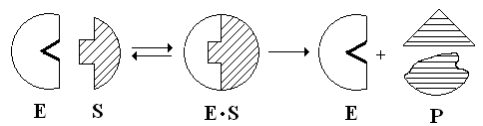 Гипотеза Кошленда позволяет объяснить, почему происходит превращение близких аналогов S-в. Если «ложный» субстрат (квази-S) отличается от природного и АЦФ принимает конформацию близкую к истинному субстрату, то расстановка каталитических групп в таком Е-S комплексе позволит осуществить реакцию. Этот «обман» фермент как бы не замечает, хотя реакция идет и не так быстро, как с истинным субстратом. Если конфигурация квази субстрата не позволяет правильно расположиться каталитической группе, то в этом случае реакция не пойдет. Т.е. если диапазон конформационных перестроек ограничен до одной единственно возможной, то фермент высокоспецифичен, а если возможности перестройки АЦФ велики, то фермент срабатывает и на квази субстраты. Вопрос 6 Сходство и отличие ферментов и неорганических катализаторов. Кинетика ферментативных реакций. Константа Михаэлиса. Скорость ферментативных реакций. Уравнение Михаэлиса-Ментена. Зависимость скорости ферментативных реакций от концентрации субстрата и фермента, от температуры и рН. Сходство и отличия ферментов и неорганических катализаторов. Сходство. Катализируют только энергетически возможные реакции. Не изменяют направления реакции. Ускоряют наступление равновесия реакции, но не сдвигают его. Не расходуются в процессе реакции. Скрыть Отличия. Скорость ферментативной реакции намного выше. Высокая специфичность. Мягкие условия работы (внутриклеточные). Возможность регулирования скорости реакции. Кинетика ферментативных реакций - раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической природы реагирующих веществ, а также от факторов окружающей среды. Для измерения каталитической активности ферментов используют такие показатели, как скорость реакции или активность фермента. Скорость ферментативной реакции определяется изменением количества молекул субстрата или продукта за единицу времени. Скорость ферментативной реакции - мера каталитической активности фермента, её обозначают как активность фермента. Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции,катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса: Уравнение имеет вид: где Для более удобного графического представления экспериментальных данных Г. Лайнуивер и Д. Бэрк преобразовали уравнение Бриггса–Хол-дейна по методу двойных обратных величин исходя из того принципа, что если существует равенство между двумя какими-либо величинами, то и обратные величины также будут равны. В частности, если 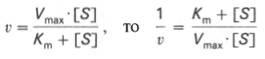 или 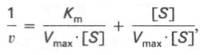 то после преобразования получаем уравнение: 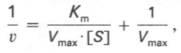 которое получило название уравнения Лайнуивера–Бэрка. При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax. Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Это наблюдение легло в основу ферментативной кинетики, разработанной учёными Л. Михаэлисом и М. Ментен в 1913 г. Ферментативный процесс можно выразить следующим уравнением:  где k1 - константа скорости образования фермент-субстратного комплекса; k-1 - константа скорости обратной реакции, распада фермент-субстратного комплекса; k2 - константа скорости образования продукта реакции. Следующее соотношение констант скоростей (k-1 + k2)/k1 называют константой Михаэлиса и обозначают Кm. Скорость реакции пропорциональна концентрации фермент-субстратного комплекса ES, a скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента. На концентрацию ES влияет скорость формирования и распада ES. Наибольшая скорость реакции наблюдается в том случае, когда все молекулы фермента находятся в комплексе с субстратом, т.е. в фермент-субстратном комплексе ES, т.е. [Е] = [ES]. Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением (математическое выведение этой формулы можно найти в пособиях по ферментативной кинетике): V = Vmax[S]/ Km + [S] Это уравнение получило название уравнения Михаэлиса-Ментен. В случае, когда скорость реакции равна половине максимальной, то Km = [S] (т.е. константа Михаэлиса равняется равновесной концентрации субстрата. (рис. 6). Таким образом, константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ И ПРАКТИЧЕСКИЕ ЗАДАНИЯ К ЗАЧЕТУ ПО ДИСЦИПЛИНЕ «БИОХИМИЯ» Специальность31.05.01«Лечебноедело» Теоретическиевопросы Генетический код, его важнейшие свойства. Генетический код – это система записи наследственной информации в молекулах нуклеиновых кислот, основанная на определённом чередовании последовательностей нуклеотидов в ДНК или РНК, образующих кодоны, соответствующие аминокислотам в белке. Генетический код имеет несколько свойств. Триплетность. Вырожденность или избыточность. Однозначность. Полярность. Неперекрываемость. Компактность. Универсальность. Биосинтез белков. Одним из важнейших процессов биосинтеза в клетке является процесс биосинтеза белков, который включает в себя особые реакции, встречающиеся только в живой клетке — это реакции матричного синтеза. Синтез белка в клетке протекает при участии специальных органелл — рибосом. Это немембранные органеллы, состоящие из рРНК и рибосомальных белков. 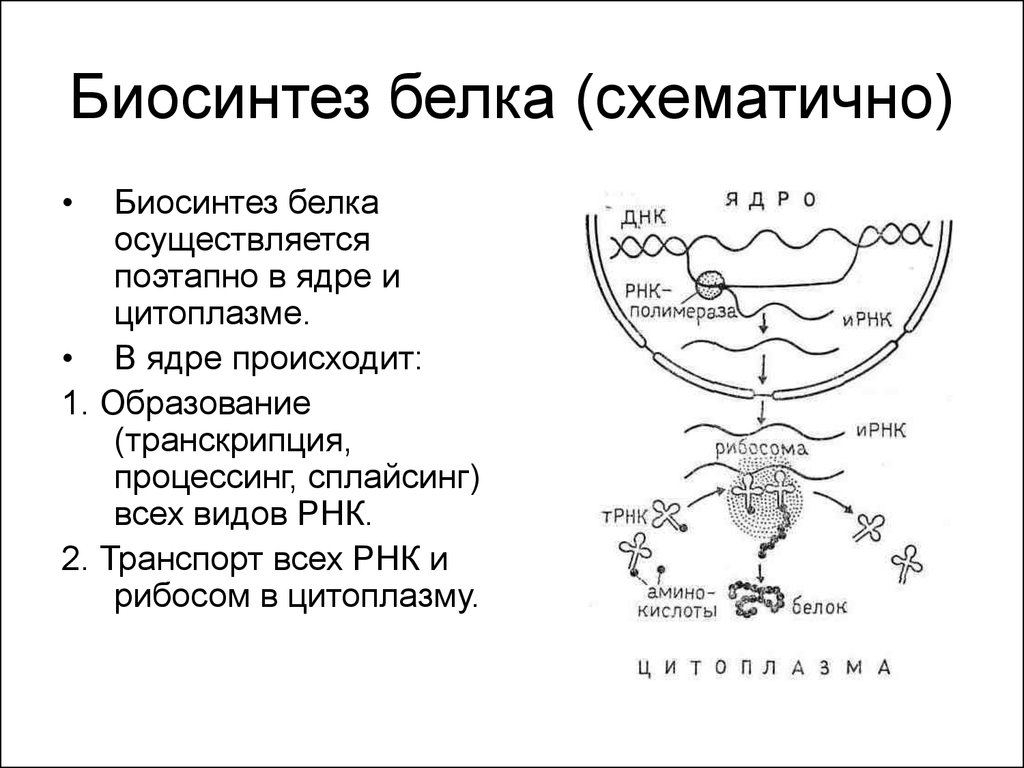  Активация аминокислот, субстратная специфичность аминоацил-т-РНК-синтетаз, адапторная функция т-РНК. Трансляция, этапы (инициация, элонгация, терминация,). Три обязательные стадии матричных биосинтезов: инициация → элонгация → терминация Инициация – процесс, в котором образуется первая связь между мономерными звеньями создаваемой полимерной цепи. Истинная инициация отличается от всех остальных стадий биосинтеза тем, что в ней принимают участие две молекулы мономера, в то время как на остальных стадиях одним из субстратов является растущая цепь продукта реакции, т.е. олигомер. Элонгация - процесс поэтапного удлинения цепи растущего полимера. При каждом цикле элонгации на начальной его стадии происходит выбор такого субстрата, который соответствует считываемому в данный момент кодовому сигналу на молекуле матрицы. •Терминация - процесс остановки роста синтезируемой полимерной цепи и отсоединение ее от матрицы. Окончание синтеза полимера, как правило, происходит на некотором расстоянии от физического конца матрицы, поэтому для осуществления терминации используются особые кодовые сигналы, при считывании которых с матрицы присоединение очередного мономерного звена оказывается невозможным. Энергетические источники. Посттрансляционное созревание молекулы белков. Процесс фолдинга. Ферменты фолдинга, шапероны. Репарация ДНК. РЕПАРАЦИЯ (от лат. reparatio — восстановление), процесс восстановления природной (нативной) структуры ДНК, повреждённой при репликации или внешних воздействиях и процессах внутри организма. ДНК является единственной молекулой, которая способна к репарации. Основные типы повреждений ДНК. Основные типы повреждений ДНК. Повреждения ДНК - любое изменение ДНК, которое вызывает отклонение от нативной структуры. На уровне одного нуклеотида: • Отсутствие основания • Некомплементарное основание • Нарушенное основание Структурные: • Образование неспецифических связей между цепями (тиминовые димеры и поперечные сшивки) • Одноцепочечные разрывы • Двухцепочечные разрывы. Изменение структуры азотистых оснований алкилированинием 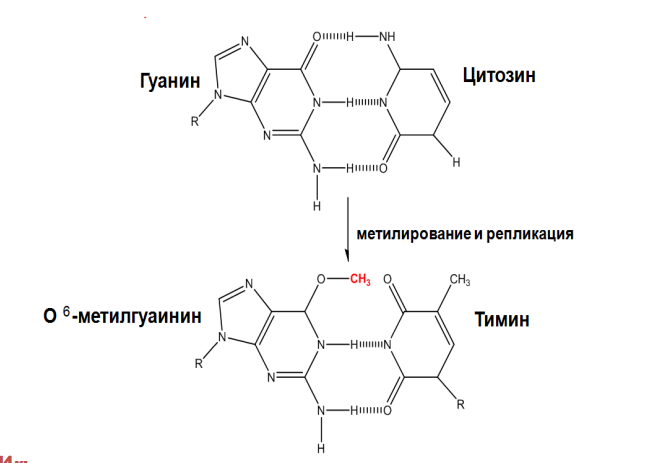 Окисление азотистых оснований под действием активных форм кислорода (О•, О-О•, НООН, •ОН) 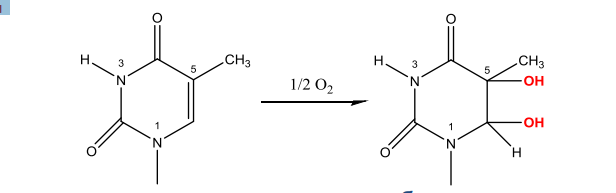 Гидролиз: • Дезаминирование. • Все продукты дезаминирования (урацил, гипоксантин, ксантин) нехарактерны для состава ДНК и поэтому довольно легко распознаются ферментами репарации. 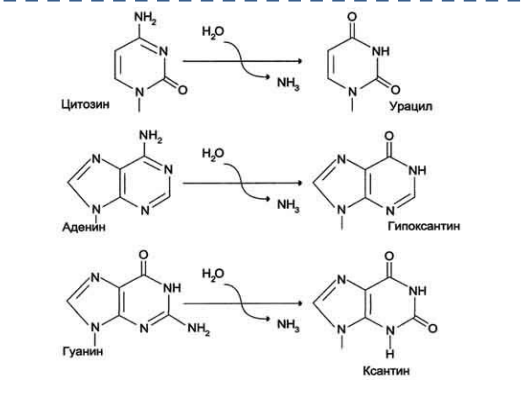 Депуринизация - спонтанное удаление аденина или гуанина 3.Димеризация пиримидинов (чаще всего тиминов, реже цитозинов), через образование циклобутанового кольца. 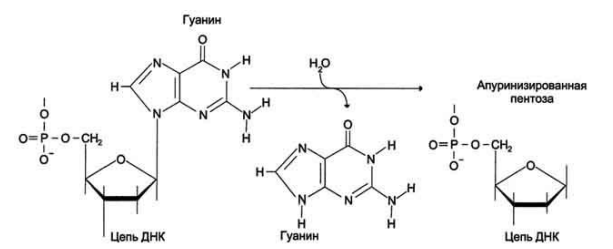 Разрыв цепей (одиночные и двойные разрывы); Образование аддуктов (бензо[a]пирен-диол-эпоксид-dG-аддуктов); Межнитевые сшивки. Сшивки ДНК-белок. Прямая репарация. Прямая репарация — наиболее простой путь устранения повреждений в ДНК, в котором обычно задействованы специфические ферменты, способные быстро (как правило, в одну стадию) устранять соответствующее повреждение, восстанавливая исходную структуру нуклеотидов. Виды прямой репарации: Фотореактивации ДНК: Восстановительный эффект при фотореактивации связан с действием фермента — фотолиазы (дезоксирибопиримидинфотолиазы), представляющей собой полипептид, ассоциированный с небольшой молекулой РНК (10-15 нуклеотидов). Фермент поглощает фотон света (синего света), после чего приобретает способность расщеплять циклобутановый мостик между пиримидиновыми нуклеотидами. Репарация метилированного гуанина с участием метилтрансфераз. О6 -метилгуанин-ДНКметилтрансфераза ( фермент – самоубийца), которая снимает метильную группу с азотистого основания на один из собственных остатков цистеина У Е. coli может в 1 мин синтезироваться до 100 молекул этого белка. Аналогичный по функциям белок высших эукариот, очевидно, играет важную роль в защите от рака, вызываемого внутренними и внешними алкилирующими факторами. Репарация АП-сайтов инсертазами. Образовавшиеся в результате удаления пурина АР-сайты могут быть залечены ферментами инсертазами (от англ. insert - вставлять). Эти ферменты могут встраивать в брешь, присоединив к дезоксирибозе, такое же основание, какое было до поражения. В результате структура ДНК восстанавливается. 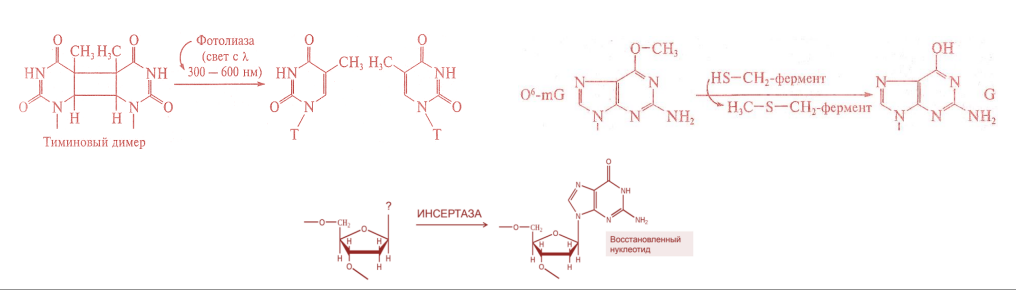 Экцизионная репарация. Экцизионная репарация —многостадийный путь устранения повреждений в ДНК, в котором специфические экцизионные ферменты, способные вырезать из цепи ДНК отдельные фрагменты, отсюда происходит и термин «экцизионная репарация» (анг. еxcision -вырезание). 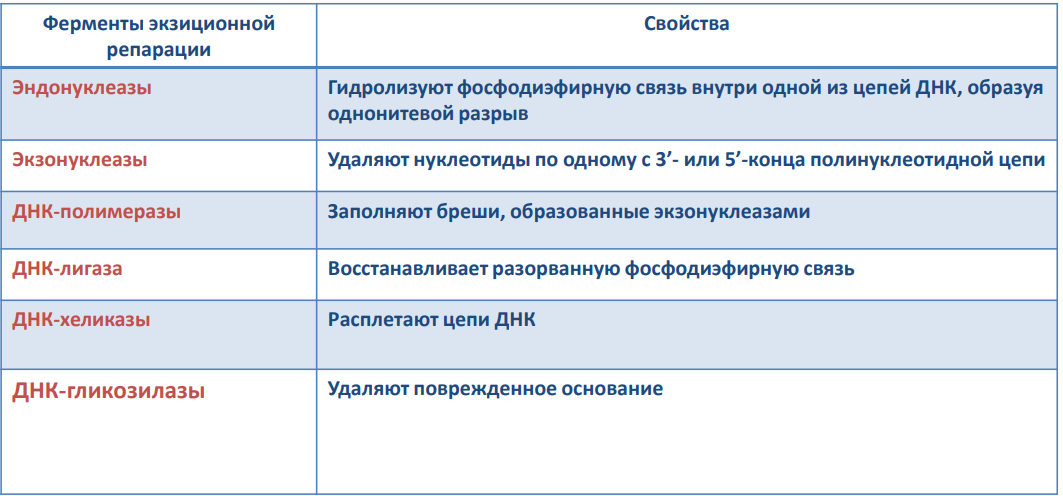 Заболевания, обусловленные дефектами системы репарации. Пигментная ксеродерма Нарушена эксцизионная репарация. Клинические проявления: - дерматозы под действием солнечного света - рак кожи - неврологические нарушения - дефекты роста и развития - преждевременное старение различных систем Синдром Блума Подавлен репаративный синтез. Дефект ДНК-хеликазы. Высокая частота хромосомных аберраций. Клинические проявления: - задержка роста и развития - нарушения иммунной системы - предрасположенность к раковым заболеваниям - предрасположенность к инфекционным заболеваниям - свето-индуцируемое поражение капилляров кожи Строение и функции клеточных мембран. Биологическая мембрана – надмолекулярная структура, представляющая собой липопротеидные пленки (6-10 нм), состоящая из двух слоев липидов, в который погружены белки. В бислое неполярные гидрофобные «хвосты» обращены друг к другу (погружены в толщу мембраны), а полярные гидрофильные «головки» ориентированы наружу. Биомембраны при ничтожно малой (по сравнению с протяженностью) толщине механически прочны, за счет гидрофобного взаимодействия. Кроме того, в состав биомембран входят углеводы (приблизительно 10 %) (жидкостно-мозаичная модель, Сенгер, Николсон, 1972) определяет ее величину, форму; поддерживает разницу концентраций ионов по обе стороны мембраны и позволяет питательным веществам проникать внутрь клетки, а продуктам выделения выходить наружу; участвует в межклеточных контактах; восприятие и передача сигнала из внешней среды; связана с различными ферментами; Липидный состав и строение липидного бислоя. 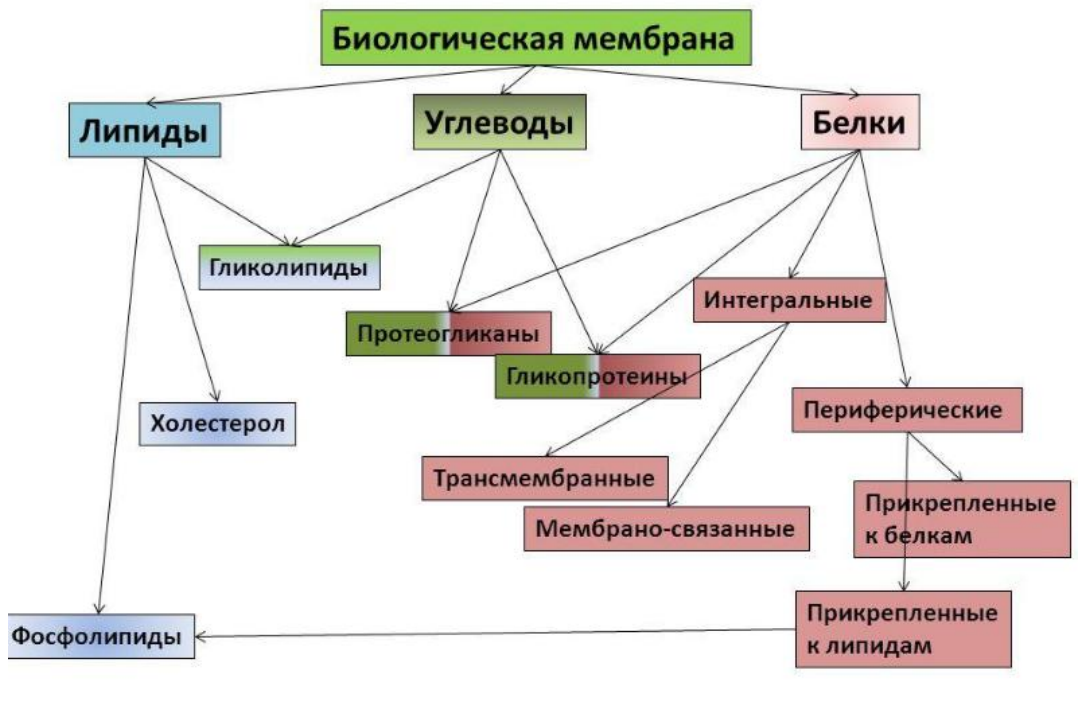 Фосфолипиды (ФЛ) представляют собой соединение спирта глицерола или сфингозина с высшими жирными кислотами и фосфорной кислотой. В их состав также входят азотсодержащие соединения холин), этаноламин, серин, циклический шестиатомный спирт инозитол). Фосфолипиды – основные компоненты клеточных мембран. Гликолипиды (ГЛ) построены из сфингозина, остатка жирной кислоты и олигосахарида. Заметим, что в них отсутствует фосфатная группа. Белки мембран. Интегральные белки прочно удерживаются в мембране с помощью гидрофобных взаимодействий. Их молекулы амфифильны. Гидрофобная часть этих белков находится в в зоне гидрофобных хвостиков фосфолипидов, а гидрофильная – контактирует с жидкими средами (цитоплазмой и межклеточной жидкостью). Периферические белки менее прочно удерживаются в мембране с помощью ионных связей. |
