Биохимия (зачет). Вопрос 1 Первичная структура белков
 Скачать 4.52 Mb. Скачать 4.52 Mb.
|
|
Фосфопротеины Фосфопротеины – это сложные белки, простетической группой которых является остаток фосфорной кислоты. Она связывается с пептидной цепью через остатки тирозина, серина и треонина, т.е. тех аминокислот, которые содержат ОН-группу. 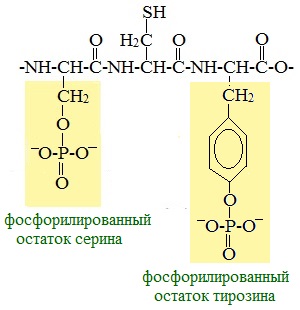 К белкам этого класса относятся: казеин молока, в котором содержание фосфорной кислоты достигает 1%; вителлин, вителлинин и фосвитин, выделенные из желтка куриного яйца; овальбумин, открытый в белке куриного яйца; ихтулин, обнаруженный в икре рыб и, который играет немаловажную роль в развитии эмбриона рыб. Биологическая роль фосфопротеинов заключается в том, что они являются питательными веществами необходимыми для растущих организмов. Фосфопротеины – это ценный источник энергетического и пластического материала для развития зародыша и дальнейшего роста и развития организма. Например, казеин (казеиноген) молока содержит все незаменимые аминокислоты и фосфорную кислоту. В его состав также входят ионы кальция. Фосфор и кальций необходимы растущему организму в больших количествах для формирования скелета. Гликопротеины Гликопротеины (гликоконъюгаты) – это сложные белки, которые содержат в качестве простетической группы углеводный компонент. У некоторых гликопротеидов углеводная часть непрочно связана с белком и может легко от него отделяться. Простетические группы некоторых гликопротеидов могут встречаться в тканях и в свободном состоянии. Гликопротеины широко распространены в природе. Они встречаются в секретах (слюне и т.д.), в составе клеточных мембран, клеточных стенок, межклеточного вещества, соединительной ткани. Многие ферменты и транспортные белки являются гликопротеинами. Гликопротеины разделяют на истинные гликопротеины и протеогликаны. Истинные гликопротеины Углеводная часть гликопротеинов представлена небольшими гетерополисахаридами или олигосахаридами нерегулярного строения и содержит маннозу, галактозу, глюкозу, и их аминопроизводные. Белок в них составляет 80-85% массы макромолекулы. Для гликопротеинов характерна ковалентная гликозидная связь. N-гликозидная связь возникает между углеводным компонентом и амидной группой аспарагина в белках. Например, в иммуноглобулинах, ферментах и гормонах). О-гликозидная связь – моносахарид связан с ОН-группой серина или треонина (в муцинах), а иногда с ОН-группой гидроксилизина или гидроксипролина (коллагены). 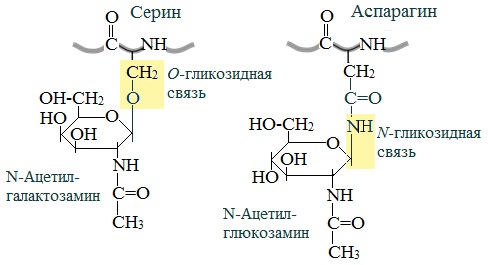 К типичным гликопротеинам относят большинство белковых гормонов, секретируемые в жидкие среды организма вещества, мембранные сложные белки, все антитела (иммуноглобулины), белки плазмы крови, молока, интерфероны, группы крови. Функциии гликопротеинов Структурная – коллаген, эластин. Защитная – антитела (иммуноглобулины), интерферон, факторы свертывания крови (протромбин, фибриноген). Рецепторная – присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ. Гормональная – гонадотропный, адренокортикотропный и тиреотропный гормоны. Ферментативная – ферменты: холинэстераза, нуклеаза. Транспортная – перенос веществ в крови и через мембраны (трансферрин, транскортин, альбумин, Na+,К+-АТФаза). Нуклеопротеины Нуклеопротеины (ДНП и РНП) – это сложные белки, простетической группой которых являются нуклеиновые кислоты (РНК и ДНК). В природе обнаружено 2 типа нуклеопротеинов – дезоксирибонуклеопротеины (ДНП) – комплексы белков с дезоксирибонуклеиновой кислотой (ДНК) и рибонуклеопротеиды (РНП) – комплексы белков с рибонуклеиновой кислотой (РНК). ДНП преимущественно локализованы в ядре, митохондриях, а РНП – в цитоплазме, а в ядре (ядрышке) обнаружены также высокомолекулярные РНП. Выделяют два вида нуклеиновых кислот в зависимости от пентозы, входящей в их состав – рибонуклеиновая кислота (РНК), если в ее состав входит рибоза и дезоксирибонуклеиновая кислота (ДНК), если в ее состав входит дезоксирибоза. Вопрос 4 Железосодержащие хромопротеины. Строение, свойства и биологическая роль гемоглобина. Производные гемоглобина, особенности их строения и значение. Формы гемоглобина (Р, F ,А, S и др.), гемоглобинопатии. Хромопротеины. Это белки, простетическая группа которых имеет окраску. К ним относятся многие белки, содержащие металлы. Например, церулоплазмин — белок, содержащий медь, имеет синюю окраску. Белки, содержащие железо, — гемопротеины (гемоглобин, миоглобин, цитохромы) — окрашены в красный цвет. Присутствие витамина B2 придает белкам желтый цвет (флавопротеины). Простетическая группа хромопротеинов связана с гистидином полипептидной цепи координационными связями. Гемоглобин – сложный белок, основной компонент эритроцитов, переносящий кислород от легких ко всем тканям организма и участвующий в выведении углекислого газа из клеток организма. Молекула гемоглобина состоит из гема (небелковой части) и глобина (белковой части, которая содержит в своей молекуле четыре полипептидные цепи: две альфа-цепи и две бета-цепи). К каждой из четырех глобиновых субъединиц прикреплена группа гема с атомом железа. Производными гемоглобина называются продукты его взаимодействия с различными лигандами. К ним относятся: - оксигемоглобин, - карбоксигемоглобин, - метгемоглобин, - карбгемоглобин. Оксигемоглобин (НвО2) - соединение гемоглобина с молекулярным кислородом. Основная функция гемоглобина - перенос кислорода от лёгких к тканям. Кислород мало растворим в воде. Один литр крови без гемоглобина способен связать лишь 3 мл кислорода, а в присутствии Нв эта способность повышается в 60-70 раз. Учитывая, что 1 г гемоглобина связывает 1,34 мл кислорода, а в 100 мл крови содержится 13-16 г гемоглобина и он насыщается кислородом на 96%, 100 мл крови будет содержать 15 х 1,34 х 96/100 =19,3 мл О2/100 мл крови. Карбоксигемоглобин (НвСО) - соединение гемоглобина с угарным газом. Сродство гемоглобина к угарному газу в 200 раз выше, чем к кислороду. Поэтому даже при концентрации 0,05% СО во вдыхаемом воздухе 50% гемоглобина переходит в НвСО, а при образовании 70% НвСО наступает смерть. Разложение НвСО протекает в 30 раз медленнее, чем диссоциация оксигемоглобина. Поэтому труп человека, отравившегося угарным газом, долгое время сохраняет розовый цвет, т.к образовавшийся НвСО не восстанавливается в гемоглобин. Метгемоглобин (НвОН). Образование метгемоглобина происходит в месте ушибов, а также при соприкосновении крови с воздухом (заборе крови, гематурии). N N Fe 3+ ОН N N В норме около 0,5% гемоглобина в крови превращается в метгемоглобин, однако концентрация его в крови не превышает 1 г %, так как под влиянием метгемоглобинредуктазы с участием НАДН2 он вновь переходит в гемоглобин. Нв(Fe+++) Нв(Fe++) При наследственной заболевании- семейной метгемоглобинемии – активность этого фермента резко падает, содержание метгемоглобина в крови достигает 40% и наступает выраженный гемолиз эритроцитов. Метгемоглобин образуется при отравлении бертолетовой солью нитратами и другми соединениями, способствующими окислению Fe++ в Fe+++. В результате гемоглобин теряет способность переносить кислород, развивается гипоксемия, а затем гипоксия тканей. При образовании 75% метгемоглобина в крови наступает аноксия и смертельный исход. Карбгемоглобин (НвСО2) - соединение гемоглобина с углекислым газом. В отличие от всех остальных производных СО2 присоединяется не к гему, а к белковой части по типу образования карбаминовой кислоты. Карбгемоглобин имеет темную краску, обуславливая цвет венозной крови. Выполняет транспортную функцию, осуществляя перенос части СО2, образовавшегося в тканях, к легким. Выделяют 4 основных типа гемоглобина: HbА1 — гемоглобин взрослого, его молекула построена из двух α- и двух β-субъединиц. На его долю приходится более 90% общего гемоглобина. HbА2 — минорный. 2 α и 2 δ частицы. 1% от общего Hb. HbF — фетальный (2 α, 2 γ). Является основным гемоглобином плода. HbP — эмбриональный (2 α, 2 ε). Преобладает у эмбриона. Гемоглобинопатии Серповидноклеточная анемия - тяжёлое наследственное заболевание, обусловленное точечной мутацией гена, кодирующего структуру β-цепи гемоглобина (см. раздел 4). В результате в эритроцитах больных присутствует HbS, β-цепи которого в шестом положении вместо гидрофильной глутаминовой кислоты содержат гидрофобную аминокислоту валин. Появление гидрофобной аминокислоты недалеко от начала молекулы способствует возникновению нового центра связывания, поэтому при низком парциальном давлении кислорода тетрамеры дезокси-HbS ассоциируют, образуя длинные микротрубчатые образования, которые полимеризуются внутри эритроцитов. Полимеризация приводит к нарушению структуры эритроцитов, они приобретают серповидную форму и легко разрушаются. При этом заболевании отмечают анемию, прогрессирующую слабость, отставание в развитии и желтуху. Вопрос 5 Современные представления о химической природе и строении ферментов. Активный (каталитический, контактный) и аллостерический центры. Ферменты-протеины и ферменты-протеиды. Химическая природа и структура коферментов: НАД, НАДФ, ФАД, ФМН. Специфичность ферментов. Виды специфичности. Теории специфичности. Общая характеристика Ферменты — биологические катализаторы. Это доказывает сходство ферментов и катализаторов: 1. повышают скорость химической реакции; 2. действуют в мизерных концентрациях; 3. не расходуются в ходе реакции; 4. не смещают химическое равновесие реакций. Но, поскольку все ферменты являются белками, существует ряд их отличий от неорганических катализаторов: 1. ферменты более активны; 2. они регулируемы; 3. работают только в узких рамках физиологических параметров (температура, рН и др., см. ниже); 4. ферменты специфичны. Рассмотрим подробнее типы специфичности ферментов: а) абсолютная: один фермент реагирует только с одним видом субстрата1 (обозначается — S) в реакции только одного типа. Это самый распространенный тип специфичности, поэтому он не нуждается в примерах; 1 Субстрат — так называют вещество, которое катализирует фермент (прим. автора). б) относительная: 1 фермент — несколько субстратов — 1 реакция (пример: пищеварительные ферменты); в) стереоспецифичность: фермент работает только с одним из изомеров субстрата (пример: малатдегидрогеназа). 2. Строение сложных ферментов Замечу, что энзимы (как и все белки) делят на простые и сложные. Простые — их молекула построена только из аминокислот. Сложные — в их состав входит также небольшая небелковая часть. Рассмотрим подробнее строение сложных ферментов. Белковая часть их молекулы (бо̀льшая по размеру) — апофермент; небелковая — кофактор. Кофакторы делят на: а) кофермент — связан с апоферментом легко, нековалентно и поэтому может на время отходить от белковой части; б) простетическая группа — связана с апоферментом ковалентно, жестко. Строение активного центра Активный центр — это рабочий орган фермента, с его помощью энзим и проводит реакцию катализа. В его состав входят аминокислотные последовательности и кофактор (у сложных энзимов). Активный центр построен из двух частей: а) контактная площадка — особая «выемка» в теле фермента, она выполняет две функции: во-первых, контакт с субстратом (S) и его удержание; во-вторых, она по форме и положению функциональных групп идеально сочетается с субстратом (и только с ним), следовательно, обеспечивает специфичность. б) каталитический участок — «сердце» энзима, именно он обеспечивает катализ, т. е. — ускорение реакции. Если фермент сложный, то его кофактор является тем самым каталитическим участком. 4. Аллостерический центр. Если активный центр есть у каждого фермента, то аллостерический — лишь у избранных (о них я расскажу позднее), эту группу так и называют — аллостерические ферменты. Аллостерический центр не похож на активный и выполняет иную функцию — регуляторную. К нему могут специфически присоединяться только особые вещества — эффекторы (модификаторы), которые делятся на: активаторы (ускоряют работу энзима) и ингибиторы (замедляют). Таким образом, аллостерический центр можно сравнить с «выключателем», с помощью которого можно управлять ферментом (а, следовательно — и химической реакцией), т. е. подстегивать его работу или, наоборот, притормаживать. Повторю, функция аллостерического центра — регуляция скорости химического процесса. Простые ферменты - ферменты-протеины - состоят только из аминокислот, а сложные ферменты - ферменты-протеиды - в своем составе имеют белковую часть - апофермент, состоящую из одних аминокислот, и небелковую часть - кофермент, или простетическую группу. Небелковая часть может быть представлена минеральными веществами, витаминами и т. д. НАД, NAD -- кофермент, присутствующий во всех живых клетках, входит в состав ферментов группы дегидрогеназ, катализирующих окислительно-восстановительные реакции; выполняет функцию переносчика электронов и водорода, которые принимает от окисляемых веществ. Восстановленная форма (NADH) способна переносить их на другие вещества. Представляет собой динуклеотид, молекула которого построена из амида никотиновой кислоты и аденина, соединённых между собой цепочкой, состоящей из двух остатков D-рибозы и двух остатков фосфорной кислоты; применяется в клинической биохимии при определении активности ферментов крови. 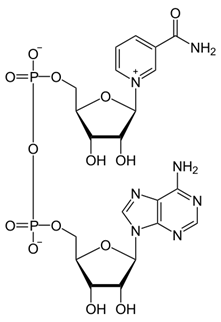 Рис. 12. Строение кофермента НАД. НАДФ, NADP -- широко распространённый в природе кофермент некоторых дегидрогеназ -- ферментов, катализирующих окислительно-восстановительные реакции в живых клетках. NADP принимает на себя водород и электроны окисляемого соединения и передаёт их на другие вещества. В хлоропластах растительных клеток NADP восстанавливается при световых реакциях фотосинтеза и затем обеспечивает водородом синтез углеводов при темновых реакциях. NADP, -- кофермент, отличающийся от NAD содержанием ещё одного остатка фосфорной кислоты, присоединённого к гидроксилу одного из остатков D-рибозы, обнаружен во всех типах клеток. 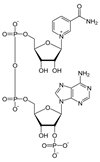 Рис. 13. Строение кофермента НАДФ. ФАД, FAD -- кофермент, принимающий участие во многих окислительно-восстановительных биохимических процессах. FAD существует в двух формах -- окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами.  Рис. 14. Строение кофермента ФАД. Кофермент А (коэнзим А, КоА, СоА, HSKoA) -- кофермент ацетилирования; один из важнейших коферментов, принимающий участие в реакциях переноса ацильных групп при синтезе и окислении жирных кислот и окислении пирувата в цикле лимонной кислоты. Молекула КоА состоит из остатка адениловой кислоты (1), связанной пирофосфатной группой (2) с остатком пантотеновой кислоты (3), которая в свою очередь связанна пептидной связью с аминокислотой в-аланином (4) (эти две группы представляют собой остаток пантотеновой кислоты), соединённой пептидной связью с остатком в-меркаптоэтаноламина (5). 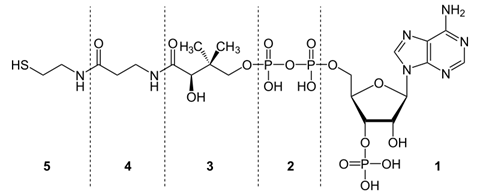 Рис. 15. Строение кофермента А. Важнейшее биологическое свойство ферментов – специфичность. Специфичность ферментов характеризует их способность катализи-ровать определенные типы превращений тех или иных субстратов. Фермент может катализировать более одного типа превращений. Так, многие карбогидразы (целлюлазы, β-глюказидазы, глюкоамила-за, β-галактозидаза) катализируют как гидролиз полисахаридов, так и перенос гликозильных остатков на углеводные субстраты. Понятие Е·S комплекса и АЦФ тесно взаимосвязаны с особым свойством ферментов – их специфичностью. По степени специфичности (в порядке ее снижения) различают: I. Стереохимическую субстратную специфичность – в этом случае ферменты катализируют только 1 форму S (1 изомер). Например, фумаратгидратаза катализирует только превращение фумаровой кислоты, но не катализирует превращение ее изомера – малеиновую кислоту. II. Абсолютную субстратную специфичность – Е превращает только 1S. Например, уреаза превращает только мочевину. III. Абсолютная групповая S-ную специфичность. Ферменты действуют на группу сходных S-в. Например, алкоголь ДГ превращает не только этанол, но и другие алифатические спирты. IV. Относительную групповую S-ную специфичность. Фермент воздействует не на группу молекул S, а на определенные связи определенных групп S-в. Например, пепсин и трипсин специфичны по отношению к пептидным связям в различных белках. V. Относительную S-ную специфичность. Фермент катализирует, превращаясь в S-в, относящимся к различным группам химических соединений. Например, фермент цитохром-450 катализирует реакции гидроксилирования до 7000 разных S-в. Это наименее специфичная ферментная система. |
