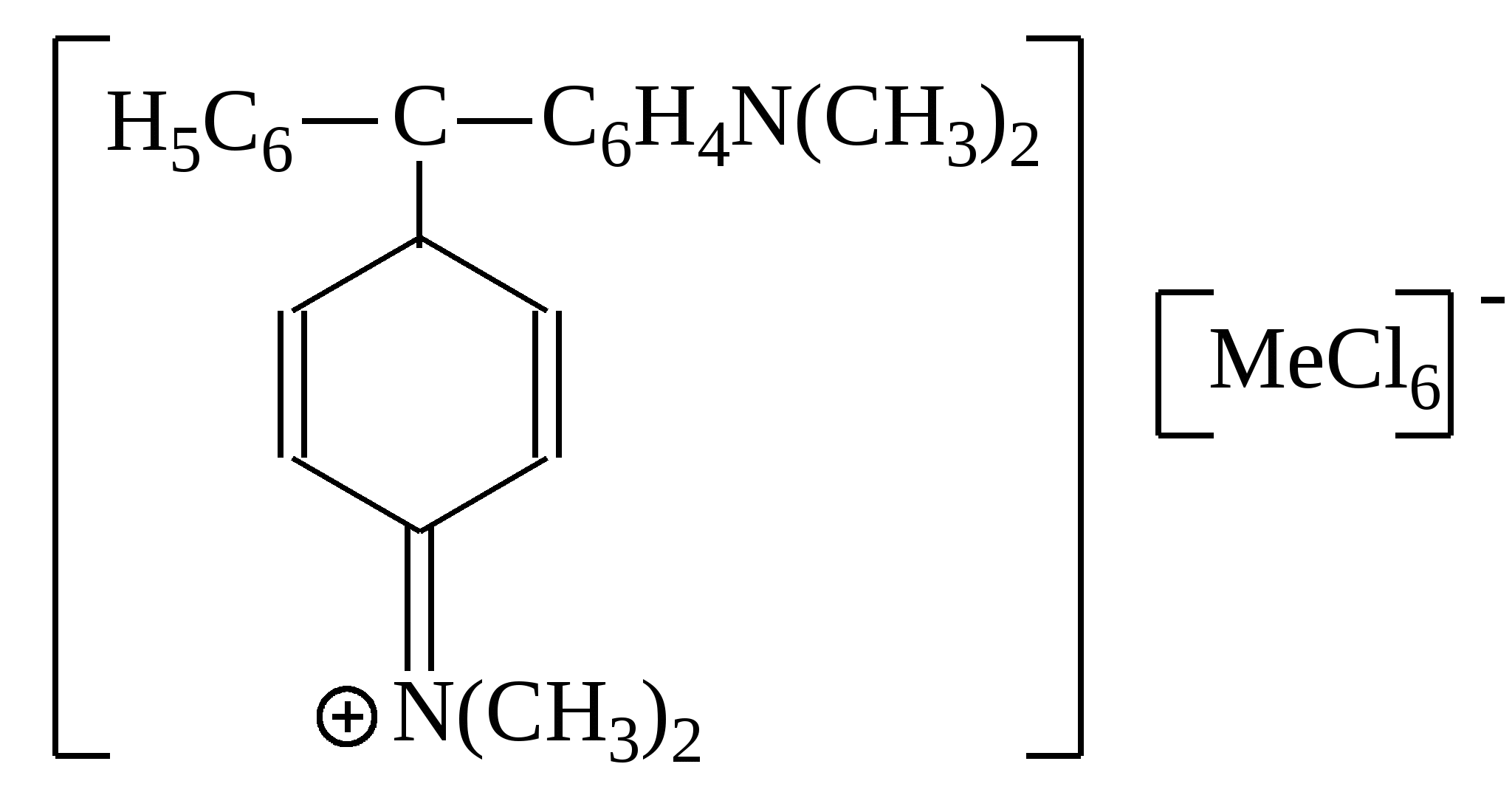Тема 2: Химико-токсикологический анализ группы веществ, изолируемых дистилляцией. Частные вопросы токсикологии и анализа «летучих» ядов. ГЖХ для определения «летучих» ядов. Схема анализа дистиллята на основе комбинации химического и газохроматографического методов. Экспресс-диагностика алкогольной интоксикации.
Из предложенных веществ в группу «летучих» ядов входят:
Фенол
Дихлорэтан
Этиленгликоль
Антипирин
Анилин
При дистилляции «летучих» ядов нельзя применять минеральную кислоту, т.к. это приводит к таким нежелательным последствиям как:
Переоткрытие синильной кислоты
Гидролиз солей синильной кислоты и ее потери
Недооткрытие фенола
Переоткрытие фенола
Разложение алкилгалогенидов
Уксусная кислота обнаруживается всеми перечисленными реакциями, кроме реакций образования:
Этилацетата
Индофенола
Окиси какодила
Этиленгликоля
Комплекса с хлоридом железа (III)
При дистилляции «летучих» ядов к объекту добавляют:
Слабый раствор минеральной кислоты
Щавелевую кислоту
Раствор гидроксида натрия
Виннокаменную кислоту
Гидрокарбонат натрия
При перегонке первые порции дистиллята собирают в:
Пустую склянку
Раствор щавелевой кислоты
Дистиллированную воду
Раствор гидроксида натрия
Раствор гидрокарбоната натрия
При химико-токсикологических исследованиях количественное определение синильной кислоты:
Обязательно
Необязательно
Желательно
При химико-токсикологических исследованиях количественное определение уксусной кислоты:
Обязательно
Желательно
Проводится при специальных запросах
Продуктами метаболизма хлороформа являются вещества (вещество):
Ацетон
CO2 и HCl
Кислота синильная
Формальдегид
Дихлорэтан
Муравьиная кислота является продуктом метаболизма вещества (веществ):
Четыреххористого углерода
Формальдегида
Хлороформа
Синильной кислоты
Дихлорэтана
Положительное химико-токсикологическое значение имеет реакция обнаружения синильной кислоты:
Образования берлинской лазури
Образования роданида железа
Образование цианида серебра
Какой реакцией можно обнаружить уксусную кислоту в присутствии этанола:
Образования индиго
Йодоформной пробой
С нитропруссидом натрия
Образования индофенола
С реактивом Марки
Из предложенных веществ в группу «летучих» ядов входят:
Уксусная кислота
Антипирин
Фенол
Амидопирин
Этиленгликоль
Реакциями обнаружения уксусной кислоты являются реакции:
С бромной водой
Этерификации
С резорцином
С хлоридом железа (III)
С кодеином
Для изолирования синильной кислоты используют:
Суховоздушную дистилляцию
Метод макродистилляции
Метод фракционной перегонки с дефлегматором
Метод Карандаева
Метод микродистилляции
Метод Герасимова
Метод дистилляции можно применять для веществ:
Несмешивающихся с водой
Образующих с водой азеотропную смесь
Плохо растворимых в воде
Смешивающихся с водой в любых соотношениях
Хорошо растворимых в воде
Для количественного определения спиртов в качестве внутреннего стандарта используют:
Пропиловый спирт
40-% раствор нитрита натрия
Фенол
Изоамиловый спирт
Изопропиловый спирт
1,2-этиленгликоль
Для количественного определения летучих ядов используют:
Метод относительной калибровки
Метод внешнего стандарта
Метод внутреннего стандарта
Метод абсолютной калибровки
Алкилнитритный метод
Условиями реакции окисления метилового спирта являются:
Охлаждение
Нагревание
Присутствие серной кислоты
Избыток дихромата калия
Добавление перманганата калия
В группу «летучих» ядов входят:
Хлороформ
Фосфорная кислот
Уксусная кислота
Анилин
Дихлорэтан
Отрицательное судебно-химическое значение имеют реакции обнаружения формальдегида с:
Резорцином
Хромотроповой кислотой
Реактивом Фелинга
Кодеином и серной кислотой
Нитратом серебра
При наличии фенола в дистилляте отмечаются следующие характерные признаки:
Маслянистые капли на поверхности
Молочновидное помутнение
Запах сивушных масел
Розоватые капли на дне приемника
Бесцветные капли на дне приемника
Условия реакции отщепления хлорид-ионов:
Выдерживание при комнатной температуре
Присутствие спиртового раствора щелочи
Присутствие раствора органической кислоты
Нагревание
Присутствие водного раствора щелочи
При обнаружении 1,2-дихлорэтана положительное судебно-химическое значение имеют реакции:
Образования этиленгликоля
Отщепления хлорид-ионов
Взаимодействия с хинолином
Фудживара
Образования ацетиленида меди
Исследование на изоамиловый спирт проводят при наличии в дистилляте:
Бесцветных капель на дне дистиллята
Запаха сивушных масел
Розоватых капель на дне приемника
Маслянистых капель на поверхности дистиллята
Молочновидного помутнения
При химико-токсикологических исследованиях хлоралгидрат определяется количественно методами:
Броматометрическим
Аргентометрическим
Весовым
Газохроматорафическим
Фотометрическим
При химико-токсикологических исследованиях формальдегид определяется количественно методами:
Роданометрическим
Колориметрическим
Гравиметрическим
Йодометрическим
Спектрофотометрическим
При химико-токсикологических исследованиях фенол определяется количественно методами:
Аргентометрическим
Алкалиметрическим
Броматометрическим
Гравиметрическим
Газохроматографическим
Реакцию окисления до альдегида можно использовать для обнаружения:
Фенола
Метанола
Формальдегида
Изоамилового спирта
Синильной кислоты
Муравьиная кислота является продуктом метаболизма веществ:
Четыреххористого углерода
Формальдегида
Хлороформа
Синильной кислоты
Дихлорэтана
Реакция, позволяющая обнаружить изоамиловый спирт в присутствии других спиртов (метилового, этилового):
Этерификации
Окисления
Образования алкилнитрита
С ароматическими альдегидами
Образования йодоформа
Этиловый спирт используют в качестве антидота при отравлении:
Синильной кислотой
Этиленгликолем
Метанолом
Фенолом
Каким общим методом можно количественно определить метанол и хлороформ:
Колориметрическим
Йодометрическим
Газохроматографическим
Аргентометрическим
Меркуриметрическим
Реакцией, позволяющей обнаружить этиловый спирт в присутствии других спиртов (метилового, изоамилового), является реакция:
Этерификации
Окисления
Взаимодействия с ароматическими альдегидами
Образования йодоформа
Образования этилнитрита
При химико-токсикологических исследованиях количественное определение фенола:
Обязательно
Необязательно
Желательно
Положительное судебно-химическое имеет реакция обнаружения фенола:
С бромной водой
С хлоридом железа (Ш)
Индофенольная проба
Реакция окисления
Реакция образования фенолята
Четыреххлористый углерод дает положительный результат во всех реакциях, кроме реакции:
Образования изонитрила
Отщепления хлорид-иона
Восстановления гидрата окиси меди
С резорцином в щелочной среде
Хлороформ дает положительный результат во всех реакциях, кроме реакции:
Отщепления хлорид-иона
С реактивом Несслера
С реактивом Фелинга
Образования изонитрила
В основе количественного определения формальдегида лежит реакция с:
Кодеином и концентрированной серной кислотой
Резорцином в щелочной среде
Реактивом Фелинга
Фуксинсернистой кислотой
Хромотроповой кислотой
При химико-токсикологических исследованиях кислота синильная определяется количественно в свежем трупном материале методом:
Аргентометрическим (способ обратного титрования)
Весовым
Колориметрическим
Присутствие какого общего реактива необходимо для проведения реакции окисления метанола и этанола при судебно-химическом анализе?
Концентрированной серной кислоты
Хлороформа
Гидроксида натрия
Карбоната натрия
Уксусной кислоты
Для изолирования этиленгликоля предпочтительнее использовать:
Перегонку с водяным паром
Суховоздушную дистилляцию
Метод Гуляевой
Метод Карандаева
Настаивание с водой в сочетании с диализом
УСТАНОВИТЕ СООТВЕТСТВИЕ (1-д, 2-б)
Биоматериал, содержащий с синильную кислоту
|
Метод количественного определения
|
Биоматериал свежий
Биоматериал несвежий
|
А. Алкалиметрия
Б. Гравиметрия
В. Ацидиметрия
Г. Нитритометрия
Д. Аргентометрия
|
УСТАНОВИТЕ СООТВЕТСТВИЕ (1-е, 2-д, 3-б, 4-а, 5-г, 6-в)
Метод дистилляции
|
Особенности метода
|
Метод макродистилляции
Метод фракционной перегонки с дефлегматором
Метод Карандаева
Метод микродистилляции
Метод Герасимова
Суховоздушная дистилляция
|
А. Применяют колбу-дефлегматор
Б. Используют для изолирования спиртов
В. Используют газовый хроматограф
Г. Используют для изолирования цианидов
Д. Применяют метод, позволяющий разделить многокомпонентную смесь
Е. Добавляют селективный уносчик
|
УСТАНОВИТЕ СООТВЕТСТВИЕ (1-б, 2-а,в,г,д)
Метод количественного определения
|
Вещество
|
Йодометрический
Аргентометрический
|
Хлороформ
Ацетон
Четыреххлористый углерод
Синильная кислота
Дихлорэтан
|
УСТАНОВИТЕ СООТВЕТСТВИЕ (1-в,2-г)
Вещество
|
Продукт метаболизма
|
Хлороформ
Фенол
|
Щавелевая кислота
Муравьиная кислота
Хлористый водород
Хингидрон
|
УСТАНОВИТЕ СООТВЕТСТВИЕ (1-д, 2-б, 3-г, 4-а, 5-в)
Вещество
|
Реакция обнаружения
|
Синильная кислота
Ацетон
Четыреххлористый углерод
Уксусная кислота
Дихлорэтан
|
Образование индиго
С нитропруссидом натрия
Образование ацетиленида меди
С резорцином
Образование берлинской лазури
|
УСТАНОВИТЕ СООТВЕТСТВИЕ (1-б, 2-в, 3-а)
Метод количественного
определения этанола
|
Реакции, лежащие в основе метода
|
Энзимный
Видмарка-Шоймоша
Газохроматографический
|
А. Образование алкилнитрита
Б. Окисление до уксусной кислоты
В. Окисление до уксусного ангидрида
|
ОТКРЫТАЯ ФОРМА ТЕСТА
Перечислите преимущества метода дистилляции.
Дайте определение абсолютному расстоянию (времени) удерживания.
Запишите формулу для определения максимальной концентрации этанола в плазме крови.
Запишите формулу расчета дозы выпитого спиртного.
Запишите формулу для определения максимальной концентрации вещества в плазме крови.
Дополните. Недостатками метода дистилляции являются ________ метода и необходимость _________ . (длительность, соответствующего оборудования)
Дополните. Метод газо-жидкостной хроматографии основан на _______ анализируемых веществ между ________ жидкой фазой и ________ газом. (распределении, неподвижной, инертным)
Дополните. Носитель – это ________ вещество, которое имеет малую _______ активность. (инертное, адсорбционную)
Тема 3: Химико-токсикологический анализ группы веществ, изолируемых минерализацией. Подготовка биологических образцов к исследованию. Методы изолирования. Техника минерализации. Денитрация минерализата. Качественные реакции на металлические яды. Схема дробного метода анализа минерализата. Мокрое озоление. Химико-токсикологический анализ соединений ртути и мышьяка.
В основе дробного метода анализа «металлических» ядов лежат принципы:
Обнаружение одного катиона в присутствии других
Создание селективных условий
Маскировка мешающих ионов
Предварительное разделение катионов
Применение органических реагентов
К частным методам минерализации относятся:
Сжигание под действием кислорода воздуха
Минерализация смесью серной и азотной кислот
Деструкция
Минерализация смесью серной, азотной и хлорной кислот
Сплавление с карбонатом и нитратом натрия
Наличие в минерализате окислителя мешает обнаружению катионов за счет:
Нарушения процессов окисления
Нарушения процессов восстановления
Восстановления органических реагентов
Окисления органических реагентов
Процессов гидролиза
Окислительные свойства минерализата обусловлены наличием в нем:
Азотной кислоты
Серной кислоты
Азотистой кислоты
Сернистой кислоты
Нитрозилсерной кислоты
Денитрация минерализата основана на процессах:
Гидролиза нитрозилсерной кислоты
Гидролиза сернистой кислоты
Восстановления азотной кислоты
Восстановления серной кислоты
Восстановления азотистой кислоты
Изолирование «металлических» ядов из биологического материала проводится методами:
Минерализации смесью серной и азотной кислот
Сплавления с карбонатом и нитратом натрия
Сжигания под действием кислорода воздуха
Кислотного гидролиза
Минерализации смесью серной, азотной и хлорной кислот
К общим методам минерализации относятся:
Деструкция
Минерализация смесью серной и азотной кислот
Простое сжигание
Минерализация смесью серной, азотной и хлорной кислот
Сплавление с окислительной смесью
В процессе минерализации смесью кислот протекают стадии:
Гидролиза
Деструкции
Пептизации
Глубокого жидкофазного окисления
Конъюгации
На первой стадии минерализации доминируют процессы:
Гидролиза белков до аминокислот
Окисления белков
Распада полисахаридов до ди- и моносахаридов
Распада сахаров до диоксида углерода и воды
Гидролиза жиров до жирных кислот и многоатомных спиртов
На второй стадии минерализации преобладают процессы:
Окисления белков до диоксида углерода, простейших аминов и воды
Гидролиза жиров
Окисления жиров до диоксида углерода и воды
Гидролиза белков
Окисления сахаров до диоксида углерода и воды
На первой стадии минерализации серная кислота выполняет следующие функции:
Окисляет молекулы органических веществ
Дегидратирует молекулы органических веществ
Сульфирует молекулы органических веществ
Повышает температуру кипения реакционной смеси
Обугливает органические вещества
В процессе минерализации азотная кислота выполняет следующие функции:
Повышает окислительные свойства серной кислоты
Окисляет молекулы органических веществ
Дегидратирует молекулы органических веществ
Нитрует молекулы органических: веществ
Повышает температуру реакционной смеси
На второй стадии минерализации серная кислота выполняет следующие функции:
Окисляет молекулы органических веществ
Гидролизует молекулы органических веществ
Повышает окислительный потенциал азотной кислоты
Дегидратирует молекулы органических веществ
Сульфирует молекулы органических веществ
Катион марганца можно обнаружить реакциями с:
Дифенилкарбазоном
Перйодатом калия
Диэтилдитиокарбаминатом натрия
Персульфатом аммония
Сульфатом натрия
Конец минерализации смесью серной и азотной кислот определяют по следующим признакам:
Объем минерализата уменьшается наполовину
Минерализат не темнеет в течение 30 минут без добавления азотной кислоты
Тяжелые белые пары в колбе отсутствуют
Колба заполнена тяжелыми белыми парами
Минерализат не темнеет в течение 30 минут без добавления серной кислоты
В биологическом материале соединения металлов находятся в связанном состоянии с:
Белками
Сахарами
Пептидами
Жирами
Аминокислотами
Катион бария можно доказать реакциями с:
Хлоридом натрия
Концентрированной серной кислотой
Нитратом серебра
Иодатом калия
Гидроксидом аммония
Катион свинца можно доказать реакциями с:
Дитизоном
Хлоридом натрия
Сероводородом
Малахитовым зеленым
Дихроматом калия
Катион свинца количественно можно определить методами:
Комплексонометрическим (обратное титрование)
Комплексонометрическим (прямое титрование)
Экстракционно-фотометрическим по дитизонату
Экстракционно-фотометрическим по диэтилдитиокарбаминату
Дихроматно-йодометрическим
В качестве денитраторов применяют:
Органические кислоты
Гетероциклические соединения
Альдегиды
Мочевина
Сульфит натрия
Бикарбонат натрия
Катион хрома можно доказать реакциями:
С дитизоном
С дифенилкарбазидом
С малахитовым зеленым
С пиридинродановым реактивом
С пероксидом водорода
Окраска минерализата может быть обусловлена присутствием катионов:
Меди
Свинца
Бария
Хрома
Марганца
В случае получения белого осадка в минерализате, последний фильтруют, полученный фильтрат обрабатывают:
Горячим раствором ацетата аммония
Персульфатом аммония
Раствором бикарбоната натрия
Раствором сульфата аммония
Раствором бихромата калия
В результате реакции формальдегида с азотистой кислотой образуются:
Вода и окислы азота
Диоксид углерода и окислы азота
Азот и диоксид углерода
Вода, диоксид углерода, окислы азота и азот
Вода, диоксид углерода и азот
На стадии деструкции вода необходима для:
Снижения процессов нитрования и сульфирования
Ускорения процессов нитрования и сульфирования
Ускорения процессов гидролиза
Снижения процессов комплексообразования
Наличие окислителя в минерализате и полноту денитрации определяют по реакции с:
Триптофаном
Фенилаланином
Дифениламином
Диэтиламином
Тирозином
Дробный метод анализа катионов назван именем:
Карандаева
Гуляевой
Герасимова
Крыловой
Фудживара
Количественное определение катионов марганца является:
Необязательным
Желательным
Обязательным
В основе количественного определения катиона хрома лежит реакция с:
Дитизоном
Диэтилдитиокарбаминатом натрия
Дифенилкарбазидом
Малахитовым зеленым
Пиридинродановым реактивом
Недостатком метода дробного анализа является:
Подготовка основной реакции
Не позволяет определить катионы, которые содержатся в организме в естественном состоянии
Добавление комплексонов
Изменение степени окисления металла
Не позволяет определить катионы, обуславливающие окраску минерализата
В основе количественного определения катиона свинца лежит реакция с:
Дитизоном
Диэтилдитиокарбаминатом натрия
Дифенилкарбазидом
Малахитовым зеленым
Пиридинродановым реактивом
Объектами исследования на неорганические соединения ртути в дробном методе анализа являются:
Мозг
Печень
Желудок
Почки
Кровь
Катион ртути количественно определяют методами:
Фотометрическим
Визуально-колориметрическим
Комплексонометрическим
Экстракционно-фотометрическим
Гравиметрическим
Катион ртути можно доказать реакциями с:
Диэтилдитиокарбаминатом натрия
Дитизоном
Сульфидом натрия
Йодидом меди (I)
Гексацианоферратом калия
Катион кадмия количественно определяют методами:
Гравиметрическим
Комплексонометрическим
Экстракционно-фотометрическим
Роданометрическим
Визуально-колориметрическим по сульфиду кадмия
Катион серебра можно доказать реакциями с:
Дихроматом калия
Хлоридом натрия
Сульфидом натрия
Дитизоном
Диэтилдитиокарбаминатом натрия
Катион цинка можно доказать реакциями с:
Дитизоном
Перйодатом калия
Сульфидом натрия
Концентрированной серной кислотой
Тетрароданомеркуратом аммония
Катион таллия количественно определяют экстракционно-фотометрически методом по реакциям с:
8-Оксихинолином
Малахитовым зеленым
Диэтилдитиокарбаминатом натрия
Дитизоном
Пиридинродановым реактивом
Катион кадмия можно доказать реакциями с:
Сульфидом натрия
Пиридинродановым реактивом
Раствором бруцина в серной кислоте и бромидом натрия
Дифенилкарбазидом
Гексацианоферратом калия
Катион сурьмы можно доказать реакциями с:
Тиомочевиной и пикратом калия
Малахитовым зеленым
Дитизоном
Пероксидом водорода
Тиосульфатом натрия
Катион сурьмы количественно определяют методами:
Гравиметрическим
Экстракционно-фотометрическим
Комплексонометрическим
Роданометрическим
Фотометрическим по цветной реакции
Катион меди можно доказать реакциями с:
Тетрароданомеркуратом аммония
Пиридинродановым реактивом
Ферроцианидом калия
Дитизоном
Сульфидом натрия
Катион висмута можно доказать реакциями с:
8-Оксихинолином
Перйодатом калия
Раствором бруцина в серной кислоте и бромидом калия
Ферроцианидом калия
Тиомочевиной
Катион свинца количественно можно определить методами:
Комплексонометрическим (обратное титрование)
Комплексонометрическим (прямое титрование)
Экстракционно-фотометрическим по дитизонату
Экстракционно-фотометрическим по диэтилдитиокарбаминату
Дихроматно-йодометрическим
С помощью подобного комплекса при рН >7 можно изолировать из минерализата катион:
|
Бария
Кадмия
Сурьмы
Цинка
Меди
|
При разбавлении минерализата водой выпадает осадок:
Сульфата серебра
Сульфата бария
Сульфата кадмия
Сульфата свинца
Сульфата висмута
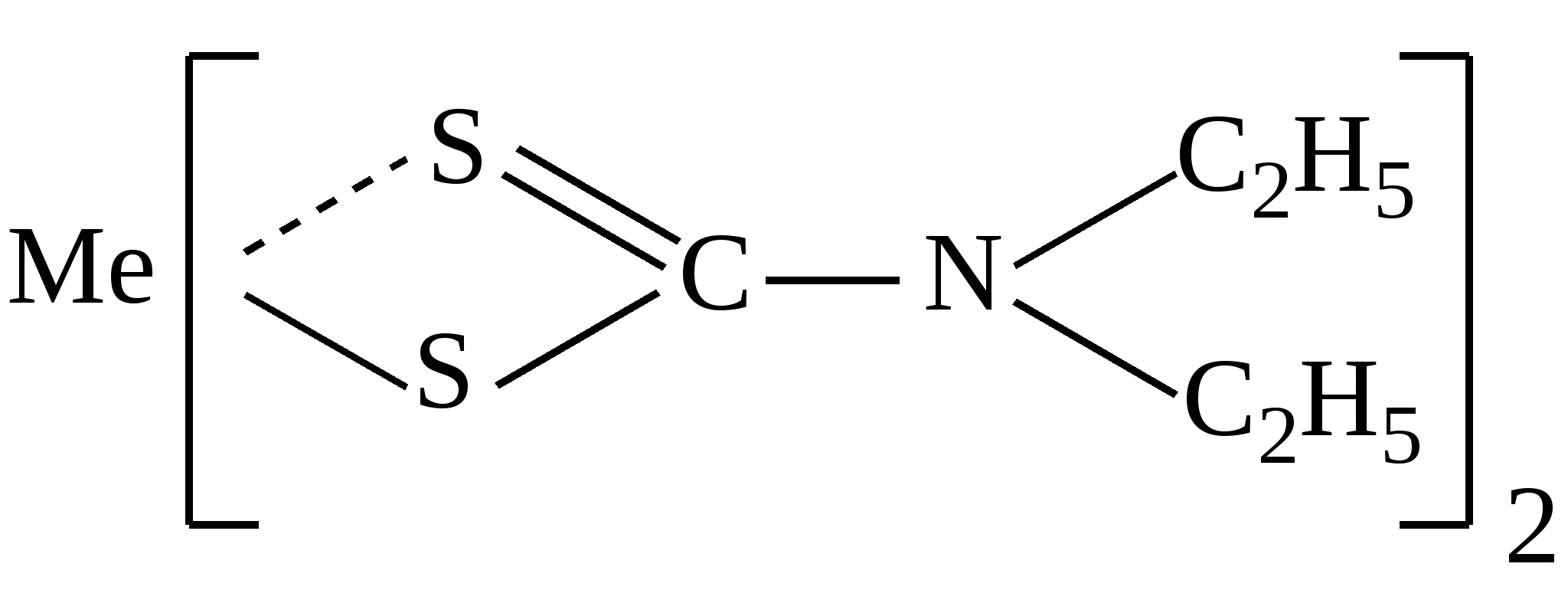
Приведенная формула может принадлежать:
|
рН=8-10
|
Комплексу хрома с дифенилкарбазидом
Дитизонату свинца
Диэтилдитиокарбаминату натрия
Дитизонату цинка
Диэтилдитиокарбаминату меди
|
В результате реакции образовался осадок белого цвета состава Me2[Fe(CN)6], указывающий на наличие в минерализате катиона:
Марганца
Цинка
Висмута
Кадмия
Бария
Мышьяк количественно можно определить методами:
Нитритометрическим
Визуально-колориметрическим
Комплексонометрическим
Аргентометрическим
Фотоколориметрическим по цветной реакции
Катион таллия можно доказать реакциями с:
Насыщенным раствором тиомочевины
Дитизоном
Перйодатом калия
Малахитовым зеленым
Диэтилдитиокарбаминатом натрия
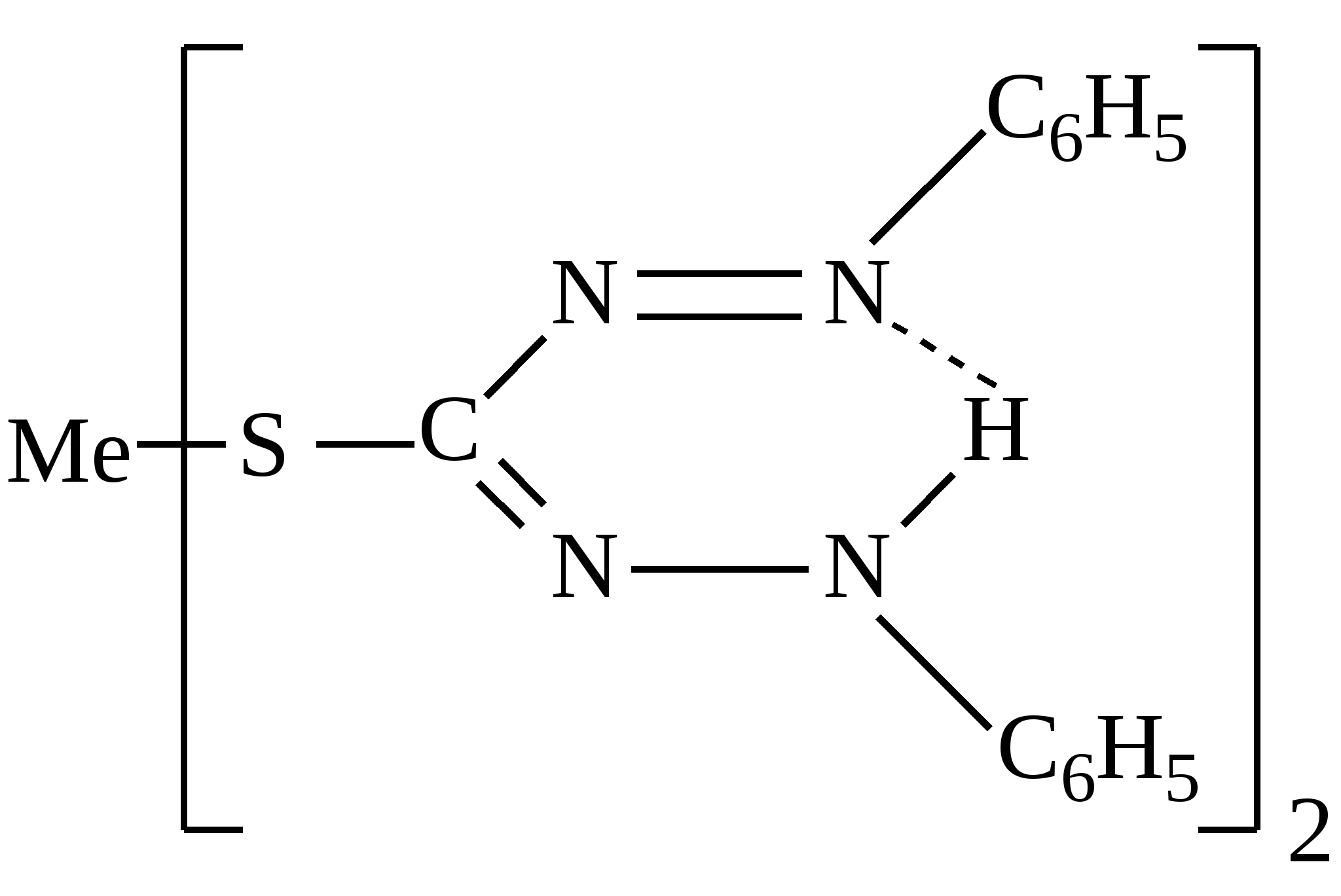
Приведенный комплекс может принадлежать катиону:
|
Меди с пиридинродановым реактивом
Таллия с малахитовым зеленым
Хрома с дифенилкарбазидом
Сурьмы с малахитовым зеленым
Цинка с дитизоном
|
Доказательство ртути в деструктате основано на реакции:
Зангер-Блека
Несслера
Полежаева
Марша
Гутцайта
В результате следующих химических превращений образовался характерный кристаллический осадок, указывающий на наличие в минерализате катиона:

Свинца
Цинка
Кадмия
Бария
Висмута
В результате реакции образовался осадок сиреневого цвета состава MeCd[Fe(CN)6], что свидетельствует о наличии в минерализате катиона:
Свинца
Хрома.
Меди
Висмута
Таллия
Изолирование ртути из биологического материала проводится методом:
Простого сжигания
Сплавления с карбонатом и нитратом натрия
Деструкции
Минерализацией смесью серной и азотной кислот
Минерализацией смесью серной, азотной и хлорной кислот
В результате реакции образовался кирпично-красный осадок состава Сu2[Меl4],что свидетельствует о наличии в растворе катиона:
Сурьмы
Свинца
Ртути
Серебра
Мышьяка
Приведенный комплекс образуется при доказательстве катиона:
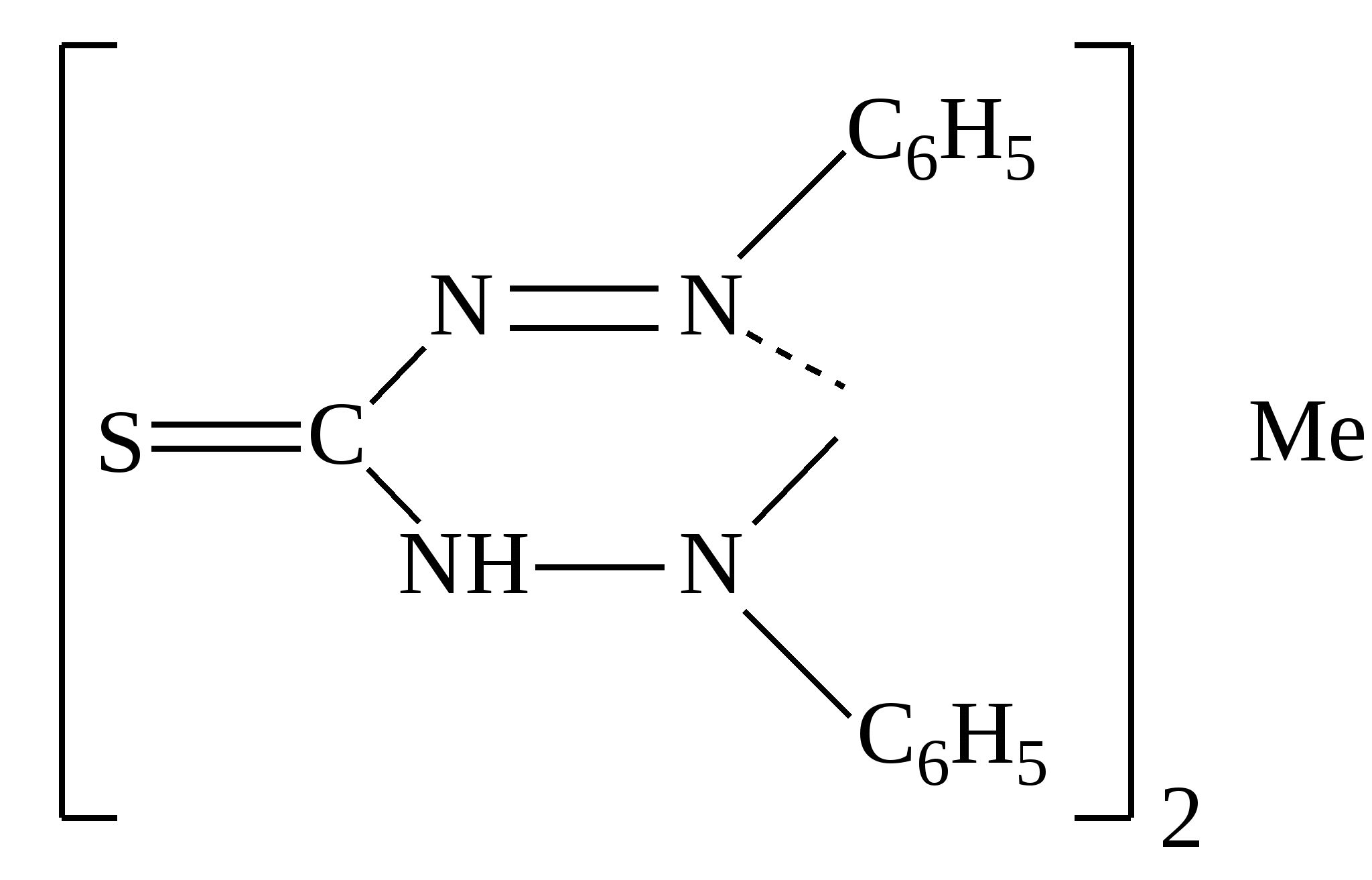
|
рН=1
|
Серебра
Ртути
Свинца
Цинка
Таллия
|
Приведенный комплекс образуется при доказательстве катиона:
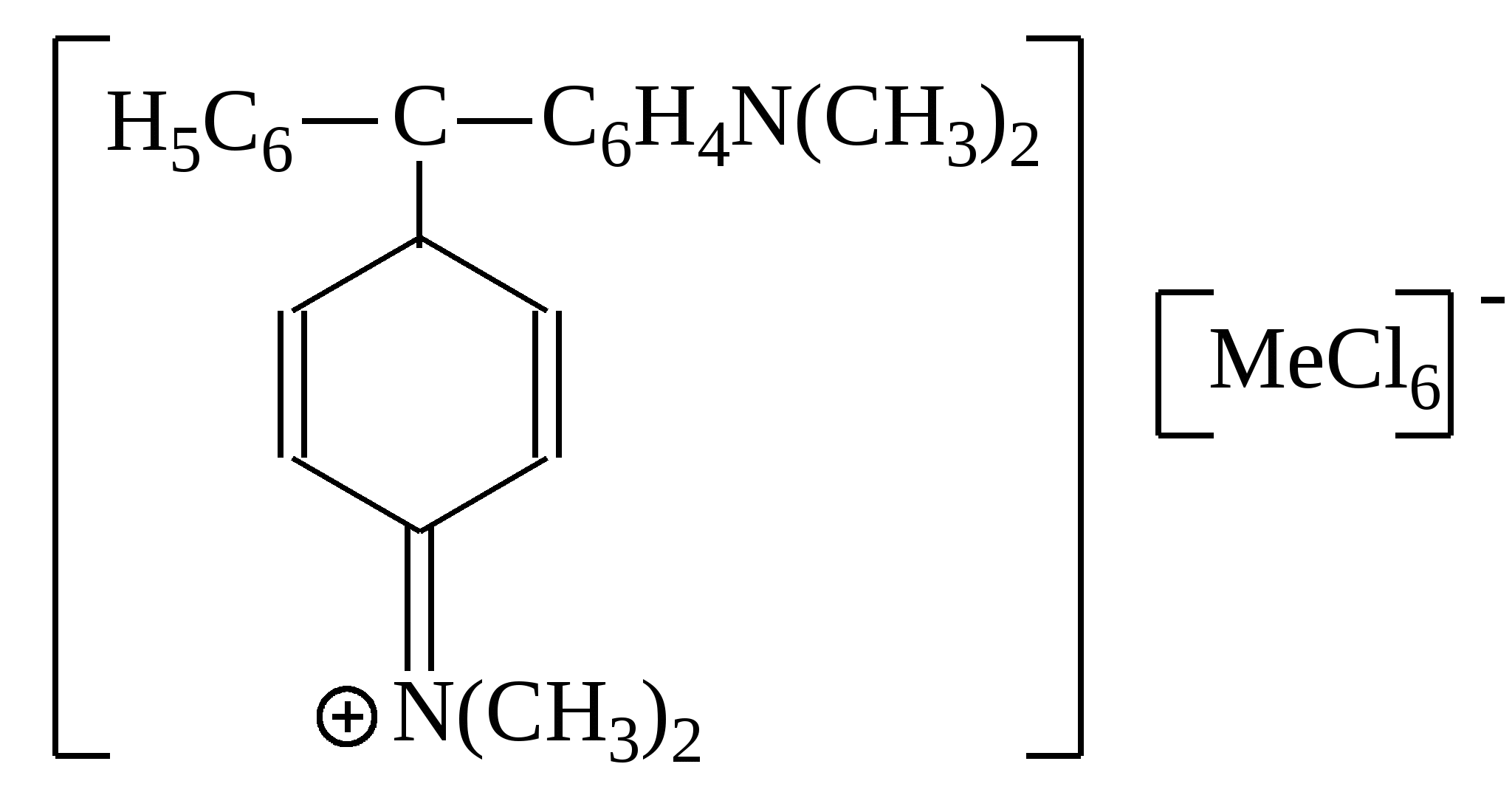
|
Висмута
Сурьмы
Хрома
Цинка
Кадмия
|
В результате реакции образовались кристаллы характерной формы состава K2CuMe(NO2)6, указывающие на наличие в минерализате катиона:
Бария
Цинка
Мышьяка
Свинца
Висмута
Катион висмута количественно определяют фотоколориметрическим методом по реакции с:
Тиомочевиной
8-Оксихинолином
Бруцином
Пиридинродановым реактивом
Дифенилкарбазидом
Приведенный комплекс образуется при доказательстве катиона:
|
Свинца
Меди
Висмута
Мышьяка
Серебра
|
В результате реакции образовался осадок лилово-розового цвета состава MeZn[Hg(SCN)4]2, что свидетельствует о наличии в минерализате катиона:
Меди
Бария
Свинца
Сурьмы
Кадмия
Мышьяк в минерализате можно предварительно обнаружить по реакции:
Гутцайта
Зангер-Блека
Полежаевой
Марша
Пеллагри
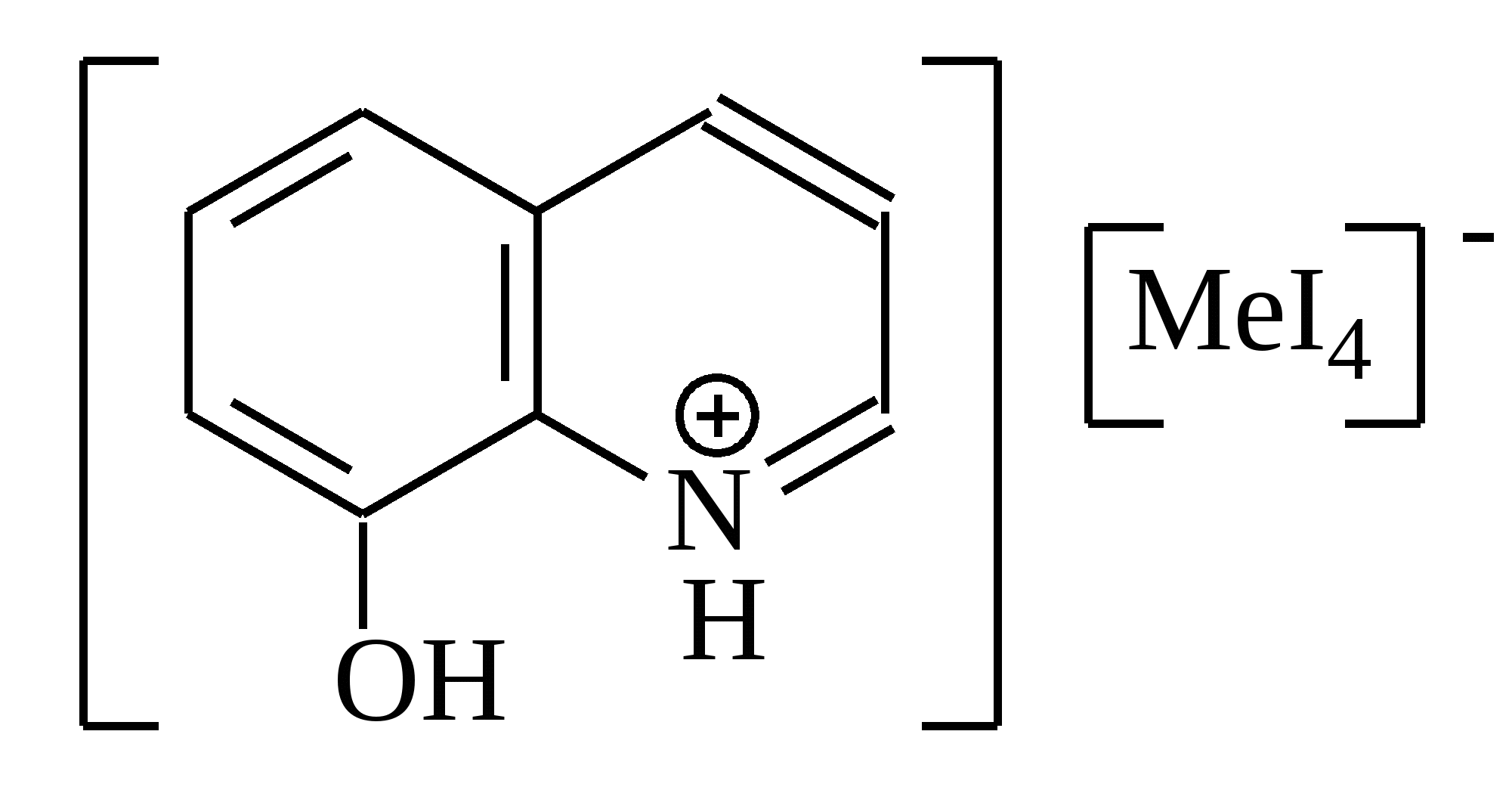
Приведенное соединение образуется при доказательстве катиона:
|
Свинца
Хрома
Мышьяка
Цинка
Меди
|
В результате реакции образовались кристаллы характерной формы состава Me[Hg(SCN)4], указывающие на наличие в минерализате катиона:
Цинка
Марганца
Кадмия
Меди
Таллия
Приведенное соединение образуется при доказательстве в минерализате катиона:
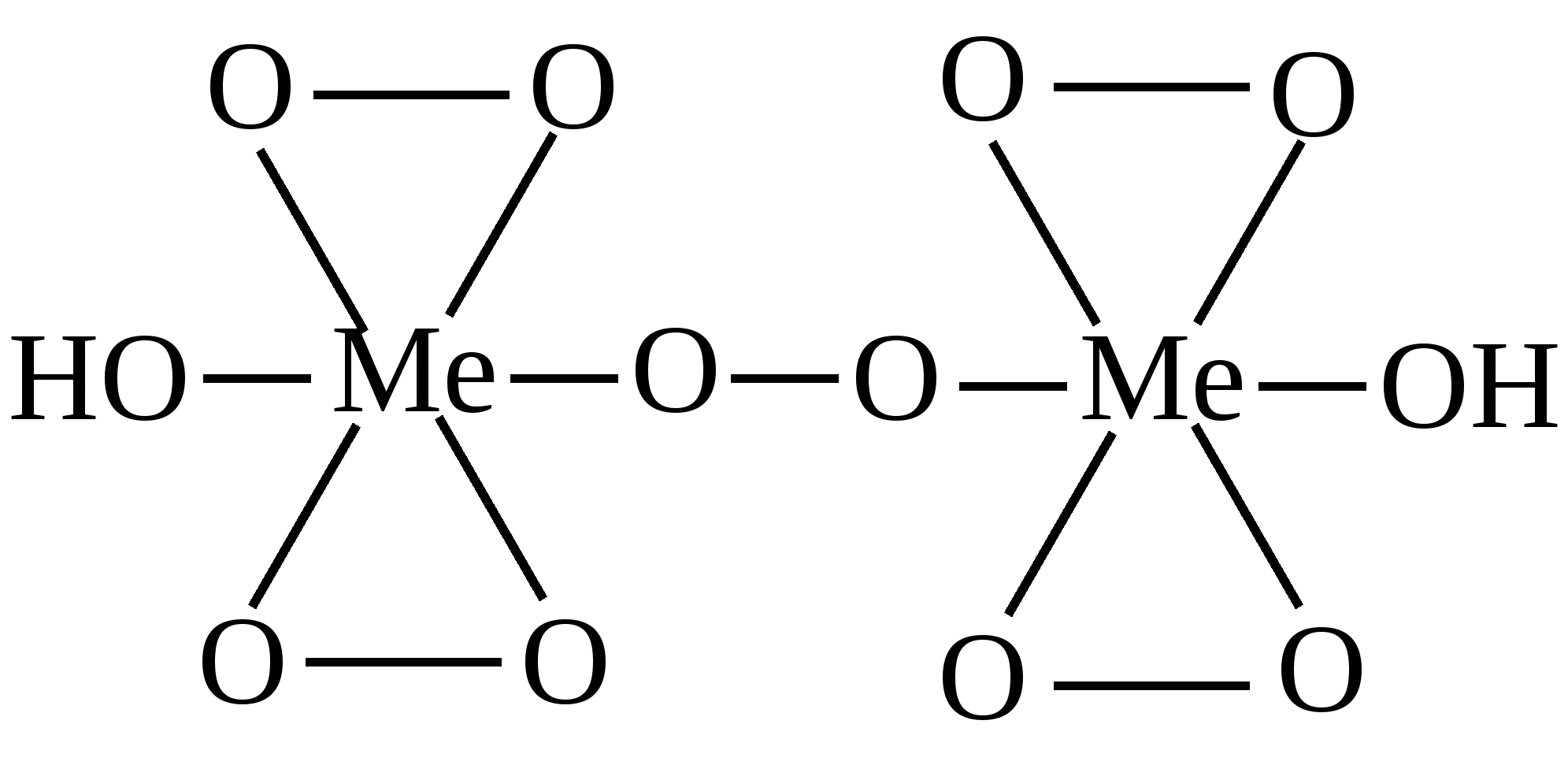
|
Мышьяка
Марганца
Хрома
Сурьма
Цинка
|
При образовании комплекса состава [Me(S=C(NH2)2)n](NO3)3 появилось желтое окрашивание, что свидетельствует о наличии в минерализате катиона:
Меди
Свинца
Висмута
Таллия
Серебра
Приведенная формула может принадлежать:
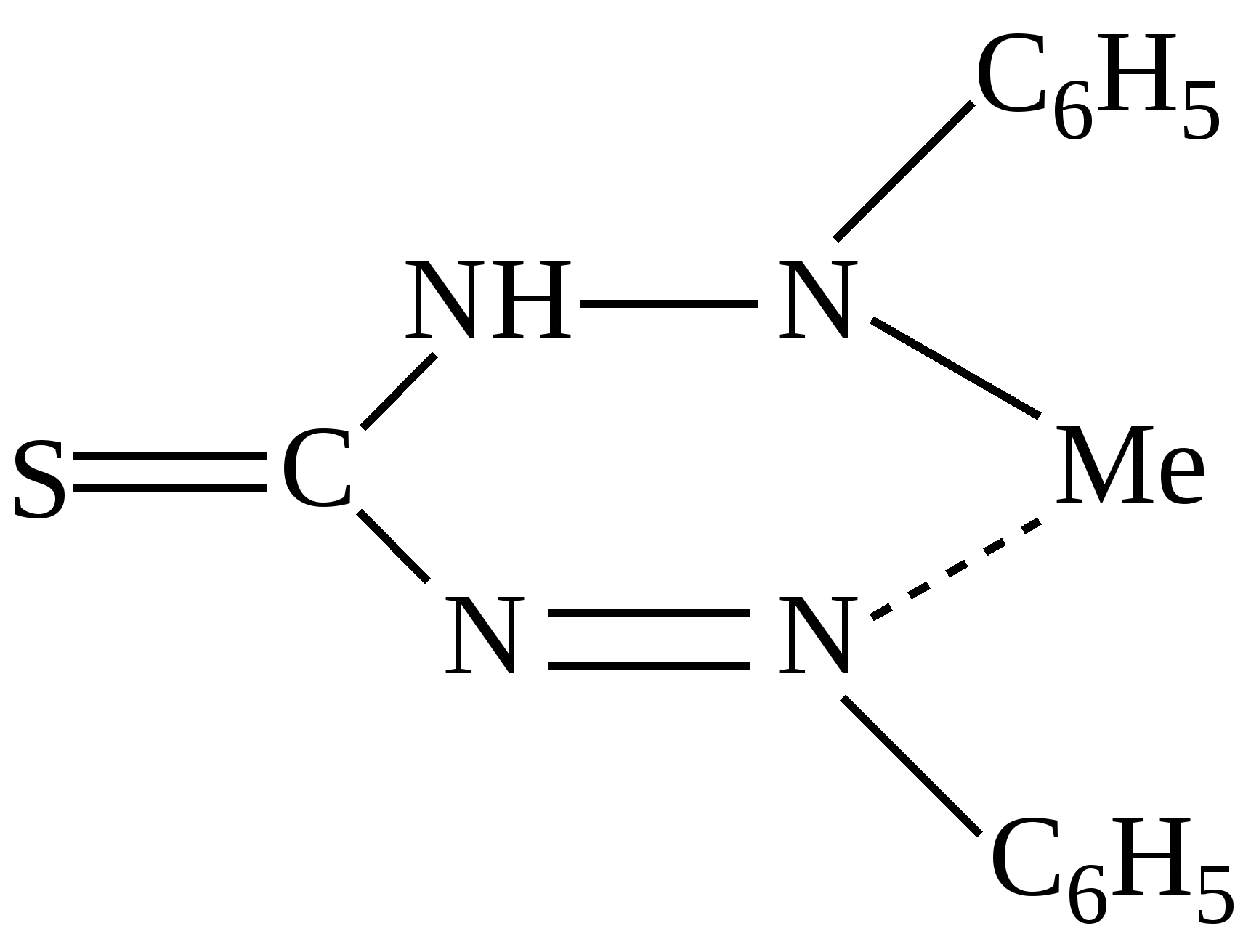
|
рН=1
|
Дитизонату серебра
Дитизонату цинка
Диэтилдитиокарбаминату меди
Дитизонату таллия
Диэтилдитиокарбаминату кадмия
|
В результате реакции образовались кристаллы характерной формы состава Cs[MeI3], указывающие на наличие в минерализате катиона:
Меди
Мышьяка
Свинца
Висмута
Цинка
Катион меди количественно определяют экстракционно-фотометрическим методом по реакции с:
Диэтилдитиокарбаминатом натрия
Диэтилдитиокарбаминатом свинца
Дитизоном
Малахитовым зеленым
8-Оксихинолином
Приведенная формула может принадлежать:
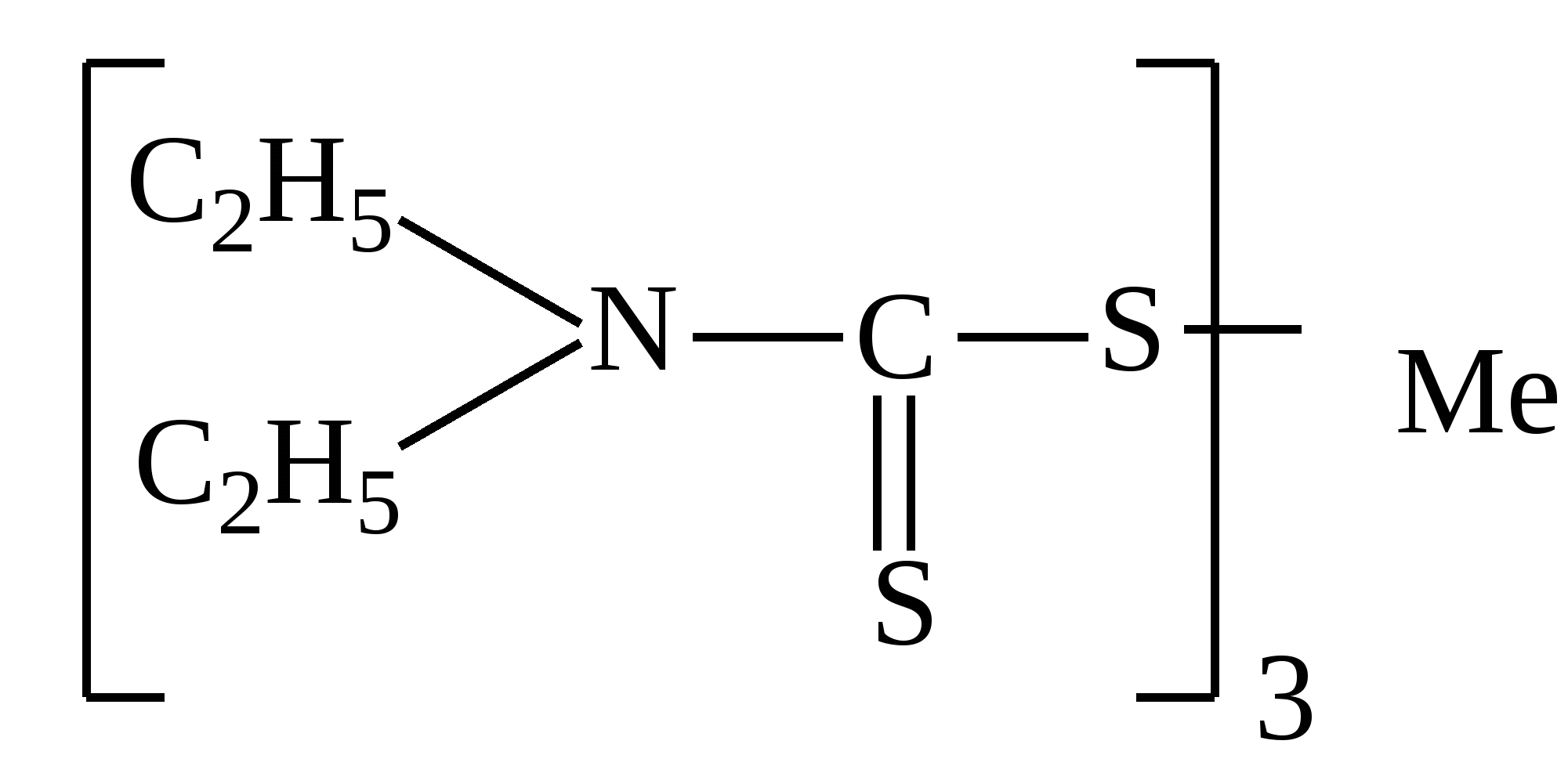
|
рН=14
|
Диэтилдитиокарбаминату меди
Дитизонату цинка
Диэтилдитиокарбаминату хрома
Диэтилдитиокарбаминату висмута
Комплексу меди с пиридинродановым реактивом
|
В результате реакции образовался осадок оранжевого цвета состава Me2S3, указывающий на наличие в минерализате катиона:
Марганца
Бария
Сурьмы
Цинка
Висмута
Катион цинка количественно определяют экстракционно-фотометрическим методом по реакции с:
Дитизоном
Малахитовым зеленым
Диэтилдитиокарбаминатом свинца
8-Оксихинолином
Пиридинродановым реактивом
Приведенная формула может принадлежать:
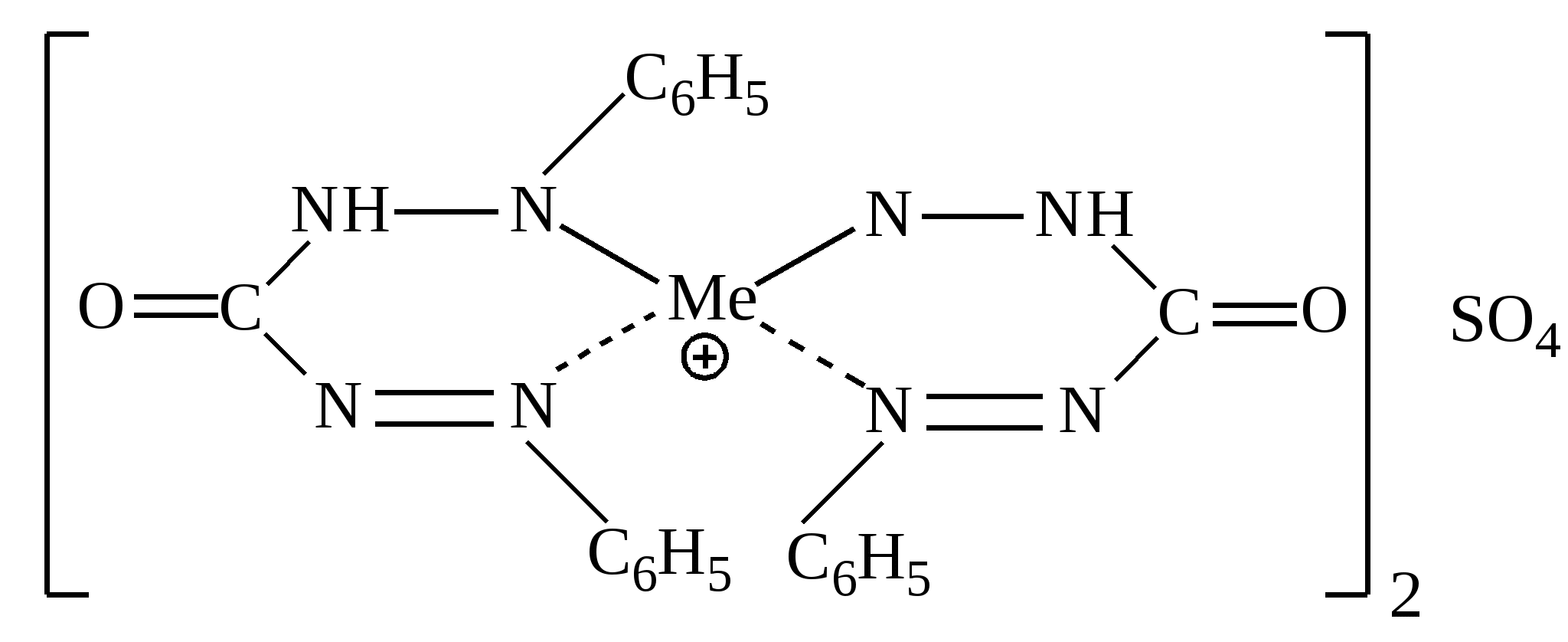
|
Дитизонату цинка
Комплексу хрома с дифенилкарбазидом
Дитизонату свинца
Диэтилдитиокарбаминату цинка
Комплексу таллия с малахитовым зеленым
|
На индикаторной бумаге, пропитанной бромидом ртути, появилось светло-коричневое пятно за счет образования продукта реакции состава Me2Hg3, что свидетельствует о наличии в минерализате катиона:
Свинца
Висмута
Меди
Кадмия
Мышьяка
К металлам, которые содержатся в организме человека и млекопитающих в естественном состоянии, относятся:
Сурьма
Медь
Кадмий
Таллий
Серебро
Катион хрома количественно определяют фотоэлектроколориметрическим методом по реакции с:
Дитизоном
Диэтилдитиокарбаминатом натрия
Дифенилкарбазидом
Малахитовым зеленым
Пиридинродановым реактивом
В дробном методе обнаружения мышьяка отрицательное химико-токсикологическое значение имеет реакция:
Реакция Зангер—Блека
Реакция Мараша
Реакция Полежаева–Рубцова
Реакция окисления
Реакция с CsCl и HCl
В дробном методе исследования ионы Hg2+ количественно определяют:
Комплексонометрическим методом
Экстракционно-фотометрическим методом по цветной реакции
Эмиссионный спектральный анализ
Колориметрическим методом Полежаева
Фотометрическим методом по тетрайод-2-меркуриату меди
Указанием для исследования на наличие мышьяка и меди является ________ окраска объектов исследования:
Грязно-желтая
Коричневая
Изумрудно-зеленая
Ярко-красная
Серо-черная
При целенаправленном исследовании на мышьяк выбирают следующий метод изолирования:
Сухое озоление сплавлением с Na2CO3 и NaNO3
Мокрое озоление
Деструктивный метод
Простое сжигание
Минерализация кHNO3 и кH2SO4
На какой стадии мокрого озоления наблюдаются наибольшие потери ртути:
На стадии денитрации
Во время фильтрования
На стадии деструкции
На стадии глубокого жидкофазного окисления
При измельчении объекта исследования
При исследовании мочи на ионы Hg2+ добавляют:
SnCl2 + HCl
CsCl + HCl
FeCl3 + HCl
CuSO4 + KI
Катион меди количественно определяют методом:
Комплексонометрическим
Гравиметрическим
Косвенная йодометрия
Фотометрическим методом по реакции с пиридинродановым реактивом
Фотоэлектрометрическим по реакции с (ДДТК)2Pb
УСТАНОВИТЕ СООТВЕТСТВИЕ (1-б 2-в)
Реактив
|
Обнаруживаемый катион
|
Пиросульфат аммония
8-оксихинолин
|
Катион ртути
Катион марганца
Катион висмута
|
УСТАНОВИТЕ СООТВЕТСТВИЕ (1-в, 2-г, 3-ж)
Химическое соединение
|
Название
|
As2Hg3
H3AsO3
As2O5
|
Арсин
Мышьяковистый ангидрид
Амальгама мышьяка
Ортомышьяковистая кислота
Метамышьяковистая кислота
Мышьяковая кислота
Мышьяковый ангидрид
|
УСТАНОВИТЕ СООТВЕТСТВИЕ (1-а, 2-е, 3-д, 4-б)
Химическое соединение
|
Название
|
AsH3
H3AsO4
HAsO2
As2O3
|
Арсин
Мышьяковистый ангидрид
Амальгама мышьяка
Ортомышьяковистая кислота
Метамышьяковистая кислота
Мышьяковая кислота
Мышьяковый ангидрид
|
УСТАНОВИТЕ СООТВЕТСТВИЕ (1-а,г,д 2-б,в 3-е)
Метод минерализации
|
Особенности метода
|
Сплавление с Na2CO3 и NaNO3
Минерализация простым сжиганием
Минерализация кHNO3 и кH2SO4
|
При исключении исследования на соединения ртути
При исследовании на наличие солей меди, марганца и др.
Обработка золы минеральными кислотами
При малых количествах объектов исследования
При специальных исследованиях на наличие As, Ag и др.
Использование окислительных свойств минеральных кислот
|
УСТАНОВИТЕ СООТВЕТСТВИЕ (1-д, 2-в, 3-а, 4-б)
Катион, определяемый реакцией с дитизоном
|
Условия реакции
|
Катион талия
Катион цинка
Катион ртути
Катион серебра
|
рН 1–2
рН 1–2 (при добавлении HCl комплекс разрушается)
рН 4–5
рН 7–10
рН 12
|
УСТАНОВИТЕ СООТВЕТСТВИЕ (1-в, 2-а)
Реакция обнаружения
|
Эффект реакции
|
Образование надхромовых кислот
Образование сульфата свинца
|
Белый осадок
Черный осадок
Голубое окрашивание
Зеленое окрашивание
|
УСТАНОВИТЕ СООТВЕТСТВИЕ (1-а, 2-б)
Реакция обнаружения
|
Эффект реакции
|
Окисление Mn2+ в MnO4–
Образование бихромата свинца
|
Фиолетовое окрашивание
Желтый осадок
Зеленое окрашивание
Белый осадок
Малиновое окрашивание
|
ОТКРЫТАЯ ФОРМА ТЕСТА
Дайте определение процессу минерализации.
Перечислите достоинства дробного метода анализа катионов.
Перечислите основные способы устранения мешающих катионов (не менее пяти).
Объясните, для чего промывают осадок ацетатом аммония при исследовании минерализата дробным методом анализ.
Какие реакции положены в основу метода Марша? Запишите химизм.
Перечислите достоинства и недостатки метода обнаружения мышьяка по способу Марша.
Приведите формулы реактивов-реагентов: дифенилкарбазида, продукта окисления его кислородом воздуха, дифенилтиокарбазона.
Назовите основные формы отравления мышьяком и их признаки.
Опишите этапы изолирования ртути деструктивным методом.
Какие реакции положены в основу метода, позволяющего сочетать качественное и количественное определение Hg2+? Напишите химизм.
|
 Скачать 0.68 Mb.
Скачать 0.68 Mb.