Клиническая Микробиология. Вопросы к занятию
 Скачать 0.68 Mb. Скачать 0.68 Mb.
|
|
ВОПРОСЫ К ЗАНЯТИЮ 1. Физико-химические свойства и химический состав крови. Кровь - жидкая ареолярная соединительная ткань, состоящая из клеток (эритроцитов, лейкоцитов, тромбоцитов, нейтрофилов, базофилов, моноцитов, эозинофилов) и внеклеточной жидкости. 45% приходится на форменные элементы (из них 44% приходится на долю эритроцитов), 55% составляет плазма, в плазме 83% приходится на долю воды и 17% - на сухой остаток. Свойства: Кровь красного цвета, вязкость в 5-6 раз больше вязкости воды за счет наличия белков и форменных элементов крови, относительная плотность 1,050 г/см3 - 1,060 г/см3, pH крови = 7,36 -7,42 - слабо щелочная, общий объем составляет 7% от массы тела 5-6 литров. Кровь - раствор, в ней много органических и минеральных веществ, общая концентрация их 300 ммоль/л, осмотическое давление 7,7-8,1ат, осмомолярность 285- 310 миллиосмоль/л, онкотическое давление - 0,2ат. Химический состав крови: I. Минеральные: Na+, K+, Cl-, Ca++, Mg++ и др. II. Органические: 1. Азотсодержащие (белки, небелковые азотсодержащие вещества); 2. Безазотистые вещества (углеводы,липиды, метаболиты) ОРГАНИЧЕСКИЕ НЕБЕЛКОВЫЕ СОЕДИНЕНИЯ ПЛАЗМЫ Делятся на две группы: I группа - азотсодержащие небелковые компоненты В состав небелкового азота крови входит азот промежуточных и конечных продуктов обмена простых и сложных белков. Раньше небелковый азот называли "остаточный азот" (остается после осаждения белков): азот мочевины (50%) азот аминокислот (25%) низкомолекулярные пептиды креатин креатинин билирубин индикан некоторые другие азотсодержащие вещества При некоторых заболеваниях почек, а также при патологии, сопровождающейся массивным разрушением белков (например, тяжелые ожоги), может повышаться небелковый азот крови, т.е наблюдается азотемия. Однако наиболее часто нарушается не общее содержание небелкового азота в крови, а соотношение между отдельными компонентами небелкового азота. Поэтому сейчас в плазме определяют азот отдельных компонентов. В понятие "остаточный азот" включают и низкомолекулярные пептиды. Среди низкомолекулярных пептидов есть много пептидов, обладающих высокой биологической активностью (например, гормоны пептидной природы). Подробнее о них - см. лекцию по теме “Протеолиз”. II группа - безазотистые органические вещества 1) Углеводы, липиды и продукты их метаболизма (глюкоза, ПВК, лактат, кетоновые тела, жирные кислоты, холестерин и его эфиры и др.). 2) Минеральные вещества крови (смотрите учебник Коровкина стр.449-452 и учебник Николаева стр.360, а также лекции по теме “Биохимия питания” – раздел ”Водно-минеральный обмен” 2. Основные биохимические функции крови: транспортная, осморегулирующая, буферная, детоксикационная, защитная, регуляторная, гемостатическая и др. Питание тканей и выделение продуктов метаболизма. интегративная (объединительная) дыхательная (газообмен) 3питательная выделительная буферная (рH) регуляция водного баланса регуляция теплового баланса защитная гемостатическая - свертынающая и антисвертывающая системы регуляторная - синтез серотонина и др. транспортная 3. Белки плазмы крови: общий белок, белковые фракции, белковый коэффициент. Разделение белков плазмы крови на фракции методом электрофореза на бумаге, в полиакриламидном геле, высаливанием. Общий белок крови – это совокупность всех белковых фракций крови. Равен 65-85 г/л. Отношение масс альбуминов и глобулинов в плазме и сыворотке крови названо белковым коэффициентом. Для здоровых людей альбумин-глобулиновый коэффициент сыворотки крови составляет 1,5—2,3. Электрофорез белков – это метод разделения белковых молекул в исследуемом образце. Его принцип заключается в том, что молекулы с разной массой, зарядом и формой в электрическом поле движутся с различной скоростью и отображаются в результате как полосы разной ширины и с местоположением, специфичным для каждой фракции. Самая интенсивная полоса соответствует альбумину, на долю которого приходится около 70% общего белка крови. Принцип разделения белков сыворотки крови на фракции состоит в том, что в электрическом поле белки сыворотки крови движутся по смоченной буферным раствором хроматографической бумаге (ацетатцеллюлозной пленке, крахмаловому, агаровом гелям) со скоростью, зависящей в основном от величины электрического заряда и молекулярной массы частиц. Сыворотку крови наносят на бумажную полоску, смоченную буфером. Концы бумажной полосы опущены в раствор электролита, где находятся электроды источника постоянного тока. При замыкании электрической цепи белковые молекулы движутся со скоростью. Пропорциональной величине заряда. За единицу времени проходят разные расстояния, т.е. оказываются на разных участках бумажной полосы. Высаливание. Разделение белков проводят с использованием солей щелочных и щелочноземельных металлов. Наиболее часто используют сульфат аммония. Различные белки высаливаются из растворов при разных концентрациях растворов сульфата аммония: альбумины выпадают при 100% насыщении, глобулины при 50%. При действии сульфата аммония, ацетона, спирта белки теряют гидратную оболочку, утрачивают устойчивость и выпадают в осадок. В результате высаливания получают 2 фракции: Альбумины – 40 – 50 г/л Глобулины – 20 – 30 г/л Электрофорез на бумаге позволяет разделить белки плазмы крови на 6 фракций: Альбумины - 54-62% Глобулины: 1-глобулины 2,5-5% 2-глобулины 8,5-10% -глобулины 12-15% -глобулины 15,5-21% Фибриноген (остается на старте) - от 2 до 4%. АЛЬБУМИНЫ Альбумины – простые низкомолекулярные гидрофильные белки. В молекуле альбумина содержится 600 аминокислот. Молекулярная масса 67 кДа. Альбумины, как и большинство других белков плазмы крови, синтезируются в печени. Примерно 40% альбуминов находится в плазме крови, остальное количество - в интерстициальной жидкости и в лимфе. ФУНКЦИИ АЛЬБУМИНОВ Определяются их высокой гидрофильностью и высокой концентрацией в плазме крови. 1. Поддержание онкотического давления плазмы крови. Поэтому при уменьшении содержания альбуминов в плазме падает онкотическое давление, и жидкость выходит из кровяного русла в ткани. Развиваются "голодные" отеки. Альбумины обеспечивают около 80% онкотического давления плазмы. Именно альбумины легко теряются с мочой при заболеваниях почек. Поэтому они играют большую роль в падении онкотического давления при таких заболеваниях, что приводит к развитию «почечных» отеков. 2. Альбумины – это резерв свободных аминокислот в организме, образующихся в результате протеолитического расщепления этих белков. 3. Транспортная функция. Альбумины транспортируют в крови многие вещества, особенно такие, которые плохо растворимы в воде: свободные жирные кислоты, жирорастворимые витамины, стероиды, некоторые ионы (Ca2+, Mg2+). Для связывания кальция в молекуле альбумина имеются специальные кальцийсвязывающие центры. В комплексе с альбуминами транспортируются многие лекарственные препараты, например, ацетилсалициловая кислота, пенициллин. ГЛОБУЛИНЫ В отличие от альбуминов глобулины не растворимы в воде, а растворимы в слабых солевых растворах. 1-ГЛОБУЛИНЫ В эту фракцию входят разнообразные белки. 1-глобулины имеют высокую гидрофильность и низкую молекулярную массу - поэтому при патологии почек легко теряются с мочой. Однако их потеря не оказывает существенного влияния на онкотическое давление крови, потому что их содержание в плазме крови невелико. Функции 1-глобулинов: 1. Транспортная. Транспортируют липиды, при этом образуют с ними комплексы - липопротеины. Среди белков этой фракции есть специальный белок, предназначенный для транспорта гормона щитовидной железы тироксина - тироксинсвязывающий белок. 2. Участие в функционировании системы свертывания крови и системы комплемента - в составе этой фракции находятся также некоторые факторы свертывания крови и компоненты системы комплемента. 3. Регуляторная функция. Некоторые белки фракции 1-глобулинов яляются эндогенными ингибиторами протеолитических ферментов. Наиболее высока в плазме концентрация 1-антитрипсина. Содержание его в плазме от 2 до 4 г/л (очень высокое), молекулярная масса - 58-59 кДа. Главная его функция - угнетение эластазы - фермента, гидролизующего эластин (один из основных белков соединительной ткани). 1-антитрипсин также является ингибитором протеаз: тромбина, плазмина, трипсина, химотрипсина и некоторых ферментов системы свертывания крови. Количество этого белка увеличивается при воспалительных заболеваниях, при процессах клеточного распада, уменьшается при тяжелых заболеваниях печени. Это уменьшение - результат нарушения синтеза 1-антитрипсина, и связано оно с избыточным расщеплением эластина. Существует врожденная недостаточность 1-антитрипсина. Считают, что недостаток этого белка способствует переходу острых заболеваний в хронические. К фракции 1-глобулинов относят также 1-антихимотрипсин. Он угнетает химотрипсин и некоторые протеиназы форменных элементов крови. 2-ГЛОБУЛИНЫ. Высокомолекулярные белки. Эта фракция содержит регуляторные белки, факторы свертывания крови, компоненты системы компемента, транспортные белки. Сюда относится и церулоплазмин. Этот белок имеет 8 участков связывания меди. Он является переносчиком меди, а также обеспечивает постоянство содержания меди в различных тканях, особенно в печени. При наследственном заболевании - болезни Вильсона - уровень церулоплазмина понижается. Вследствие этого повышается концентрация меди в мозге и печени. Это проявляется развитием неврологической симптоматики, а также циррозом печени. -ГЛОБУЛИНЫ К этой фракции относятся некоторые белки системы свертывания крови и подавляющее большинство компонентов системы активации комплемента (от С2 до С7). Основу фракции -глобулинов составляют Липопротеины Низкой Плотности (ЛПНП) ( гамма-ГЛОБУЛИНЫ В этой фракции содержатся в основном АНТИТЕЛА - белки, синтезируемые в лимфоидной ткани и в клетках РЭС, а также некоторые компоненты системы комплемента. Функция антител - защита организма от чужеродных агентов (бактерии, вирусы, чужеродные белки), которые называются АНТИГЕНАМИ. Главные классы антител в крови: - иммуноглобулины G (IgG) - иммуноглобулины M (IgM) - иммуноглобулины A (IgA), к которым относятся IgD и IgE. Только IgG и IgM способны активировать систему комплемента. С-реактивный белок также способен связывать и активировать С1-компонент комплемента, но эта активация непродуктивна и приводит к накоплению анафилотоксинов. Накопившиеся анафилотоксины вызывают аллергические реакции. К группе гамма-глобулинов относится также криоглобулины. Это белки, которые способны выпадать в осадок при охлаждении сыворотки. У здоровых людей их в сыворотке нет. Они появляются у больных с ревматическим артритом, миеломной болезнью. Среди криоглобулинов существует белок фибронектин. Это высокомолекулярный гликопротеин (молекулярная масса 220 кДа). Он присутствует в плазме крови и на поверхности многих клеток (макрофагов, эндотелиальных клеток, тромбоцитов, фибробластов). Функции фибронектина: Обеспечивает взаимодействие клеток друг с другом; Способствует адгезии тромбоцитов; Предотвращает метастазирование опухолей. Плазменный фибронектин является опсонином - усиливает фагоцитоз. Играет важную роль в очищении крови от продуктов распада белков, например, распада коллагена. Вступая в связь с гепарином, участвует в регуляции процессов свертывания крови. В настоящее время этот белок широко изучается и используется для диагностики особенно при состояниях, сопровождающихся угнетением системы макрофагов (сепсис и др.) ФИБРИНОГЕН Это белок, на который направлено действие системы свертывания крови. При свертывании крови фибриноген превращается в фибрин, который нерастворим в воде и выпадает в виде нитей. В этих нитях запутываются форменные элементы крови и, таким образом, формируется кровяной сгусток (тромб). 4. Белки крови: трансферрин, церулоплазмин, гаптоглобин, иммуноглобулины, гликопротеиды, липопротеины. Трансферрин (Transferrin) – главный белок-переносчик железа в плазме крови. Он образуется в печени из аминокислот, которые всасываются из пищи в процессе переваривания. Трансферрин связывается с железом, которое поступает с едой или при разрушении эритроцитов, и переносит его к органам и тканям (к печени, селезенке). Трансферрин способен присоединить больше железа, чем весит сам. Как правило, железом заполнена 1/3 связывающих центров трансферрина, остальные 2/3 остаются в резерве. Степень «заполненности» трансферрина железом отражают такие показатели, как общая железосвязывающая способность сыворотки, латентная железосвязывающая способность сыворотки и процент насыщения трансферрина. При дефиците железа уровень трансферрина повышается, чтобы он смог связаться даже с небольшим количеством железа в сыворотке. Количество трансферрина в крови зависит к тому же от состояния печени, питания человека и работы кишечника. Если функция печени нарушается из-за значительного разрастания в ней рубцовой ткани (цирроза), то уровень трансферрина падает. При недостатке белковой пищи в рационе или нарушении всасывания аминокислот из-за воспаления в кишечнике трансферрин также не образуется в достаточных количествах. В норме процент насыщения трансферрина железом составляет около 30%. Снижение процента насыщения трансферрина железом (следствие снижения концентрации железа и роста концентрации трансферрина) указывает на анемию, обусловленную недостатком поступления железа. При значительном увеличении % насыщения трансферрина железом в плазме появляется низкомолекулярное железо, которое может откладываться в печени и поджелудочной железе, вызывая их повреждение. Содержание трансферрина у женщин на 10% выше, чем у мужчин. В третьем семестре беременности концентрация трансферрина в сыворотке может повыситься на 50 5. Концентрация этого белка снижается у пожилых людей. При воспалении трансферрин проявляется как негативный белок острой фазы ( его концентрация при острофазном ответе на воспаление уменьшается). Церулоплазмин Медьсодержащий гликопротеин a2 – глобулин Участвует в обмене железа, окисляя железо 2-х валентное до 3-х валентного Прооксидантные свойства: активирует окисление аскорбиновой кислоты, катехоламинов, серотонина Антиоксидантные свойства: инактивация свободных радикалов кислорода, миелопероксидазы Этот белок имеет 8 участков связывания меди. Он является переносчиком меди, а также обеспечивает постоянство содержания меди в различных тканях, особенно в печени. При наследственном заболевании – болезни Вильсона – уровень церулоплазмина понижается. Вследствие этого повышается концентрация меди в мозге и печени. Это проявляется развитием неврологической симптоматики, а также циррозом печени. Гаптоглобины. 2-глобулин. образует специфические комплексы с гемоглобином, освобождающимся из эритроцитов при внутрисосудистом гемолизе. Вследствие высокой молекулярной массы этих комплексов они не могут выводиться почками. Это предотвращает потерю железа организмом. Комплексы гемоглобина с гаптоглобином разрушаются клетками ретикуло-эндотелиальной системы (клетки системы мононуклеарных фагоцитов), после чего глобин расщепляется до аминокислот, гем разрушается до билирубина и экскретируется желчью, а железо остается в организме, и может быть реутилизировано. Строение молекулы иммуноглобулина. Молекулы всех классов иммуноглобулинов имеют сходное строение. Разберем их строение на примере молекулы IgG. Это сложные белки, которые являются гликопротеинами и обладают четвертичной структурой. Схема строения молекулы иммуноглобулина представлена на рисунке: 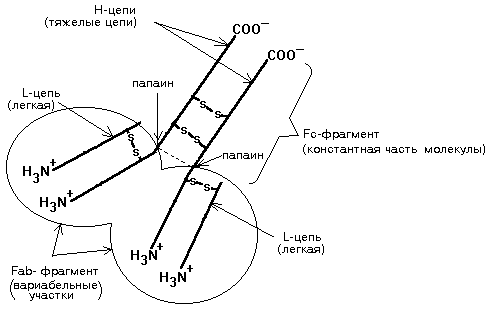 В состав белковой части иммуноглобулина входят всего 4 полипептидные цепи: 2 одинаковые легкие и 2 одинаковые тяжелые цепи. Молекулярная масса легкой цепи составляет 23 кДа, а тяжелой - от 53 до 75 кДа. С помощью дисульфидных (-S-S-) связей (мостиков) тяжелые цепи соединены между собой и легкие цепи также удерживаются около тяжелых цепей. Если раствор иммуноглобулина обработать протеолитическим ферментом папаином, то молекула иммуноглобулина гидролизуется с образованием 2-х вариабельных участков и одной константной части. Легкая цепь, начиная с N-конца, и такой же по длине участок Н-цепи формируют вариабельный участок - Fab-фрагмент. Аминокислотный состав Fab-фрагмента очень сильно различается у разных иммуноглобулинов. Fab - фрагмент может связываться с соответствующим антигеном слабыми типами связей. Именно этот участок обеспечивает специфичность связи иммуноглобулина со своим антигеном. В пределах молекулы иммуноглобулина выделяют также Fc-фрагмент - константная (одинаковая) для всех иммуноглобулинов часть молекулы. Формируется за счет Н-цепей. Есть участки, взаимодействующие с первым компонентом системы комплемента (или с рецепторами на поверхности определенного типа клеток). Кроме того, Fc - фрагмент обеспечивает иногда прохождение иммуноглобулина через биологическую мембрану, например, через плаценту. Взаимодействие Fab-фрагмента со своим антигеном приводит к значительному изменению конформации всей молекулы иммуноглобулина. При этом становится доступным тот или иной участок в пределах Fc-фрагмента. Взаимодействие этого открывшегося центра с первым компонентом системы комплемента или с рецепторами клетки, что приводит к образованию иммунного комплекса "антиген-антитело". Синтез иммуноглобулинов значительно отличается от синтеза других белков. Каждая из L-цепей кодируется группой из 3-х различных генов, а Н-цепь - четырьмя генами. Таким образом обеспечивается огромное разнообразие структуры антител, их специфичность к различным антигенам. В организме человека потенциально возможен синтез приблизительно 1 миллиона различных антител. Гликопротеины - (ГП) - класс соединения белков с олигосахаридами (гексозамины, гексозы, фрукозы, сиаловые кислоты), входящие в состав как волокон, так и аморфного вещества. Гликопротеины играют большую роль в формировании структуры межклеточного вещества соединительной ткани и определяют его функциональные особенности (примеры ГП: фибронектин, хондронектин, фибриллин, ламинин др.). Фибриноктин - главный поверхностный гликопротеин фибробласта, полагают, что он обуславливает липкость, подвижность, рост и специализацию клеток. Фибриллин - формирует микрофибриллы, усиливает связь между внеклеточными компонентами. Ламинин - компонент базальной мембраны, состоящий из 3-х полипептидных цепочек, связанных между собой дисульфидными соединениями, а также с коллагеном V типа и поверхностными рецепторами клеток.  5. Гипо- и гиперпротеинемия. Парапротеинемия. Диспротеинемия. Агамма-глобулинемия. С-реактивный белок (СРБ). Диспротеинемия- изменение физиологического соотношения белков сыворотки крови. Возникает при патологических состояниях, напр. При заболев.печени- ↓альбумины, ↑γ-глобулины, при заболев.почек- ↓альбумины, при атеросклерозе ↑β-глобулины. Парапротеинемия- появление в крови необычных белков, отличающихся от норм. Физико-химич.св-ами,биологической активности. Напр. Появление пироглобулинов при сифилисе, криоглобулинов при вирусных паразитарных инфекциях, и др. Гипопротеинемия- снижение уровня белка в крови меньше 60г/л, причинами явл-ся протеинурия, ↓синтеза в печени, голодание. Рез-т- отеки, асцит. Гиперпротеинемия- ↑содерж.белка в крови. 2 вида: относительная-связана с ↓объема жидкости, рез-т-обезвоживание орг-ма.; абсолютная(парапротеинемия)- появление аномальных белков, напр примиеломной болезни-цепи иммуноглобулинов в моче появл-ся белки Бени-Джонса.Рез-т онкология. Агаммаглобулинемия (синоним синдром дефицита антител, болезнь Брутона) —отсутствие или резкое снижение содержаниягамма-глобулиновв плазме крови. При этом снижается или становится невозможной выработка необходимого количества антител, в связи с чем больные агаммаглобулинемией чрезвычайно подвержены инфекционным заболеваниям. Различают наследственную и приобретенную агаммаглобулинемию. Наследственная агаммаглобулинемия — редкое заболевание, бывает у мальчиков (обычно выявляется ввозрастедо 6 лет); она связана с недоразвитием лимфоидно-плазматической ткани и утратой организмом способности синтеза гамма-глобулинов. Приобретенная агаммаглобулинемия встречается у людей обоего пола в возрасте от 7 до 70 лет; в ряде случаевболезньявляется следствием перенесенных тяжелых инфекционных заболеваний либо возникает при злокачественных новообразованиях лимфоидного аппарата (хронический лимфолейкоз и др.), нефрозах и др. Клинически агаммаглобулинемия характеризуется предрасположенностью к бактериальным инфекциям при нормальной сопротивляемости против вирусной инфекции. Инфекционные заболевания при агаммаглобулинемии протекают длительно, с частыми обострениями и тяжелыми осложнениями C-реактивный белок . Содержится в крови здоровых людей в очень низких концентрациях ,менее 10 мг/л. Его функция неизвестна. Концентрация С-реактивного белка значительно увеличивается при острых воспалительных заболеваниях. Поэтому С-реактивный белок называют белком "острой фазы" (к белкам острой фазы относятся также альфа-1-антитрипсин, гаптоглобин). С1-ингибитор - гликопротеид, является основным регуляторным звеном в классическом пути активации комплемента (КПК), способен угнетать плазмин, калликреин. При недостатке С1-ингибитора развивается ангионевротический отек. 6. Ферментные белки крови: альдолаза, аминотрансферазы (АLТ, АSТ), лактатдегидрогеназа, щелочная и кислая фосфатаза, креатинкиназа, амилаза. Изоферменты ЛДГ и креатинкиназы. Диагностическое значение определения активности ферментов и изоферментов в крови. По функции белки-ферменты плазмы крови делят на: а) Собственно ферменты плазмы - выполняют специфичные метаболические функции в плазме. К собственно ферментам плазмы относятся такие протеолитические системы, как система комплемента, система регуляции сосудистого тонуса и некоторые другие. б) Ферменты, поступающие в плазму в результате повреждения того или иного органа, той или иной ткани в результате разрушения клеток. Обычно не выполняют в плазме метаболическую функцию. Однако для медицины представляет интерес определение активности некоторых из них в плазме крови в диагностических целях (трансаминазы, лактатдегидрогеназа, креатинфосфокиназа и др.) α-Амилаза участвует в расщеплении крахмала, гликогена и некоторых других углеводов до моно- и дисахаридов (мальтозы, глюкозы). Ею богаты слюнные и поджелудочная железы. Активность α – амилазы в крови изменяется под влиянием приема пищи: днем она выше, чем ночью. Увеличивается активность при: остром панкреатите и обострении хронического; эпидемическом паротите; «хирургических» заболеваниях, вызванных поражением органов брюшной полости (аппендицит, перитонит и т. д.); диабетическом ацидозе; после приема алкоголя, введения адреналина, кортикостероидов, наркотических веществ, тетрациклина; отравлении метанолом. Снижение отмечается при: атрофии и фиброзе поджелудочной железы; тиреотоксикозе; инфаркте миокарда. Аминотрансферазы (АлАТ и АсАТ) АлАТ содержится в основном в печени. Увеличивается активность при: вирусном гепатите; токсическом повреждении печени; инфекционном мононуклеозе; холестазе; циррозе печени; осложненном инфаркте миокарда; лечении больных большими дозами салицилатов, фибратов. АсАТ присутствует в миокарде и ткани скелетной мускулатуры. Увеличивается его активность при: мышечных дистрофиях; инфаркте миокарда (через 4-6 часов после болевого приступа с максимальной концентрацией на 3-5 сутки); тяжелом приступе стенокардии, тахиаритмии; остром ревмокардите; тромбозе легочной артерии; токсическом поражении печени; инфекционном мононуклеозе; холангите; остром алкогольном отравлении; остром панкреатите; амебоидных инфекциях. Уменьшение АсТ и АлТ в сыворотке крови встречается при тяжелых поражениях печени, когда уменьшается количество клеток, синтезирующих эти ферменты (обширный некроз, цирроз). Лактатдегидрогеназа (ЛДГ) –ускоряет превращение молочной кислоты в пировиноградную и наоборот. Является внутриклеточным энзимом, который содержится в почках, печени, сердце, скелетных мышцах, эритроцитах. В тканях содержатся 5 изоферментов ЛДГ. Увеличение активности ЛДГ-1 или отношения ЛДГ-1/ЛДГ-2 отмечается при: инфаркте миокарда; мегабластной анемии; болезнях почек. ЛДГ-5 повышается при многих заболеваниях печени; повреждении скелетных мышц; раке. ЛДГ-3 при тромбозе, эмболии легочной артерии; почечных заболеваниях, сердечно-легочной недостаточности. ЛДГ-4 и 5 повышается при нарушении кровообращения, которое связано с сердечной недостаточностью, поражениях паренхимы печени, повреждениях скелетных мышц. Креатинфосфокиназа (КФК) – принимает участие в реакциях энергообразования и содержится в наибольшом количестве в сердечной и скелетной мускулатуре. Чаще всего анализ на этот белок проводят при инфаркте миокарда, т.к. он очень чувствителен и специфичен. Увеличение активности креатинкиназы в крови отмечается при: инфаркте миокарда (важнейший диагностический признак); аритмии сердца, прогрессирующей мышечной дистрофии; после тяжелой физической нагрузки, при напряжении мышц (беге); внутримышечных инъекциях лекарственных средств (особенно наркотических и обезболивающих); снижении функции щитовидной железы (гипотиреозе); нарушении мозгового кровообращения, инсульте; острой алкогольной интоксикации; шизофрении, маниакально-депрессивном психозе, эпилепсии; травмах головы. Снижается при тиреотоксикозе. Липаза (панкреатическая) синтезируется поджелудочной железой и принимает участие в расщеплении нейтральных жиров. Ее изменение при заболеваниях поджелудочной железы аналогично изменению α-амилазы, однако одновременное определение этих ферментов позволяет диагностировать поражение поджелудочной железы с тонностью до 98%. Щелочная фосфатаза (ЩФ) – участвует в минеральном (фосфорно-кальциевом) обмене, но проявляет максимальную активность в щелочной среде. Содержится в большом количестве в стенках желчных протоков печени, костях, слизистой оболочке кишечника, плаценте, почках. Этот белок является биохимическим маркером кальциево-фосфорного обмена в костной ткани, скрининговым тестом остеопороза. Увеличение ЩФ отмечается при: заболеваниях печени, сопровождающихся холестазом; механической желтухе; злокачественных заболеваниях костей, остеомаляции; рахите; инфекционном мононуклеозе; диффузном токсическом зобе, ограниченной склеродермии; раке гепатодуоденальной зоны, циррозе печени. Уменьшение отмечается при: снижении функции щитовидной железы (гипотиреозе); старческом остеопорозе; выраженной анемии; цинге, гиповитаминозе С и Д. Кислая фосфотаза (КФ) – участвует в реакциях обмена ионов фосфорной кислоты. Наибольшее содержание обнаруживается в предстательной железе, что используется как очень чувствительный и специфичный показатель ее патологии. Также содержится в эритроцитах, тромбоцитах, почках, селезенке. Увеличение активности КФ отмечается при раке предстательной железы, заболеваниях почек, гепатобилиарной системы, ревматизме, пневмонии, бронхите, мегалобластной анемии, остеопорозе и др. Ложноположительные результаты могут наблюдаться при катетеризации мочевого пузыря, обследовании и биопсии предстательной железы, поэтому анализы необходимо проводить через 2 дня после этих манипуляций. Уменьшение КФ выявлено при тромбоцитопениях. Гамма-глутамилтрансфераза (γ-ГТФ) задействована в превращениях аминокислот и пептидов, используется для диагностики заболеваний печени и желчных путей. Увеличение ГГТ отмечается при остром гепатите и обострении хронического, печеночной коме, механической желтухе, острой интоксикации. При нормальной активности γ-ГТФ вероятность заболевания печени очень мала. Глюкозо-6-фосфатдегидрогеназа (Г-6-ФДГ) принимает участие в процессах окисления глюкозы. Используется в основном для выявления наследственных заболеваний, связанных с дефицитом этого белка-катализатора, отсутствие которого приводит к гемолизу. Пепсин – основной фермент желудочного сока, секретируется в виде пепсиногена. Повышение его уровня отмечается при усиленной секреции желудочного сока, утолщении стенок желудка, язве 12-перстной кишки, опухоли поджелудочной железы. Снижение пепсиногена отмечается при атрофическом гастрите, опухолях желудка, болезни Аддисона. 7. Небелковые азотсодержащие вещества крови в норме и при патологии. Остаточный азот крови. ОРГАНИЧЕСКИЕ НЕБЕЛКОВЫЕ СОЕДИНЕНИЯ ПЛАЗМЫ Делятся на две группы: I группа - азотсодержащие небелковые компоненты В состав небелкового азота крови входит азот промежуточных и конечных продуктов обмена простых и сложных белков. Раньше небелковый азот называли "остаточный азот" (остается после осаждения белков): азот мочевины (50%) азот аминокислот (25%) низкомолекулярные пептиды креатин креатинин билирубин индикан некоторые другие азотсодержащие вещества При некоторых заболеваниях почек, а также при патологии, сопровождающейся массивным разрушением белков (например, тяжелые ожоги), может повышаться небелковый азот крови, т.е наблюдается азотемия. Однако наиболее часто нарушается не общее содержание небелкового азота в крови, а соотношение между отдельными компонентами небелкового азота. Поэтому сейчас в плазме определяют азот отдельных компонентов. В понятие "остаточный азот" включают и низкомолекулярные пептиды. Среди низкомолекулярных пептидов есть много пептидов, обладающих высокой биологической активностью (например, гормоны пептидной природы). Подробнее о них - см. лекцию по теме “Протеолиз”. II группа - безазотистые органические вещества 1) Углеводы, липиды и продукты их метаболизма (глюкоза, ПВК, лактат, кетоновые тела, жирные кислоты, холестерин и его эфиры и др.). 2) Минеральные вещества крови 8. Азотемия, её виды (ретенционная и продукционная), причины. Азотемия - увеличение остаточного азота в крови 1. относительная - при сгущении крови, при обезвоживании 2. абсолютная - накопление азотистых шлаков A) продукционная - при усиленном распаде белков -увеличивается за счет аминокислот Б) ретенционная -почечная - при заболеваниях почек, нарушается выведение мочевины - внепочечная - замедляется доставка азотистых шлаков к почкам Urea ratio =азот мочевины/ остаточный азот =48 9. Безазотистые органические вещества крови: липиды (холестерол, фосфолипиды, ТАГ), глюкоза, пируват, лактат, кетоновые тела. В крови постоянно циркулирует большая группа соединений, представляющих собой питательные вещества или промежуточные продукты их обмена. К ним относятся глюкоза, молочная кислота, триглицериды, липоиды, холестерин, свободные жирные кислоты, минеральные соли и др. Глюкоза в крови содержится в пределах 80-120 мг%. Этот уровень отличается постоянством. Гипо- или гипергликемии бывают физиологическими или патологическими. К физиологическим относятся изменения уровня глюкозы в зависимости от питания, в период беременности и т. д. Патологическое увеличение или уменьшение глюкозы возникает при различных заболеваниях (сахарный диабет, гликогенозы, галактоземия и др.). Молочная кислотаприсутствует в крови в небольших количествах - 5,0-15 мг на 100 мл плазмы. Она увеличивается при поражении печени и тяжелой мышечной работе. Ацетоновые телав крови составляют 0,1-0,5 мг%. Их увеличение имеет большое клиническое значение, так как наблюдается при сахарном диабете, голодании, рвотах. Липиды в цельной крови находятся на уровне 380 мг%. В плазме их количество в несколько раз выше, чем в эритроцитах. Повышение жира в крови называется липемией. Физиологическую липемию, вызванную приемом большого количества жирной пищи, отличают от патологической, имеющей в своей основе нарушения процессов обмена жира. Туберкулез, алкоголизм характеризуются стойкой липемией, достигающей иногда 10 г на 100 мл крови. Триглицериды в основном сосредоточены в плазме и составляют 100 - 250 мг%. Общего холестерина в крови содержится 15.0- 250 мг%. Его уровень значительно повышается при атеросклерозе, подагре, ожирении, сахарном диабете. Лецитина больше в эритроцитах, чем в плазме,- соответственно 350 и 150 мг%. 10.Минеральные вещества крови (Na+ , K+ , Ca2+ , Pn, Cl־ ,Fe, Cu).   |
