восстановление оксида железа. Курсовой ТМП Королев. Восстановление оксидов железа водородом
 Скачать 4.53 Mb. Скачать 4.53 Mb.
|
|
Министерство образования и науки Российской Федерации Федеральное агентство по образованию  Южно-Уральский государственный университет Южно-Уральский государственный университетФилиал в г. Златоусте Факультет Металлургический Кафедра «Общая металлургия» Курсовая работа По курсу «Теория металлургических процессов» На тему: «Восстановление оксидов железа водородом» Выполнил: Королев Е.А. Группа: ЗД-239 Проверил: Дильдин А.Н. Златоуст 2011г. Содержание: Введение………………………………………………………………………3 Восстановление оксидов железа водородом…………………………...4 Задача №1. Взаимодействие углерода с кислородосодержащей газовой фазой.……………………………………………………………………….…9 Задача №2. Восстановление оксида железа оксидом углерода и водородом…………………………………………………………………...13 Заключение………………………………………………………………….15 Библиографический список………………………………………………..16 ВведениеМеталлургия — одна из древнейших областей деятельности человека. Неслучайно отдельные эпохи истории названы, исходя из распространения того или иного металла: "бронзовый век", "железный век". В глубокой древности была разработана оригинальная, весьма интересная технология прямого получения железа. На территории нашей страны еще в 1400 году до нашей эры, как утверждают археологи, уже выплавляли железо так называемым кричным методом. Сначала в гopнаx при температуре около 1000 градусов (такую температуру можно создать, не применяя современных способов нагрева) восстанавливали железную руду обыкновенным углем, получали так называемую крицу. Затем крицу, своего рода железную губку, многократно проковывали в горячем состоянии. В результате появилось довольно чистое железо, из которого можно было изготовить различные предметы быта и оружие. Типичным же способом изготовлена и знаменитая металлическая колонна, которая высится близ города Дели. Воздвигнута она в начале V века нашей эры и изготовлена из железа феноменальной чистоты - металл содержит лишь 0,28 % примесей. Простояла колонна более 1500 лет без каких-либо признаков коррозии. Со временем двух ступенчатая система восстановления железа углем с последующей ковкой – единственная тогда промышленная схема черной металлургии – отошла в небытие. Ее заменил доменный процесс, который в сочетании с мартеновским и кислородно-конверторным царствует в современной металлургии. Однако экономика и дополнительные требования к чистоте металла снова вызвали к жизни старый, испытанный метод. Побуждающие причины достаточно очевидны. Кроме дефицита энергоресурсов и в частности кокса, можно указать быстро растущую потребность в высококачественном металле. Авиация, ракетная техника, приборостроение и т.д. ВОССТАНОВЛЕНИЕ ОКСИДОВ ЖЕЛЕЗА ВОДОРОДОМ В качестве газов - восстановителей используют водород, оксид углерода, их смеси, углеводород. Если для восстановления использовать водород, то анализ термодинамической возможности восстановления оксидов может быть проведен с помощью диаграммы G0=f(T) для реакции образования оксидов металлов и водяного пара. Процесс восстановления в этом случае можно представить уравнением: МеОк + Н2= Мек + Н2О, где МеОк и Мек – конденсированные фазы оксида и металла. Система имеет (С=К+2–Ф=3+2–3=2) две степени свободы. Если заданы общее давление и температура, то состав газовой фазы состоящей из Н2 и Н2О, равновесной с твердыми фазами, определяется путем решения двух уравнений: с учетом, что Некоторые металлы, как например, железо образуют несколько оксидов. Восстановление, как и диссоциация в этом случае протекает в две или более стадий. Для оксидов железа , при температурах выше 840 К восстановление протекает по трехстадийной схеме: При температурах ниже 840 К Fe3O4 восстанавливается сразу до железа, поэтому процесс Fe2O3 двухстадийный: Одинаковое количество атомов железа, участвует в каждой реакции, приведено для облегчения оценки относительного количества кислорода, каждой стадии процесса. 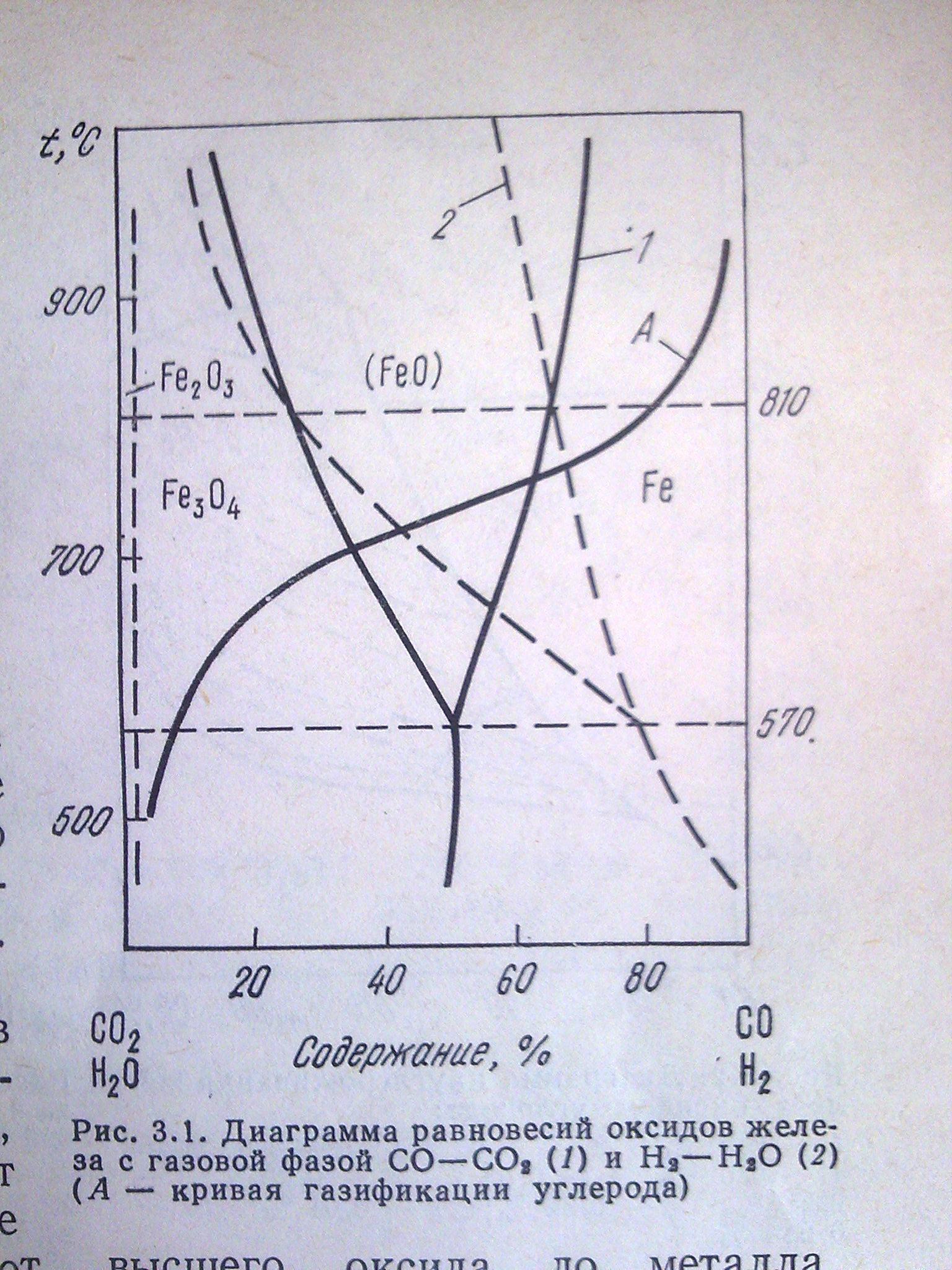 Рисунок 1. Диаграмма равновесий оксидов железа с газовой фазой СО – СО2 (1) и Н2 – Н2О (2) (А – кривая газификации углерода) На рис.1 линия равновесного состава газа для реакции (3) нанесена условно, вследствие необратимости этой реакции газовая фаза практически полностью состоит из паров воды. Используя рис. 1, можно при заданной температуре, общем давлении и парциальном давлении газа определить область существования конденсированной фазы железа. Равновесные характеристики восстановления других оксидов могут быть рассчитаны подобным образом. Сопоставление линий равновесного состава газовой фазы при восстановлении оксидов железа газами СО и Н2 (рис.1) показывает, что при температурах T < 1083 K для восстановления оксидов железа требуется более высокое по сравнению с СО парциальное давление Н2 в газовой фазе. При T > 1083 K соотношение обратное: для соответствующих оксидов равновесное парциальное давление Н2 ниже, чем равновесное парциальное давление СО. Таким образом, при T < 1083 K более сильным восстановителем является оксид углерода, а при T > 1083 K – водород. Это изменение восстановительной способности СО и Н2 иллюстрирует рис.1 (пересечение линий равновесного состава смесей СО – СО2 и Н2 – Н2О). Оксид FeO на диаграмме состояния имеет области нестехиометрического состава. В вюстите (FeO), например, имеющем важное значение при производстве железа и его сплавов, массовое содержание кислорода зависит от температуры и может изменяться от 23,1 до 25,6%. Если использовать линии равного парциального давления кислорода, в вюститной области системы Fe – O, то можно рассчитать составы газовой фазы Н2 – Н2О, равновесной с вюститом различного состава. На практике удобно пользоваться данными, показывающими содержание кислорода в вюстите, равновесном с газовой фазой различного состава. Линии равного содержания кислорода в вюстите, равновесном с газовой фазой Н2 – Н2О представлена на рис.2. 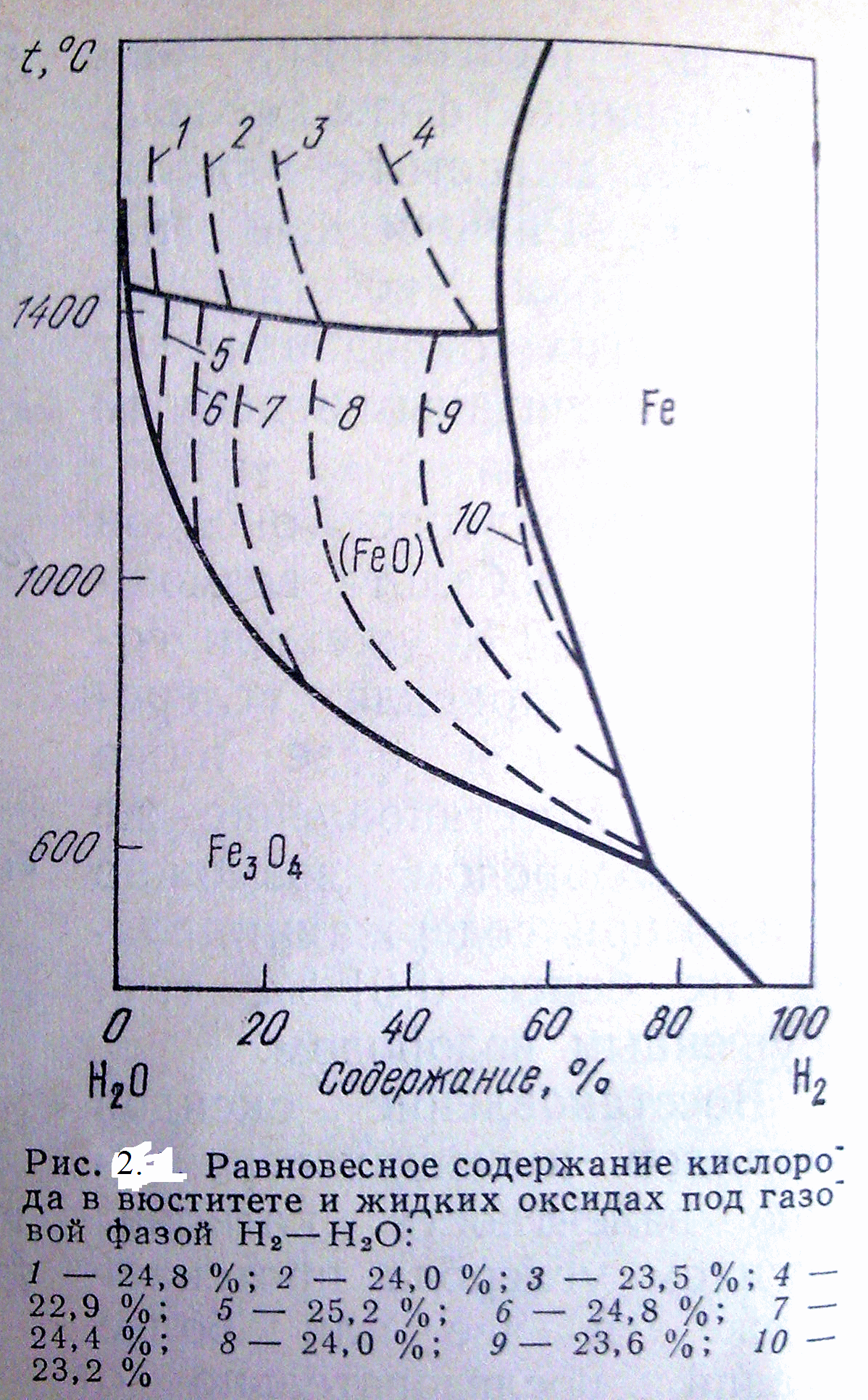 Рисунок 2. Равновесное содержание кислорода в вюстите и жидких оксидах под газовой фазой Н2 – Н2о: 1- 24,8%; 2 – 24,0%; 3 – 23,5%; 4 - 22,9%; 5 - 25,2%; 6 - 24,8%; 7 - 24,4%; 8 - 24,0%; 9- 23,6%; 10-23,2% При восстановлении оксидов, находящихся в растворе или образующих химическое соединения с другими оксидами, например, вюстит с MnO, MgO, CaO, процессы восстановления имеют свои особенности, связанные с учетом активности оксида, находящегося в растворе. Равновесие реакции восстановления в общем виде можно представить уравнением: где Видно, что в процессе восстановления изменяется (уменьшается) концентрация При восстановлении, например, раствора вюстита в MnO константа равновесия зависит от активности FeO в растворе MnO 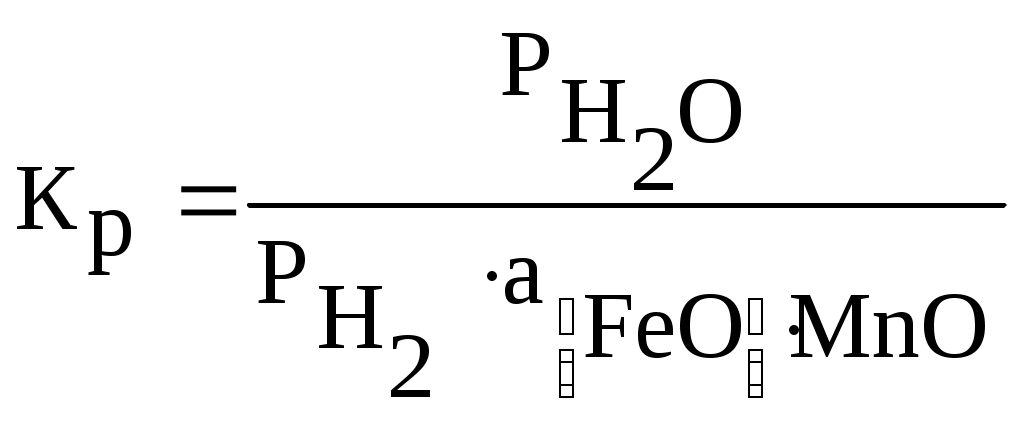 (10) (10)Активности компонентов твердого раствора (Mn, Fe) О были определены различными методами, в частности путем установления равновесных составов смесей Н2 – Н2О и СО – СО2 с этими растворами и при помощи твердых электролитов. Подобным образом можно определить равновесный состав газовой фазы при восстановлении Fe3O4 из раствора с Mn3О4, которые образуют систему твердых растворов. Образование растворов характерно для металлургических процессов. Так, вюстит при 1100 0С растворяет до 28% СаО, а СаО до 15% вюстита. Дихромтриоксид (Cr2O3) растворяется в вюстите до 5% при 1350 0С и образует соединение Fe Cr2O4, которое в свою очередь, образует с магнетитом непрерывный ряд твердых растворов. Кроме того в процессах восстановления сложных оксидных систем в большинстве случаев возможно образование различных соединений между исходными оксидными фазами, промежуточными и конечными продуктами восстановления, а также сопутствующими оксидами. На практике часто не осуществляются равновесные условия, отсутствуют термодинамические данные для восстановления многих соединений, поэтому обычно производится приближенная оценка равновесий. Тем не менее, учет образования промежуточных соединений при проведении соответствующих расчетов позволяет проводить нужные корректировки технологических процессов. Задача №1. Взаимодействие углерода с кислородосодержащей газовой фазой. Рассчитайте значения равновесного давления кислорода и кислородных потенциалов в равновесной газовой смеси, образующейся при взаимодействии обогащённого кислородом воздуха (N2 – O2) с твердым углеродом для шести заданных температур. Исходные данные для расчёта:
Решение: Для определения равновесного состава газовой смеси, находим соотношение между азотом и кислородом в обогащенном воздухе: γ= 2С + О2 = 2СО (1) С + О2 = СО2 (2) С+СО2=2СО (3) Константа равновесия для реакции (1) равна: 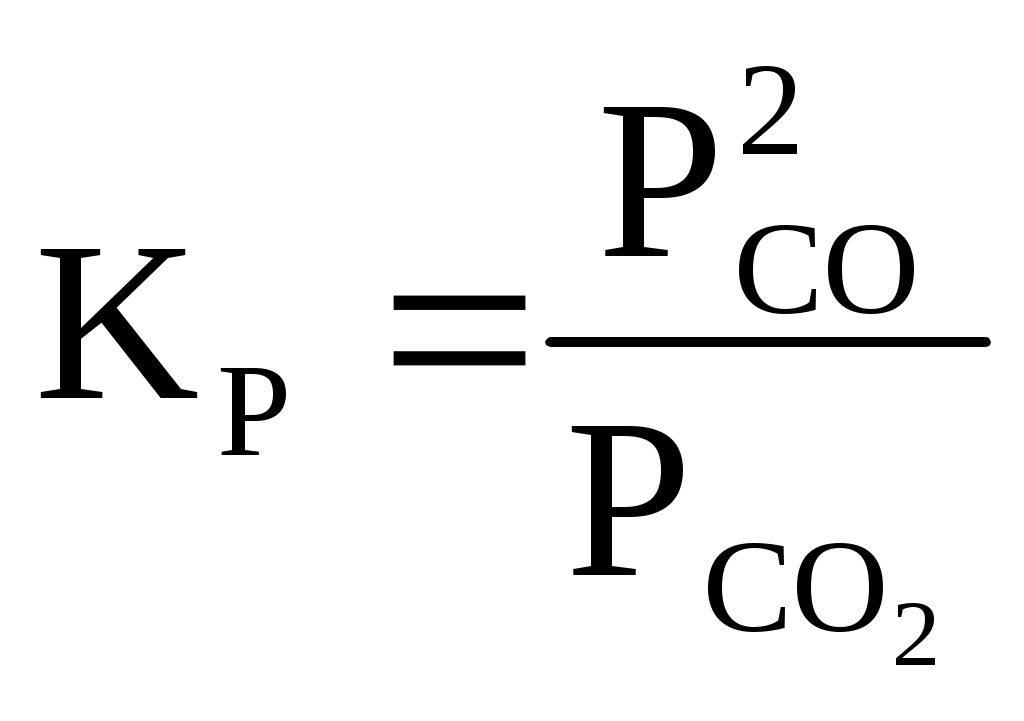 Пользуясь уравнением
Находим равновесный состав газовой смеси: СО,%= 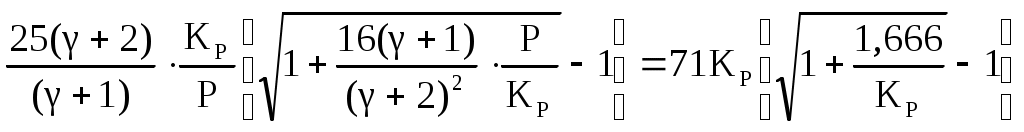 (4) (4)где Р – общее давление в газовой смеси СО2,% = N2,%=100-(СО,%+СО2,%) (6) 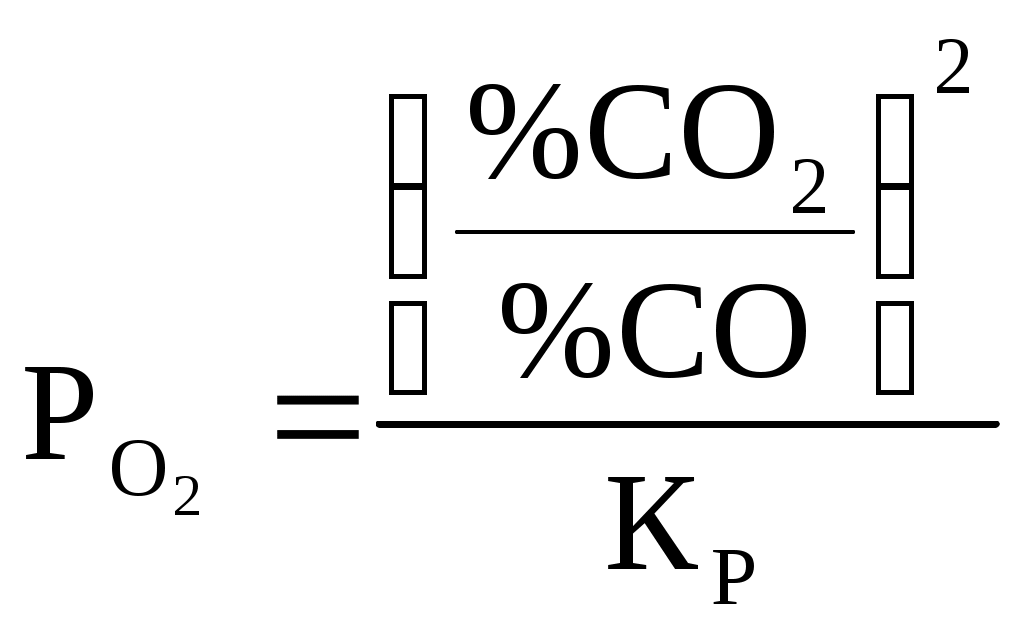 (8) (8)Результаты расчётов сведены в таблицу 1. Таблица 1
По данным таблицы 1 строим график зависимости состава равновесной газовой смеси для реакции газификации углерода от температуры. 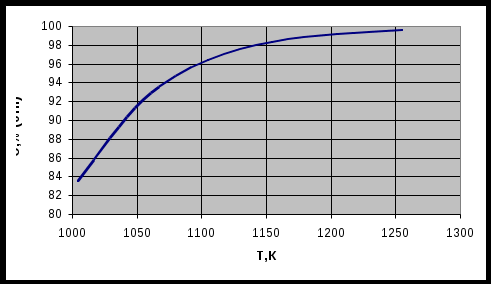 Рисунок 1 – график зависимости состава равновесной газовой смеси углерода от температуры Вывод: Проанализировав график, сделаем вывод, что при увеличении температуры концентрация СО увеличивается. Строим график зависимости равновесного давления кислорода в газовой смеси для реакции газификации углерода от температуры. 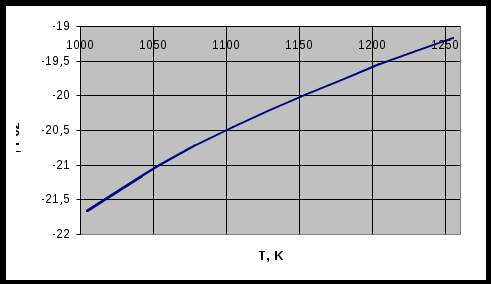 Рисунок 2 – график зависимости равновесного давления от температуры Вывод: Проанализировав график, сделаем вывод, что при увеличении температуры давление над кислородом в газовой реакции газификации углерода увеличивается. Строим график зависимости кислородного потенциала для равновесной газовой смеси СО-СО2 от температуры. 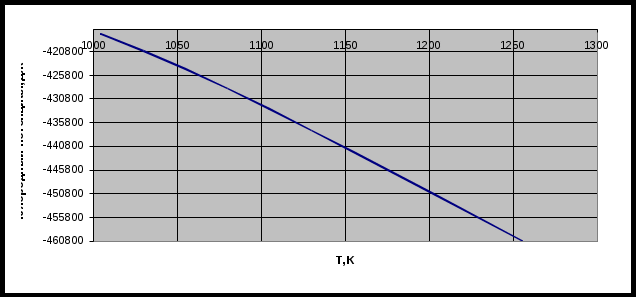 Рисунок 3 – график зависимости кислородного потенциала от температуры Вывод: Проанализировав график, сделаем вывод, что при увеличении температуры кислородный потенциал для равновесной газовой смеси СО-СО2 уменьшается. Задача №2 Восстановление оксида железа оксидом углерода и водородом. Определить равновесный состав газовых реакций восстановления оксидов железа водородом при заданной температуре (Т=1420К). Решение: 1. 2. 3. 4. Т.к. Т=1420 К то реакция под номером 4 происходить не будет Определим константы равновесия для каждой реакции по формуле где Но константа равновесия реакции находится еще и по следующей формуле: 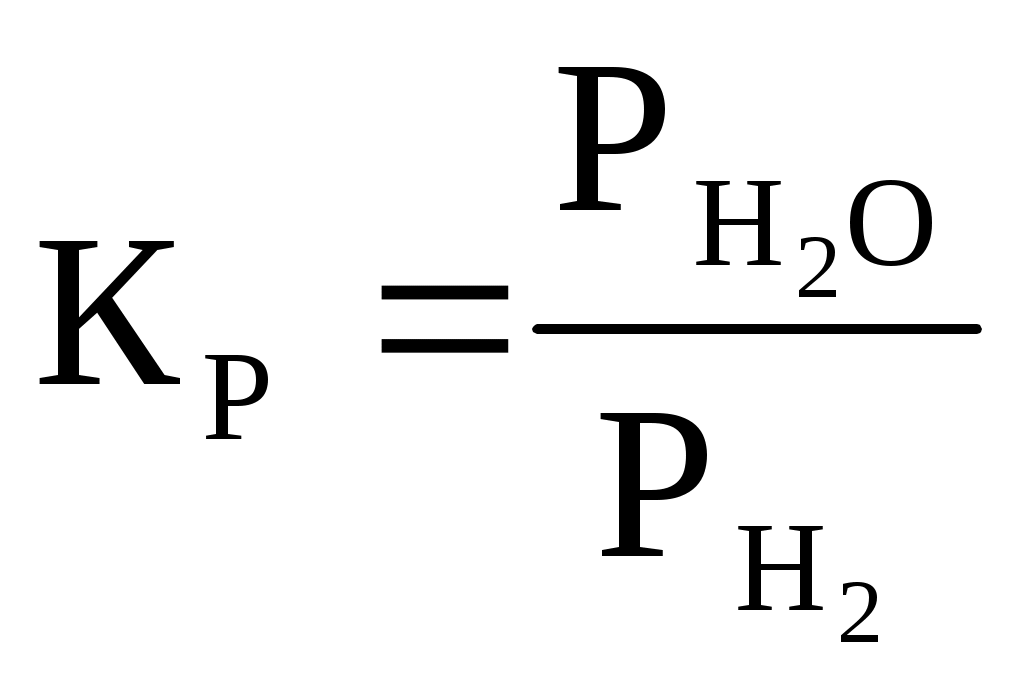 (2) (2)где Общее давление равно Общее давление примем равным 1. Подставим (3) в (2) и получим: 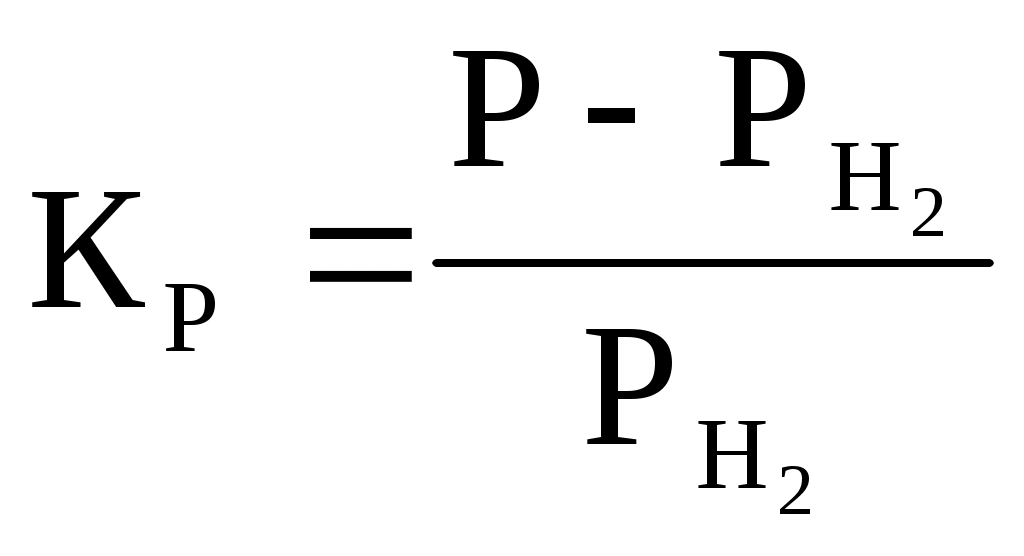 (4) (4)где РН2 будет определять долю Н2 в реакции восстановления в процентах Подставим вместо КР значения, полученные по формуле (1). Равновесный состав газовых реакций восстановления оксидов железа водорода предоставлен в таблице 2 Таблица 2
ЗаключениеМетоды бездоменного производства металла и в первую очередь метод прямого восстановления железа находит все большее количество приверженцев, что сопряжено, прежде всего, с возрастающими потребностями в чистом металле. Основным сдерживающим его развития фактором в настоящее время являются потребности в наличии природных ресурсов – богатой железом руды, природного газа и достаточного количества электроэнергии. Их получение в свою очередь предполагает крупные финансовые вложения. Тем не менее, в мире наметилась всеобщая тенденция к наращиванию объемов и мощностей по производству железа прямого восстановления (или губчатого железа). Металлургию будущего не без основания часто называют водородной. В настоящее время водород обходится дорого. Его получение, хранение и транспортировка сопряжены со множеством чисто технических проблем. Однако произведенные эксперименты и предварительные расчеты показывают, что можно получать водород с такой низкой себестоимостью, что "водородная металлургия" обретет надежную экономическую основу. А если учесть полную экологическую безопасность водородных методик, то сомнение в том, что именно они предопределяют будущее металлургии ни у кого не возникает. Разумеется, водородное восстановление – только начало технологического цикла металлургии. Но все остальные звенья требуют хорошего исходного сырья. Им, несомненно, будет восстановленное водородом железо, то есть побочный продукт ядерных реакторов. БИБЛИОГРАФИЧЕСКИЙ СПИСОК 1. Рыжонков, Д.И. Теория металлургических процессов: учебное пособие для вузов / Д.И. Рыжонков, П.П. Арсентьев, В.В. Яковлев и др. – М.: Металлургия, 1989. – 392 с. 2. Попель, С.И. Теория металлургических процессов: учебное пособие для вузов / С.И. Попель, А.И. Сотников, В.И. Бороненков. – М.: Металлургия, 1986. – 463 с. 3. Падерин, С.Н. Теория и расчеты металлургических систем и процессов: учебное пособие для вузов / С.Н. Падерин, В.В. Филиппов. – М.: МИСИС, 2002. – 334 с. 4. Григорян, В.А. Теоретические основы электросталеплавильных процессов: учебник для вузов / В.А. Григорян, Л.И. Белянчиков, А.Я. Стомахин. – М.: Металлургия, 1989. – 288 с. 5. Казачков, Е.А. Расчеты по теории металлургических процессов: учебное пособие для вузов / Е.А. Казачков. – М.: Металлургия, 1988. – 288 с. 6. http://www.roman.by/r-57603.html  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
