Электродегидратор. Плохотников. Вред и польза спиртов
 Скачать 57.4 Kb. Скачать 57.4 Kb.
|
|
Государственное профессиональное образовательное учреждение «Анжеро-Судженский политехнический колледж» Специальность: 20.02.04 Пожарная безопасность ВРЕД И ПОЛЬЗА СПИРТОВ Индивидуальный проект Выполнил: Студент группы 522 Калугин Д.А. Проверил: Булгакова Л.А. 2023 СОДЕРЖАНИЕ
ВВЕДЕНИЕ Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и значение в медицине. Но потребление спиртных напитков в мире характеризуется огромными цифрами, достигающими размеры экологических катастроф. От этого страдает все общество, в первую очередь под угрозу ставится подрастающее поколение: дети, подростки, молодежь, а также здоровье будущих матерей. Ведь алкоголь особенно активно влияет на несформировавшийся организм, постепенно разрушая его. Цель данной работы: изучить вредные и полезные воздействия спиртов на различные органы и системы органов живых организмов Задачи: Узнать что такое спирты; Познакомиться с историей появления и изучения спиртов; Понять, какой же вред и пользу несут спирты Изучить физические и химические свойства спиртов. Актуальность работы обусловлена объективной потребностью современного общества, в употреблении спиртов. Люди привыкли воспринимать спиртное как нечто безобидное, влияющее, разве что, на состояние организма следующим постпраздничным утром. Или другое, бытующее среди людей убеждение: алкоголь возбуждает, взбадривает, улучшает настроение, самочувствие, делает беседу более оживленной и интересной, что немаловажно для компании молодых людей. Метод исследования: поиско-аналитический с практическим применением, общенаучный метод исследования, а также использованы методы естествознания и другие. 1 СПИРТЫ Спирты – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа ОН связана с алифатическим атомом углерода (соединения, у которых атом углерода в группировке С–ОН входит в состав ароматического ядра, называются фенолами). Наиболее известными и распространенными являются этиловый, метиловый и фенилэтиловый спирты. Различные виды спиртов можно не только получить в лабораторных условиях, но и встретить в природе. Они содержатся в листьях растений (например, метиловый), в естественно перебродивших органических продуктах (этанол), в эфирных растительных маслах. Также некоторые витамины относятся спиртовому классу: А, В8 и D. Спирт в нормальных физических условиях имеет прозрачный цвет, резкий характерный запах и вкус, является хорошим растворителем маслянистых и жиросодержащих веществ. Крепость спирта варьируется от 95,57 до 100 об. 1.1 История возникновения спиртов Считается, что не менее чем за 8000 лет до нашей эры люди были знакомы с действием перебродивших фруктов, а позже — с помощью брожения получали хмельные напитки, содержащие этанол, из фруктов и мёда. Археологические находки свидетельствуют, что в Западной Азии виноделие существовало ещё в 5400—5000 годах до н. э., а на территории современного Китая, провинция Хэнань, найдены свидетельства производства «вина», вернее ферментированных смесей из риса, мёда, винограда и, возможно, других фруктов, в эпоху раннего неолита: от 6500 до 7000 гг. до н. э. Впервые спирт из вина получили в VI—VII веках арабские химики, а первую бутылку крепкого алкоголя (прообраза современной водки) изготовил персидский алхимик Ар-Рази в 860 году. В Европе этиловый спирт был получен из продуктов брожения в XI—XII веке, в Италии. В Россию спирт впервые попал в 1386 году, когда генуэзское посольство привезло его с собой под названием «аква вита» и презентовала царскому двору. В 1660 году английский химик и богослов Роберт Бойль впервые получил обезвоженный этиловый спирт, а также открыл его некоторые физические и химические свойства, в частности обнаружив способность этанола выступать в качестве высокотемпературного горючего для горелок. Абсолютированный спирт был получен в 1796 году русским химиком Т. Е. Ловицем. В 1842 году немецкий химик Я. Г. Шиль открыл, что спирты образуют гомологический ряд, отличаясь на некоторую постоянную величину. Правда, он ошибся, описав её как C2H2. Спустя два года, другой химик Шарль Жерар установил верное гомологическое соотношение CH2 и предсказал формулу и свойства неизвестного в те годы пропилового спирта. В 1850 году английский химик Александр Вильямсон, исследуя реакцию алкоголятов с иодистым этилом, установил, что этиловый спирт является производным от воды с одним замещенным водородом, экспериментально подтвердив формулу C2H5OH. Первое исследование метилового спирта было сделано в 1834 году французскими химиками Жаном-Батистом Дюма и Эженом Пелиго; они назвали его «метиловым или древесным спиртом», так как он был обнаружен в продуктах сухой перегонки древесины. Впервые третичный спирт (2-метил-пропан-2-ол) синтезировал в 1863 году известный русский ученый А. М. Бутлеров, положив начало целой серии экспериментов в этом направлении. Двухатомный спирт — этиленгликоль — впервые был синтезирован французским химиком А.Вюрцем в 1856 году. Трехатомный спирт — глицерин — был обнаружен в природных жирах ещё в 1783 году шведским химиком Карлом Шееле, однако его состав был открыт только в 1836 году, а синтез осуществлен из ацетона в 1873 году Шарлем Фриделем. 2 КЛАССИФИКАЦИЯ СПИРТОВ 1. В зависимости от количества гидроксильных групп в молекуле спирты делят на: а) одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН б) многоатомные (две и более гидроксильных групп), например, этиленгликоль HO–СH2–CH2–OH, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4. Соединения, в которых у одного атома углерода есть две гидроксильных группы, в большинстве случаев нестабильны и легко превращаются в альдегиды, отщепляя при этом воду: RCH(OH)2 RCH=O + H2O Спирты, содержащие три группы ОН у одного атома углерода, не существуют. 2. По типу атома углерода, с которым связана группа ОН, спирты делят на: а) первичные, у которых ОН-группа связана с первичным атомом углерода. Первичным называют атом углерода (выделен красным цветом), связанный всего с одним углеродным атомом. Примеры первичных спиртов – этанол СH3–CH2–OH, пропанол СH3–CH2–CH2–OH. б) вторичные, у которых ОН-группа связана с вторичным атомом углерода. Вторичный атом углерода (выделен синим цветом) связан одновременно с двумя атомами углерода, например, вторичный пропанол, вторичный бутанол (рис. 1). 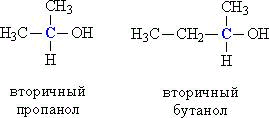 Рисунок 1 - Строение вторичных спиртов. в) третичные, у которых ОН-группа связана с третичным атомом углерода. Третичный углеродный атом (выделен зеленым цветом) связан одновременно с тремя соседними атомами углерода, например, третичный бутанол и пентанол (рис. 2). 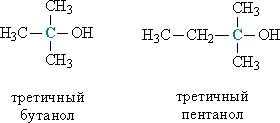 Рисунок 2 - Строение третичных спиртов В соответствии с типом углеродного атома присоединенную к нему спиртовую группу также называют первичной, вторичной или третичной. У многоатомных спиртов, содержащих две или более ОН-групп, могут присутствовать одновременно как первичные, так и вторичные НО-группы, например, в глицерине или ксилите (рис. 3). 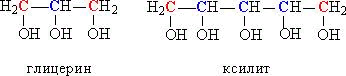 Рисунок 3 - Сочетание в структуре многоатомных спиртов первичных и вторичных он-групп. 3. По строению органических групп, связанных ОН-группой, спирты подразделяют на предельные (метанол, этанол, пропанол), непредельные, например, аллиловый спирт СН2=СН–СН2–ОН, ароматические (например, бензиловый спирт С6Н5СН2ОН), содержащие в составе группы R ароматическую группу. Непредельные спирты, у которых ОН-группа «примыкает» к двойной связи, т. е. связана с атомом углерода, участвующим одновременно в образовании двойной связи (например, виниловый спирт СН2=СН–ОН), крайне нестабильны и сразу же изомеризуются в альдегиды или кетоны: CH2=CH–OH CH3–CH=O 2 СВОЙСТВА И ПРИМЕНЕНИЕ СПИРТОВ В зависимости от того, сколько в молекуле углеводородных радикалов, спирты могут быть жидкими, вязкими, твердыми. Водорастворимость уменьшается с ростом количества радикалов. Простейшие спирты смешиваются с водой в любых пропорциях. Если же в молекулу входит более 9 радикалов, то вообще не растворяются в воде. Все спирты хорошо растворяются в органических растворителях. — Спирты горят, выделяя большое количество энергии. — Вступают в реакции с металлами, в результате чего получаются соли. — Алкоголяты — Взаимодействуют с основаниями, проявляя качества слабых кислот. — Реагируют с кислотами и ангидридами, проявляя основные свойства. Результатом реакций являются сложные эфиры. — Воздействие сильными окислителями приводит к образованию альдегидов или кетонов (в зависимости от вида спирта). — При определенных условиях из спиртов получают простые эфиры, алкены (соединения с двойной связью), галогенуглеводороды, амины (производные от аммиака углеводороды). Спирты токсичны для человеческого организма, некоторые — ядовиты (метилен, этиленгликоль). Этилен оказывает наркотическое воздействие. Опасны и пары спиртов, поэтому работы с растворителями на основе спирта должны производиться с соблюдением техники безопасности. Тем не менее, спирты участвуют в естественном метаболизме растений, животных и человека. К категории спиртов относятся такие жизненно важные вещества как витамины A и D, стероидные гормоны эстрадиол и кортизол. Более половины липидов, поставляющих энергию нашему организму, имеют в своей основе глицерин. Применять спирты можно в разных отрослях, таких как: — В органическом синтезе; — Биотопливо, добавки в топливо, ингредиент тормозной жидкости, гидравлических жидкостей; — Растворители; — Сырье для производства ПАВ, полимеров, пестицидов, антифризов, взрывчатых и отравляющих веществ, бытовой химии; — Душистые вещества для парфюмерии. Входят в состав косметических и медицинских средств; — Основа алкогольных напитков, растворитель для эссенций; сахарозаменитель (маннит и т.п.); краситель (лютеин), ароматизатор (ментол). 3 ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ 3.1Физические свойства Этиловый спирт (этанол) С2Н5ОН — бесцветней жидкость, легко испаряющаяся (температура кипения 64, 7 ºС, температура плавления - 97, 8 ºС, оптическая плотность 0, 7930) . Спирт, содержащий 4—5 % воды, называют ректификатом, а содержащий только доли процента воды — абсолютным спиртом. Такой спирт получают химической обработкой в присутствии водоотнимающих средств (например, свежепрокаленного СаО). 3.2 Химические свойства Как у всех кислородосодержащих соединений, химические свойства спирта определяются, в первую очередь, функциональными группами и, в известной степени, строением радикала. Характерной особенностью гидроксильной группы этилового спирта является подвижность атома водорода, что объясняется электронным строением гидроксильной группы. Отсюда способность этилового спирта к некоторым реакциям замещения, например, щелочными металлами. С другой стороны, имеет значение и характер связи углерода с кислородом. Вследствие большой электроотрицательности кислорода по сравнению с углеродом, связь углерод-кислород также в некоторой степени поляризована с частичным положительным зарядом у атома углерода и отрицательным – у кислорода. Однако, эта поляризация не приводит к диссоциации на ионы, спирты не являются электролитами, а представляют собой нейтральные соединения, не изменяющие окраску индикаторов, но они имеют определенный электрический момент диполя. Спирты являются амфотерными соединениями, то есть могут проявлять как свойства кислот, так и свойства оснований. Физико-химические свойства спиртов определяются в основном строением углеводородной цепи и функциональной группы −OH, а также их взаимным влиянием: 1 Чем больше заместитель, тем сильнее он влияет на функциональную группу, снижая полярность связи O—Н. Реакции, основанные на разрыве этой связи, протекают более медленно. 2 Гидроксильная группа −ОН уменьшает электронную плотность вдоль прилегающих связей углеродной цепи (отрицательный индуктивный эффект). 4 ВРЕД И ПОЛЬЗА СПИРТОВПольза спирта пирт имеет большое количество полезных свойств и способов применения. Он является антисептическим и дезодорирующим средством, применяющегося для обеззараживания медицинских инструментов, кожных покровов и рук медработников перед операцией. Также спирт добавляют в качестве пеногасителя в аппарат искусственной вентиляции воздуха и используют в качестве растворителя при изготовлении лекарственных препаратов, экстрактов и настоек. В ликеро-водочной промышленности спирт применяют для крепления алкогольных напитков, а в пищевой – в качестве консерванта и растворителя натуральных красителей и ароматизаторов. В быту спирт используют спирт для растирания при высокой температуре, согревающих компрессов и для приготовления лекарственных настоек. Т.е. спирт в чистом виде – это пустой напиток, который облагораживается за счет настаивания на нем лекарственных трав и плодов. ЗАКЛЮЧЕНИЕ В ходе работы над проектом я узнал, какой русский народный характер есть в рассказах В.М. Шукшина В.М. Шукшин создал уникальный портрет своего героя, который собрал в себя основные черты русского национального характера, ключевым понятием которого, по мнению автора, является добро. Русский человек способен сопереживать, жалеть, но также проявлять твердость, мужество и силу духа. Ему свойственно и простодушие, медлительность, леность, мечтательность, но есть хитрость и смекалка. Мы можем говорить о контрастности народного характера. Результатом работы писателя стал самобытный образ героя-«чудика», который является продолжением традиции изображения «странного» героя в русской литературе. В своих скромных и неприметных героях Шукшин удивительным образом заключал необыкновенную красоту и народную мудрость, вдохновение и любовь к жизни. Все его «чудики», герои-мыслители и философы, герои-творцы, «энергичные люди» - русские характеры. В каждом из них можно найти исконно русские черты. Народно-образные ассоциации и восприятия создают в шукшинских рассказах цельную систему понятий национальных, исторических и философских: о бесконечности жизни, о родине, о необходимости духовных связей человека с ней и со всем миром. Всеобъемлющий образ России становится центром всего творчества писателя. Его мировоззрение, жизненный опыт, обостренное чувство родины и интерес к человеку обусловили своеобразие прозы Шукшина. Составляя в 1974 году книгу своих рассказов, он написал обращение к читателю: «Русский народ за свою историю отобрал, сохранил, возвёл в степень уважения такие человеческие качества, которые не подлежат пересмотру: честность, трудолюбие, совестливость, доброту. Мы из всех исторических катастроф вынесли и сохранили в чистоте великий русский язык, он передан нам нашими дедами и отцами…Уверуй, что всё было не зря: наши песни, наши сказки, наши неимоверной тяжести победы, наше страдание – не отдавай всего этого за понюх табаку. Мы умеем жить. Помни это. Будь человеком». Заветы великого писателя забывать не следует. В заключении я хочу сказать, что мной поставленные цели и задачи были достигнуты. СПИСОК ИНФОРМАЦИОННЫХ ИСТОЧНИКОВ 1 Апухтина В.А. Проза В. Шукшина / Апухтина В.А. – Москва: Издательский центр «Академия», 1989. ‑ 288 с. ‑ ISBN 978-5-4468-6477-5. 2 Вертлиб Е.А.Русское – от Загоскина до Шукшина / Вертлиб Е.А, Л. С. Гордеев, Д. П. Вент ‑ Екатеринбург: 1999 – 270 с. ‑ ISBN 978-5-534-10978-8. 3 Вербицкий В.В. Трудный путь к истине // В.М. Шукшин Калина красная. Повести и рассказы. / Вербицкий В.В, Л. С. Гордеев, Д. П. Вент. ‑ Москва: 1993 – 270 с. ‑ ISBN 978-5-534-10981-8. 4 Горн В.Ф.Василий Шукшин. Штрихи к портрету / В.Ф. Горн, С. М. Головлева. ‑ Москва: Издательский центр «Академия» 1995. – 304 с. ‑ ISBN 978-5-6-4468-0294-4. 5 Лейдерман Н.Л. «Чудики» и мироздание (О прозе Василия Шукшина) / Лейдерман Н.Л., О. Д. Пестовников. ‑ Москва: 1991. ‑ 192 с. ‑ ISBN 978-5-4468-8780-4. 6 Михеева Н. В. Требования к оформлению выпускной квалификационных работ в электронном виде в соответствии с ГОСТ 2.105-95: методические указания / Н. В. Михеева, В. И. Сумина, А.С.Усманов. – Анжеро-Судженск: ГПОУ АСПК, 2022. – 38 с. |
