Диплом про гриб. Березовый гриб. Введение березовый гриб тритерпеновый флавоноид
 Скачать 4.88 Mb. Скачать 4.88 Mb.
|
|
2.1.2 Определение зольности Навески массой 1 г помещали в предварительно прокаленные до постоянной массы фарфоровые тигли и равномерно распределяли по дну тигля. Тигли с навеской помещали в муфельную печь. Прокаливание ведется при красном калении (550-650 °С) до постоянной массы, необходимо избегать спекания золы со стенками тигля. По окончании прокаливания, немного остывшие тигли ставим в эксикатор. Охлажденные тигли взвешиваем. Постоянная масса считается достигнутой, если разница между двумя последующими взвешиваниями не превышает 0,0005 г [15]. Содержание общей золы Х, (%), в абсолютно сухом сырье вычисляется по формуле (2.5):  , (2.5) , (2.5)где m1 - масса золы, г; m2 - масса навески сырья, г; w - потеря в массе сырья при высушивании, %. Эксперимент был проведен тремя параллельными определениями (Таблица 2.2).  Таблица 2.2 - Содержание золы в березовом грибе (чаге)
Содержание золы в сырье (чага) составляет 8.6±0.34 %, что соответствует данным Государственной Фармакопеи (9%) [21]. 2.1.3 Определение количества экстрактивных веществ Определение количества экстрактивных веществ проводили при комнатной температуре. Брали три фарфоровые чашки, предварительно доведенные до постоянной массы. В чашки вносили по 5 мл экстракта. Экстракт в фарфоровых чашках выпаривали на водяной бане досуха. Дальнейшее высушивание проводили в сушильном шкафу при температуре 100-105 °С. Содержание экстрактивных веществ Х, (%), рассчитывали от веса сухого сырья по формуле (2.6) [15].  , (2.6) , (2.6)где m- масса сухого остатка в чашке, г; m1- масса сырья, г; ω- потеря в массе сырья при высушивании, %. Эксперимент был проведен тремя параллельными определениями (Таблица 2.3).  Таблица 2.3 - Содержание экстрактивных веществ в березовом грибе (чаге)
Содержание экстрактивных веществ в сырье (чага) составляет 21.9±0.20 %,что соответствует данным Государственной Фармакопеи (22%) [21]. 2.1.4 Определение хромогенного комплекса 10 г измельченного сырья помещают в колбу на 500 мл, приливают 300 мл воды и оставляют на 1 ч при комнатной температуре. Затем соединяют с обратным холодильником и кипятят, поддерживая слабое кипение в течение 2 ч, после этого фильтруют через бумажный фильтр в мерную колбу емкостью 500 мл. Сырье переносят на фильтр и промывают теплой водой. Водное извлечение охлаждают до 18-20 °С, доводят объем до метки и тщательно перемешивают. 25 мл фильтрата переносят во взвешенную фарфоровую чашку, выпаривают на водяной бане досуха и сушат при температуре 100-105 °С в течение 3 ч, затем охлаждают в эксикаторе и взвешивают, определяя массу сухого остатка. Для определения хромогенного комплекса 100 мл фильтрата помещают в стакан емкостью 150 мл, подкисляют 25% раствором HCl (0,5-0,8 мл) до рH 1,0 - 2,0 по универсальной индикаторной бумаге, перемешивают и оставляют на 30 минут. После выпадения осадка фильтруют через складчатый фильтр. 25 мл фильтрата переносят в взвешенную фарфоровую чашку, выпаривают досуха и сушат при температуре 100-150 °С в течение 3 ч. Содержание хромогенного комплекса в чаге Х, (%), вычисляем по формуле (2.7):  , (2.7) , (2.7)где m1- масса сухого остатка, г; m2 - масса сухого остатка без хромогенного комплекса, г; m - масса измельченного сырья, г; w - потеря в массе сырья при высушивании, %. Эксперимент был проведен тремя параллельными определениями (Таблица 2.4).  Таблица 2.4 - Содержание хромогенного комплекса в березовом грибе (чаге)
Содержание хромогенного комплекса в сырье (чага) составляет 39.0±0.42 %,что соответствует данным Государственной Фармакопеи (39%). 2.2 Исследование спиртового экстракта чаги Чага широко используется в народной медицине. Для приготовления настоек из чаги чаще всего используется в качестве растворителя этиловый спирт. Поэтому для исследования лекарственных свойств спиртовых экстрактов производим их наработку. Выделение и идентификация флавоноидов чаги Березовый гриб - чагу измельчали до мелкодисперсного состояния при помощи электрического измельчителя (РМ-120). Измельченной чагой в виде порошка заполняли изготовленный из фильтровальной бумаги патрон (mпатрона=3.82г, mпатрона+чага=43.54г, mчаги=39.72г). Затем патрон помещали в аппарат Сокслета (Рисунок 2.6) и проводили экстракцию спиртом до полного извлечения всех экстрактивных веществ, растворимых в спирте. В качестве растворителей использовали этиловый спирт. Экстракцию прекращали, когда растворитель в аппарате Сокслета прекращал окрашиваться и оставался бесцветным. Полученный после экстракции раствор (экстракт) изучали с помощью тонкослойной хроматографии с применением цветных реакций. 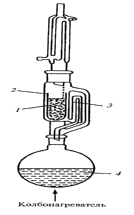 Рисунок 2.6 - Аппарат Сокслета: 1-экстрагируемое вещество; 2-пористая гильза; 3-трубка сифона; 4-растворитель Для этого на пластинки «Silufol» наносили анализируемые экстракты. Путем предварительного подбора выявляли наиболее подходящую систему растворителе для хроматографирования флавоноидов. Для этого использовали следующие системы растворителей: 1. н-бутанол - уксусная кислота - вода (4:1:5); 2. бензол - хлороформ - муравьиная кислота - этанол - этиловый эфир (30:5:5:5:10); . хлороформ - бензол - этилацетат (4:8:1). Анализ хроматограмм в различных системах растворителей показало следующее: 1. в первой системе флавоноиды проявились в виде одного пятна с Rf=0,71, но не проявились другие индивидуальные компоненты (Рисунок 2.7,а); . во второй системе наблюдается частичное разделение флавоноидов, но пятна имеют достаточно низкий Rf до 0,1. Однако в данной хроматограмме можно наблюдать другие индивидуальные компоненты такие как фенолокислоты, стерины, терпеновые соединения (Рисунок 2.7,б); . третья система часто применяется для терпеновых соединений, хорошо показала разделение фенолокислот кислот от терпеновых соединений. Однако флавоноиды также остались на старте (Рисунок 2.7,в). 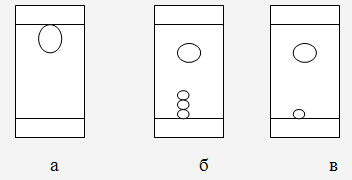 Рисунок 2.7 - Спиртовый экстракт чаги в различных системах растворителей Следовательно, наиболее подходящая система растворителей для хроматографирования флавоноидов является система: н-бутанол - уксусная кислота - вода (4:1:5) (Таблица 2.5). Таблица 2.5 - Качественные реакции на флавоноиды
После хроматографирования спиртового извлечения в различных системах растворителей и обработки хроматограмм специфическими проявителями пришли к выводу, что в спиртовом экстракте чаги содержится представители следующих классов: флавоноиды (халконы), терпеновые соединения, фенолокислота, стерины. 2.3 Комплексное исследование химического состава березового гриба - чаги По литературным данным березовый гриб - чага содержит большое количество соединений, принадлежащих к различным классам биологически активных соединений, что требует дальнейшего их изучение и идентификации. Для этого последовательно экстрагируем сырье растворителями с повышающимся градиентом полярности (гексан, толуол, этилацетат) в аппарате Сокслета (Рисунок 2.6) с целью разделения биологически активных комплексов по полярности. Березовый гриб - чагу измельчаем до мелкодисперсного состояния при помощи электрического измельчителя (РМ-120). Измельченной чагой в виде порошка заполняли изготовленный из фильтровальной бумаги патрон. Затем патрон помещали в аппарат Сокслета и проводим последовательно экстракцию гексаном, толуолом, этилацетатом до полного извлечения всех экстрактивных веществ, которые растворимы в гексане, толуоле, этилацетате. Экстракцию прекращали, когда растворитель в аппарате Сокслета прекращал окрашиваться, и оставался бесцветным. 2.3.1 Исследование гексановой фракции чаги Согласно схеме (Рисунок 2.8) проводим последовательную экстракцию в аппарате Сокслета. Первоначально проводим экстракцию гексаном при температуре 78°С (Ткип растворителя) до полного извлечения всех экстрактивных веществ, растворимых в гексане. Полученный гексановый экстракт упариваем до 10 мл, охлаждаем и наблюдаем выпадение осадка №1. Надосадочную жидкость сливаем и оставляем испарятся при нормальных условиях. В результате чего после 1 часа испарения также наблюдаем выпадение осадка №2 в надосадочной жидкости. Операцию повторяем, в результате чего получаем пять осадков (Таблица 2.6).  Рисунок 2.8 - Схема последовательной экстракции чаги растворителями с повышающимся градиентом полярности Таблица 2.6 - Выход осадков гексановой фракции
Исследование осадков гексановой фракции Полученные осадки перекристаллизовываем этиловым спиртом и проводим хроматографический анализ полученных осадков с помощью тонкослойной хроматографии на пластинках «Silufol». Использовали следующие системы растворителей: 1. хлороформ - бензол - этилацетат (4:8:1); 2. бензол - хлороформ - муравьиная кислота - этанол - этиловый эфир (30:5:5:5:10). Полученные хроматограммы просушиваем при комнатной температуре, просматриваем их в видимом и УФ - свете, проявляем ФМК. Исследование осадка №1 При хроматографическом анализе осадка №1 определяем три пятна. Распределение пятен в различных системах растворителей показано в таблице 2.7. Таблица 2.7 - Хроматографический анализ осадка №1
Исходя из полученных данных можно предположить, что в осадке №1 содержится фенолокислота, так как по литературным данным известно, что фенолокислоты флюоресцируют голубым свечением, а при опрыскивании ФМК проявляются синим цветом. Оставшиеся два пятна можно отнести к терпеновым соединениям, так как терпеновые соединения не флюоресцируют в УФ-свете, а с ФМК дают синее окрашивание. Идентификацию проводили при «свидетелях» - бетулине и лупеоле, которые являются основными терпеноидами бересты березы. Пятна 1 и 2 оказались идентичны бетулину (Rf1=0.39; Rf2=0.41) и лупеолу (Rf1=0.52; Rf2=0.59). В результате хроматографического анализа осадка № 1 можно сделать вывод о том, что осадок №1 содержит фенолокислоту, терпеновые соединения, а именно бетулин и лупеол. Исследование осадков №2, №3 Хроматографический анализе осадков №2, №3 выявил их идентичность. На хроматограмме выделены четыре пятна. Распределение пятен в различных системах растворителей показано в таблице 2.8. В обеих системах наблюдаем флюоресценцию голубым цветом пятна с Rf1=0.73 и Rf2=0.78, которые при опрыскивании ФМК дают синее окрашивание, что предполагаем наличие фенолокислот. Идентификацию проводили при «свидетелях» - бетулине, бетулиновой кислоте и лупеоле, которые являются основными терпеноидами бересты березы. Пятна 1, 2, 3 оказались идентичны бетулиновой кислоте (Rf1=0.17; Rf2=0.23), бетулину (Rf1=0.38; Rf2=0.47) и лупеолу (Rf1=0.52; Rf2=0.63). Отличие фракции 2 и 3 заключается в том что, бетулиновая кислота в осадке №2 находится в большей концентрации, чем в осадке №3. Таблица 2.8 - Хроматографический анализ осадка №2, №3
В результате хроматографического анализа осадков №2, №3 можно сделать вывод о том, что осадках №2, №3 обнаружены фенолокислота, терпеновые соединения, а именно лупеол, бетулин, бетулиновая кислота. Исследование осадка №4 При хроматографическом анализе осадка №4 определяем два пятна. Распределение пятен в различных системах растворителей показано в таблице 2.9. Исходя из полученных данных можно предположить, что в осадке №4 содержится фенолокислота с Rf1=0.71 и Rf2=0.80, так как пятна в системах 1 и 2 флюоресцировали голубым свечением, а при опрыскивании ФМК проявлялись синим цветом. Оставшееся одно пятно можно отнести к терпеновым соединениям. Идентификацию проводили при «свидетелях» - бетулине и лупеоле, которые являются основными терпеноидами бересты березы. Пятно 1 оказалось идентично бетулину с Rf1=0.39 и Rf2=0.57. Таблица 2.9 - Хроматографический анализ осадка №4
В результате хроматографического анализа осадка №4 были идентифицированы следующие классы соединений: фенолокислота, терпеновое соединение идентифицировано как бетулин. Исследование осадка №5 При хроматографическом анализе осадка №5 определяем одно пятно (Рисунок 2.9). Положение пятна в различных системах растворителей показано в таблице 2.10. Исходя из полученных данных можно предположить, что в осадке №5 содержится фенолокислота, так как пятно с Rf1=0.79 и Rf2=0.85 флюоресцирует голубым свечением, а при опрыскивании ФМК проявляются синим цветом. Таблица 2.10 - Хроматографический анализ осадка №5
 Рисунок 2.9 - Осадок № 5 в различных системах растворителей: а - хроматограмма в системе 1; б - хроматограмма в системе 2. В результате хроматографического анализа видим, что осадок № 5 является индивидуальным веществом, в УФ - свете флюоресцирует голубым цветом. Предполагаем, что осадок № 5 является фенолокислотой. Осадок № 5 представляет собой белые кристаллы, с Тплав=210-212 °С, растворимые в этаноле (Рисунок 2.10).  Рисунок 2.10 - Кристалл осадка № 5 Хроматографический анализ осадка № 5 в выше приведенных системах (№ 4 и 5) также потверждают индивидуальность соединения. Пятно в системе 4 имеет Rf=0.93 (Рисунок 2.11,а), в системе 5 имеет Rf=0.30 (Рисунок 2.11,б). 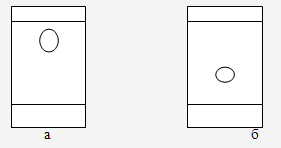 Рисунок 2.11 - Хроматограммы осадка № 5 в различных системах растворителей: а - Осадок № 5 в системе растворителей 4; б - Осадок № 5 в системе растворителей 5. Для проявления хроматограмм использовали следующие качественные реакции на фенолокислоты [28]: Реакция азосочетания, приводящая к образованию окрашенных соединений с диазотированным п-нитроанилином: 25 мл 0,3 % раствора п-нитроанилина в 8 % НCl смешиваем непосредственно перед употреблением с 1,5 мл 5 % водного раствора NaNO2 и полученной смесью обрабатываем хроматограммы. Через несколько минут хроматограмму дополнительно опрыскивают 20 % водным раствором Na2CO3. По литературным данным известно, что п-оксибензойная кислота дает бледно-желтую окраску, переходящую в розовую после опрыскивания раствором карбоната натрия. Ванилиновая кислота дает желтую окраску, переходящую в фиолетовую, протокатеховая и галловая - желтую окраску, переходящую соответственно в серовато-синию и светло-коричневую, п-кумаровая - желтую окраску, переходящую в синию. Осадок № 5 дает желтую окраску, переходящую в синию. Исходя их этого предполагаем п-кумаровую кислоту. Образование комплекса с 1% раствором железоаммониевых квасцов FeNH4(SO4)2 ·12H2O в воде [16]. Фенолы, имеющие орто- диоксигруппы, окрашиваются в зеленый, а три рядовые оксигруппы в синий цвет. Осадок № 5 с раствором железоаммониевых квасцов не изменяет свою окраску, что подтверждает наличие лишь одной фенольной группы. При вычислении Rf кислот и сравнение с литературными данными было доказано наличие п-кумаровой кислоты (Таблица 2.11). Таблица 2.11 - Хроматографический анализ фенолокислот в различных системах растворителей
Таким образом, осадок №5 идентифицирован как фенолокислота - п-кумаровая (Рисунок 2.12). Данная кислота была выделена как индивидуальное вещество (Рисунок 2.10). Были определены физико-химические параметры (Тплав=210-212°С, что соответствует литературным данным п-кумаровой кислоты).  Рисунок 2.12 - п-кумаровая кислота ИК-спектр ν см-1 (таблетка КВr): 3395 см-1 (валентные колебания ОН-группы); 2930 см-1 (углеродный скелет ароматического кольца); 1700 см-1 (валентные колебания С=О в карбонильной группе); 1650 см-1 (парадизамещенные в бензойное кольцо); 1450 см-1 (колебания ОН-группы в кислотах); 1390 см-1 (колебания ОН-группы в фенолах); 1040 см-1 (колебания СН-связи). Физические характеристики подтверждают предположения о том, что осадок № 5 представлен в виде п-кумаровой кислоты (Рисунок А.1). Таким образом, в гексановой фракции выделена и идентифицирована п-кумаровая кислота, содержание, которой от воздушно-сухого сырья составляет 0.02 %. Кроме того, идентифицироаны терпеновые соединения, а именно бетулиновая кислота, бетулин и лупеол. Исследование надосадочной жидкости гексанового экстракта Полученный гексановый экстракт упариваем, получаем раствор слабо-желтого цвета. Раствор сушим при нормальных условиях, получаем белый осадок с желтым маслообразным вкраплением, которое отмываем петролейным эфиром. Петролейный экстракт упариваем, получаем желтую маслообразную жидкость с массой 0.02г [25]. Хроматографирование полученной маслообразной жидкости в системе растворителей гексан - диэтиловый эфир - ледяная уксусная кислота (73:25:2), характерная для анализа липидов. На хроматограмме наблюдаем наличие размытого, характерного для высших жирных кислот, пятна с Rf от 0.46 до 0.58, с голубым свечением. Из этого можно сделать вывод о наличии высших жирных кислот в маслообразной жидкости из гексанового экстракта. После того как отделили белый осадок от желтой маслянистой жидкости, проводим хроматографический анализ осадка. Осадок растворяем в этиловом спирте, хроматографируем в системе растворителей: хлороформ - бензол - этилацетат (4:8:1). Полученную хроматограмму просматриваем в видимом и УФ-свете, проявляем ФМК. При хроматографическом анализе осадка выделены пять пятен. Распределение пятен в различных системах растворителей показано в таблице 2.12. Таблица 2.12 - Хроматографический анализ осадка гексанового экстракта
Исходя из полученных данных можно предположить, что в осадке обнаружена фенолокислота, так как пятое пятно флюоресцирует голубым свечением, а при опрыскивании ФМК проявляется синим цветом. Два пятна можно отнести к терпеновым соединениям. Идентификацию проводили при «свидетелях» - бетулине и лупеоле, которые являются основными терпеноидами бересты березы. Третье и четвертое пятна оказались идентичны бетулину (Rf=0.40) и лупеолу (Rf=0.57) соответственно. Второе пятно представлено в виде флавоноида, а именно флавонолы. Для подтверждения проводили качественные реакции на флавоноиды, для этого использовали пары аммиака (NH3), 5 % водный раствор соды (Na2CO3), 5 % спиртовый раствор хлорида алюминия (AlCl3). При проведении цветных реакций выявили соответствие второго пятна флавонолу, так как реакция на 5 % спиртовый раствор хлорида алюминия дает желтое окрашивание, 5 % водный раствор соды давал светло-желтое окрашивание, а пары аммиака - ярко-желтое окрашивание. Первое пятно не идентифицировано. В результате хроматографического анализа надосадочной жидкости можно сделать вывод о том, что в надосадочной жидкости находятся фенолокислоты, терпеновые соединения (бетулин, лупеол) и флавоноиды (флавонолы). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
