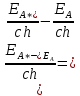спектральный аналлиз. Изучение химического состава вещества. Спектральные методы. Введение Изучение химического состава вещества
 Скачать 154.42 Kb. Скачать 154.42 Kb.
|
2.1 Атомно-эмиссионный спектральный анализМетоды эмиссионного спектрального анализа основаны на измерении длины волны, интенсивности и других характеристик света, излучаемого атомами и ионами вещества в газообразном состоянии. Возникновение спектрального анализа как метода определения химического состава вещества относится к 1860г., когда была опубликована работа Кирхгофа и Бунзена: «Химический анализ с помощью наблюдения спектра». Испускание света атомами происходит за счет изменения энергии атомов. Атомы могут обладать только строго определенными дискретными запасами внутренней энергии: E0,E1,E2 и т.д. Это означает также , что атомы не могут иметь энергию, промежуточное между E0 и E1 или между E1 и E2 и т.д. В невозбужденном, т.е. нормальном, состоянии атомы обладают минимальной энергией E0. При подведении энергии , например при столкновении с быстролетящими электронами, энергия которых достаточна для возбуждения, атомы возбуждаются , т.е. переходят на более высокий энергетический уровень: E1,E2 и т.д. Через очень короткое время ( 10-8 с) атом самопроизвольно возвращается в нормальное или какое-то более низкое возбужденное состояние. Освобождающаяся при этом энергия 10-8 с) атом самопроизвольно возвращается в нормальное или какое-то более низкое возбужденное состояние. Освобождающаяся при этом энергия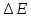 излучается в виде светового кванта hν: излучается в виде светового кванта hν: 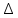 E=hν. (1) E=hν. (1) Частота излучения ν определяется соотношениемν=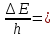 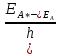 = = 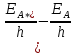 , (2) где EA* и EA –энергия атома в возбужденном и нормальном состояниях. Или, характеризуя излучение волновым числом (ν/,см-1): , (2) где EA* и EA –энергия атома в возбужденном и нормальном состояниях. Или, характеризуя излучение волновым числом (ν/,см-1): ν/= |
| Интервал длин волн | Участок спектра |
| 10-4…0,1 нм, или 10-13…10-10 м | γ – Излучение |
| 10-2…10 нм, или 10-11…10-8 м | Рентгеновские излучение |
| 10…400 нм , или 10-8…4*10-7 м | Ультрафиолетовое излучение |
| 400…760 нм, или 4*10-7…7,6*10-7м | Видимый свет |
| 760…106 нм, или 7,6*10-7…10-3 м | Инфракрасное излучение |
| 10-3 м …1 м | Микроволны или сверхвысокие частоты |
| λ > 1м | Радиоволны |