|
|
спектральный аналлиз. Изучение химического состава вещества. Спектральные методы. Введение Изучение химического состава вещества
2.2 Атомно-абсорбционный спектральный анализ.
Атом, ион или молекула, поглощая квант света, переходят в более высокое энергическое состояние. Обычно это бывает переход с основного, невозбужденного уровня на один из более высоких, чаще всего на первый возбужденный уровень. Вследствие поглощения излучения при прохождении его через слой вещества интенсивность излучения уменьшается и тем больше, чем выше концентрация светопоглощающего вещества. Закон Бугера – Ламберта - Бера связывает уменьшение интенсивности света, прошедшего через слой светопоглощающего вещества, с концентрацией вещества и толщиной слоя. Чтобы учесть потери света на отражения и рассеяние, сравнивают интенсивности света, прошедшего через исследуемый раствор и растворитель. При одинаковой толщине слоя в кюветах из одинакового материала, содержащих один и тот же растворитель, потери на отражение и рассеяние света будут примерно одинаковы у обоих пучков и уменьшение интенсивности света будут зависеть от концентрации вещества. Уменьшение интенсивности света, прошедшего через раствор, характеризуется коэффициентом пропускания (или просто пропусканием) Т:
T=l/ l0,(6) где l и l0 –соответственно интенсивности света, прошедшего через раствор и растворитель.
Взятый с обратным знаком логарифм Т называется оптической плотностью А:
-lgT= -lg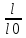 =lg =lg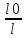 =A.(7) =A.(7)
Уменьшение интенсивности света при прохождении его через раствор подчиняется закону Бугера-Ламберта-Бера:
l=l0* 10- εlc ,(8)
или
l/l0=10- εlc,(9)
или
-lgT=A= εlc , (10)
где ε- молярный коэффициент поглощения; l – толщина светопоглощающего слоя; c- концентрация раствора.
Физический смысл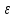 становится ясным, если принять l=1 см и c=1 моль/л, тогда А=ε. Следовательно, молярный коэффициент поглощения равен оптической плотности одномолярного раствора при толщине слоя 1см. становится ясным, если принять l=1 см и c=1 моль/л, тогда А=ε. Следовательно, молярный коэффициент поглощения равен оптической плотности одномолярного раствора при толщине слоя 1см.
Оптическая плотность раствора, содержащего несколько окрашенных веществ, обладает свойством аддитивности, которое иначе называют законом аддитивности светопоглощения. В соответствии с этим законом поглощение света каким-либо веществом не зависит от присутствия в растворе других веществ. При наличии в растворе несколько окрашенных веществ каждое из них будет давать свой аддитивный вклад в экспериментально определяемую оптическую плотность A:
A=A1+A2+…+Ak,(11)
где A1,A2 и т.д. – оптическая плотность вещества l, и вещества 2 и т.д.
При учете уравнения получаем
A=l(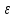 1c1+ 1c1+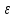 2c2+…+ 2c2+…+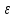 kck). (12) [2.2] kck). (12) [2.2]
Приборы для атомно-абсорбционного анализа - атомно-абсорбционные спектрометры - прецизионные высокоавтоматизированные устройства, обеспечивающие воспроизводимость условий измерений, автоматическое введение проб и регистрацию результатов измерения. В некоторые модели встроены микро ЭВМ. В качестве примера на рис. 5 приведена схема одного из спектрометров. Источником линейчатого излучения в спектрометрах чаще всего служат одноэлементные лампы с полым катодом, заполняемые неоном. Для определения некоторых легколетучих элементов (Cd, Zn, Se, Те и др.) удобнее пользоваться высокочастотными безэлектродными лампами.
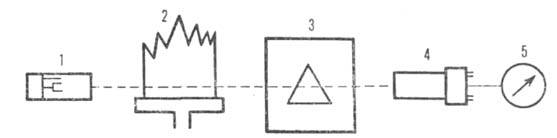
Рис.5 Принципиальная схема пламенного атомно-абсорбционного спектрометра:
1-источник излучения; 2-пламя; 3-монохроматор; 4-фотоумножитель; 5-регистрирующий или показывающий прибор.
Перевод анализируемого объекта в атомизированное состояние и формирование поглощающего слоя пара определенной и воспроизводимой формы осуществляется в атомизаторе - обычно в пламени или трубчатой печи. Наиболее часто используют пламя смесей ацетилена с воздухом (максимальная температура 2000°С) и ацетилена с N2O (2700°С). Горелку со щелевидным соплом длиной 50-100 мм и шириной 0,5-0,8 мм устанавливают вдоль оптической оси прибора для увеличения длины поглощающего слоя.
Трубчатые печи сопротивления изготавливают чаще всего из плотных сортов графита. Для исключения диффузии паров через стенки и увеличения долговечности графитовые трубки покрывают слоем газонепроницаемого пироуглерода. Максимальная температура нагрева достигает 3000 °С. Менее распространены тонкостенные трубчатые печи из тугоплавких металлов (W, Та, Мо), кварца с нихромовым нагревателем. Для защиты графитовых и металлических печей от обгорания на воздухе их помещают в полугерметичные или герметичные камеры, через которые продувают инертный газ (Аr, N2).
Введение проб в поглощающую зону пламени или печи осуществляют разными приемами. Растворы распыляют (обычно в пламя) с помощью пневматических распылителей, реже - ультразвуковых. Первые проще и стабильнее в работе, хотя уступают последним в степени дисперсности образующегося аэрозоля. Лишь 5-15% наиболее мелких капель аэрозоля поступает в пламя, а остальная часть отсеивается в смесительной камере и выводится в сток. Максимальная концентрация твердого вещества в растворе обычно не превышает 1%. В противном случае происходит интенсивное отложение солей в сопле горелки.
Термическое испарение сухих остатков растворов - основной способ введения проб в трубчатые печи. При этом чаще всего пробы испаряют с внутренней поверхности печи; раствор пробы (объемом 5-50 мкл) вводят с помощью микропипетки через дозировочное отверстие в стенке трубки и высушивают при 100°С. Однако пробы испаряются со стенок при непрерывном возрастании температуры поглощающего слоя, что обусловливает нестабильность результатов. Чтобы обеспечить постоянство температуры печи в момент испарения, пробу вводят в предварительно нагретую печь, используя угольный электрод (графитовую кювету) графитовый тигель (печь Вудриффа), металлический или графитовый зонд. Пробу можно испарять с платформы (графитового корытца), которую устанавливают в центре печи под дозировочным отверстием. В результате значительного отставания температуры платформы от температуры печи, нагреваемой со скоростью около 2000 К/с, испарение происходит при достижении печью практически постоянной температуры.
Для введения в пламя твердых веществ или сухих остатков растворов используют стержни, нити, лодочки, тигли из графита или тугоплавких металлов, помещаемые ниже оптической оси прибора, так что пары пробы поступают в поглощающую зону с потоком газов пламени. Графитовые испарители в ряде случаев дополнительно подогревают электрическим током. Для исключения механических потерь порошкообразных проб в процессе нагрева применяются испарители типа цилиндрических капсул, изготовленные из пористых сортов графита. Иногда растворы проб подвергают в реакционном сосуде обработке в присутствии восстановителей, чаще всего NaBH4. При этом Hg, например, отгоняется в элементном виде, As, Sb, Bi и др. - в виде гидридов, которые вносятся в атомизатор потоком инертного газа. Для монохроматизации излучения используют призмы или дифракционные решетки; при этом достигают разрешения от 0,04 до 0,4 нм. При атомно-абсорбционном анализе необходимо исключить наложение излучения атомизатора на излучение источника света, учесть возможное изменение яркости последнего, спектральные помехи в атомизаторе, вызванные частичным рассеянием и поглощением света твердыми частицами и молекулами посторонних компонентов пробы. Для этого пользуются различными приемами, например, модулируют излучение источника с частотой, на которую настраивают приемно - регистрирующее устройство, применяют двухлучевую схему или оптическую схему с двумя источниками света (с дискретным и непрерывным спектрами). наиболее эффективна схема, основанная на зеемановском расщеплении и поляризации спектральных линий в атомизаторе. В этом случае через поглощающий слой пропускают свет, поляризованный перпендикулярно магнитному полю, что позволяет учесть неселективные спектральные помехи, достигающие значений А = 2, при измерении сигналов, которые в сотни раз слабее[4].
2.3 Преимущества методов атомной спектроскопии.
Сравнительная оценка возможностей и характеристик различных оптических методов не может носить абсолютного характера в связи с большим разнообразием и спецификой задач анализа. Различными могут быть требования к концентрационному диапазону, точности и нижним границам количественных определений. В зависимости от массы анализируемой пробы существенно различны требования к характеристике пределов обнаружения, достигаемых применяемым методом анализа. Так, располагая большой массой пробы, можно решить задачу определения микропримесей с помощью методов анализа, характеризуемых низкими относительными пределами обнаружения. Если же в распоряжении аналитика имеется лишь малая масса пробы, метод анализа должен характеризоваться низкими абсолютными пределами обнаружения интересующих элементов-примесей. Не последнюю роль в оценке недостатков и достоинств различных методов играет экономичность этих методов: стоимость аппаратуры, расход энергии, трудовые затраты, продолжительность анализа.
Атомно-эмиссионный спектральный анализ - практически самый распространенный экспрессный высокочувствительный метод идентификации и количественного определения малых содержаний элементов. Важным достоинством метода по сравнению с другими оптическими спектральными, а также многими химическими и физико-химическими методами анализа является возможность одновременного количественного определения большого числа элементов в широком интервале концентраций с приемлемой точностью при использовании малой массы пробы.
Достоинства атомно-абсорбционного анализа - простота, высокая селективность и малое влияние состава пробы на результаты анализа. Атомно-абсорбционный анализ применяют для определения около 70 элементов. Пределы обнаружения большинства элементов в растворах при атомизации в пламени 1-100мкг/л, в графитовой печи в 100-1000 раз ниже. Абсолютные пределы обнаружения в последнем случае составляют 0,1-100пг. Относительно стандартное отклонение в оптимальных условиях измерений достигает 0,2-0,5% для пламени и 0,5-1,0% для печи. В автоматическом режиме работы пламенный спектрометр позволяет анализировать до 500 проб в час, а спектрометр с графитовой печью-до 30 проб. Оба варианта часто используют в сочетании с предварительным разделением и концентрированием экстракцией, дистилляцией, ионным обменом, хроматографией, что в ряде случаев позволяет косвенно определять некоторые неметаллы и органические соединения.
Методы атомно-абсорбционного анализа применяют также для измерения некоторых физических и физико-химических величин - коэффициент диффузии атомов в газах, температур газовой среды, теплот испарения элементов и др.; для изучения спектров молекул, исследования процессов, связанных с испарением и диссоциацией соединений [4.1].
2.4 Применение атомно-спектроскопических методов
Сточные воды – стоки бытовые, производственные и атмосферные, содержащие обычно множество неорганических и органических компонентов, причем точный состав их, даже в качественном отношении, не всегда можно заранее предвидеть. Последнее особенно справедливо в отношении сточных вод, прошедших через химическую или биохимическую очистку. Даже при простом смешении стоков от разных цехов предприятия происходят химические реакции между компонентами этих стоков, приводящие к образованию новых веществ. Поэтому при появлении нового вида сточных вод, возникающих не только при создании новых производств, но и при внедрении нового технологического процесса, требуется предварительное исследование. В ход определения того или иного компонента, казалось бы, хорошо разработанный и постоянно применяющийся. Приходится вносить изменения, а иногда и совершенно менять метод химического анализа [5].
Способ отбора пробы сточной воды зависит от цели, которая ставится перед исследователем в каждом случае. Надо следить за тем, чтобы отбираемая проба сточной воды не оказалась случайной.
Состав сточных вод обычно сильно колеблется и всецело зависит от технологического процесса производства. Поэтому необходимо перед отбором пробы подробно изучить этот процесс и брать средние или среднепропорциональные пробы в течение суток или нескольких суток, в зависимости от условий спуска сточных вод, так как некоторые цехи спускают сточные воды не ежедневно и не регулярно.
Основной метод определения неорганических компонентов сточных вод –атомно-абсорбционная спектрометрия [6].
Спектры поглощения и спектры испускания
Совокупность частот (или длин волн), которые содержатся в излучении какого-либо вещества, называют спектром испускания. Они бывают трех видов.
Сплошной - это спектр, содержащий все длины волны определенного диапазона от красного с ук = 7,6 107 и до фиолетового
уф = 4-1011 м. Сплошной спектр излучают нагретые твердые и жидкие вещества, газы, нагретые под большим давлением.
Линейчатый - это спектр, испускаемый газами, парами малой плотности в атомарном состоянии. Состоит из отдельных линий разного или одного цвета, имеющих разные расположения. Каждый атом излучает набор электромагнитных волн определенных частот. Поэтому каждый химический элемент имеет свой спектр.
Полосатый - это спектр, который испускается газом в молекулярном состоянии.
Линейчатые и полосатые спектры можно получить путем нагрева вещества или пропускания электрического тока.
Спектр поглощения (абсорбционный) - обусловлен энергетическим переходом из состояния с меньшей энергией в состояние с большей энергией.
Спектр испускания - обусловлен переходом из состояния с большей энергией в состояние с меньшей энергией. Спектры, испускаемые термически возбужденными частицами, называются эмиссионными.
Частицы вещества — атомы и молекулы — могут поглощать кванты энергии и переходить в возбужденное состояние, и затем чрезвычайно быстро (через 10-1-10-14 с) возвращаются в основное состояние. Поглощение энергии вызывает переход электрона, находящегося в атоме на внешнем уровне, на более высокие энергетические уровни. Количество энергии, необходимое для того, чтобы вызвать такой электронный переход, сравнительно велико, в частности, видимый или ультрафиолетовый свет.
Для того чтобы вызвать электронные переходы в молекулах, необходимо воздействовать на них излучением примерно такой же энергии. Однако молекула имеет и множество других разрешенных состояний, поскольку поглощение энергии может быть связано не только с электронными переходами, но и с изменением вращательных и (или) колебательных состояний исследуемого соединения. Таким образом, оптические спектры молекул получаются при изменении трех видов внутренней энергии молекул: энергии электронов; энергии колебания атомов в молекуле относительно некоторого положения равновесия; энергии вращения всей молекулы, подобно волчку, вокруг своей собственной оси, то есть:
Е=Еэл+Ек+Евр.
Каждому из этих видов внутренней энергии для молекул данного вещества соответствует свой набор энергетических уровней. Расстояние между уровнями, их количество и относительное расположение полностью определяется строением молекул вещества.
Возбуждая тот или иной вид внутренней энергии молекул, получают молекулярные спектры: вращательные; колебательные; электронные.
Для возбуждения вращательного спектра нужна небольшая энергия - 0,005 - 0,025 эВ, для колебания атомов в молекуле - 0,05 - 0,5 эВ, для возбуждения электронных спектров - 5 - 10 эВ. Однако в чистом виде не удается получить электронные и колебательные спектры. Одновременно с возбуждением колебаний атомов изменяется и скорость вращения всей молекулы. Поэтому спектр получается колебательно-вращательным.
Для получения спектров поглощения надо на вещество направить излучение, необходимое для возбуждения того или иного вида внутренней энергии. Возбуждение электронных спектров осуществляется ультрафиолетовым и видимым излучением, колебательные спектры требуют квантов ИК-излучения, вращательные - квантов микроволнового излучения или дальнего ИК-излучения. Волновые числа, соответствующие различным типам излучения приведены в табл.
Энергия излучения падает в ряду:
УФ ˃ видимое ˃ ИК ˃ микроволновое ˃ радиочастотное
Спектры поглощения получают, пропуская свет от источника, дающего сплошной спектр, через вещество, атомы которого находятся в невозбужденном состоянии.
Спектр поглощения - это совокупность частот, поглощаемых данным веществом. Согласно закону Кирхгофа, вещество поглощает те линии спектра, которые и испускает, являясь источником света.
Основной закон поглощения
Сущность: пучки монохроматического излучения проходят параллельно через пустую (или заполненную чистым растворителем) кювету сравнения и через кювету, заполненную исследуемым веществом или раствором в том же растворителе. Оба пучка попадают в приемник, где сравниваются по интенсивности I (прошедшего света) и I0 (падающего). Такой процесс повторяется при изменении длины волны (или частоты) во всем интервале измерения, в современных приборах автоматически регистрируется в виде спектра поглощения (раздать спектры).
Благодаря поглощению веществом энергии происходит уменьшениеинтенсивности света, прошедшего через раствор, которое характеризуется коэффициентом пропускания (или просто пропусканием):
T = I/Io.
Взятый с обратным знаком десятичный логарифм пропускания называется оптической плотностью (А):
-lgT = -lgI/Io = lg Io/I = A.
Оптическая плотность характеризует поглощательную способность вещества - светопоглощение.
При использовании монохроматического излучения количественная зависимость степени поглощения излучения от экспериментальных факторов достаточно хорошо описывается объединенным законом Бугера-Ламберта-Бера.
Закон: растворы одного и того же вещества при одинаковой концентрации этого вещества и толщине слоя раствора поглощают равное количество световой энергии.
Зависимость величины оптической плотности (экстинкции) от концентрации раствора и от числа поглощающих молекул (толщины оптического слоя раствора, толщины кюветы) определяется математическим выражением закона Бугера-Ламберта-Бера:
А = lgIo/I = Ксl,
где К – молярный коэффициент поглощения,
с – молярная концентрация вещества,
l – толщина слоя раствора
К (молярный коэффициент поглощения или экстинкции) равен оптической плотности раствора с концентрацией 1 моль/л и толщиной оптического слоя 1 см). Для раствора поглощающего вещества при постоянных концентрации и толщине поглощающего слоя величина А зависит от длины волны.
Бугер и Ламберт установили прямо пропорциональную связь между А и 1, а Бер — между А и с. Отметим, что при выводе этого закона не делалось никаких предположений ни о природе поглощающей среды, ни о характере поглощаемого излучения, поэтому закон универсален. Он справедлив не только для спектрофотометрии, но и для других абсорбционных спектроскопических методов (атомно-абсорбционных, ИК, рентгеновских). Поскольку связь между концентрацией и оптической плотностью (А) прямо пропорциональна, то из всех возможных величин, характеризующих светопоглощение, именно оптическую плотность удобнее всего использовать в спектрофотометрии в качестве аналитического сигнала.
Открытие спектрального анализа вызвало живой интерес даже у публики, далекой от науки, что по тем временам случалось весьма не часто. Как всегда в таких случаях, досужие любители отыскали множество других ученых, которые якобы все сделали задолго до Кирхгофа и Бунзена. В отличие от множества своих предшественников, Кирхгоф и Бунзен сразу же поняли значение своего открытия.
Они впервые отчетливо уяснили себе (и убедили в этом других), что спектральные линии - это характеристика атомов вещества.
После открытия Кирхгофа и Бунзена 18 августа 1868 г. французский астроном Пьер-Жюль-Сезар Жансен (1824-1907) во время солнечного затмения в Индии наблюдал в спектре солнечной короны желтую линию неизвестной природы. Два месяца спустя английский физик Джозеф Норманн Локьер (1836-1920) научился наблюдать корону Солнца не дожидаясь солнечных затмений и при этом обнаружил в ее спектре ту же желтую линию. Неизвестный элемент, который его испускал, он назвал гелием, т. е. солнечным элементом.
Оба ученых написали о своем открытии письма во Французскую академию наук, оба письма пришли одновременно и были зачитаны на заседании Академии 26 октября 1868 г. Такое совпадение поразило академиков, и они решили в честь этого события выбить памятную золотую медаль - с одной стороны профиль Жансена и Локьера, с другой - бог Апполон на колеснице и надпись: «Анализ солнечных протуберанцев».
На Земле гелий был открыт в 1895 г. Уильямом Рамзаем в минералах тория.
Исследования спектров испускания и поглощения позволяет установить качественный состав вещества. Количественное содержание элемента в соединении определяется путем измерения яркости спектральных линий.
При избирательном поглощении в электронных спектрах наблюдаются полосы с резко выраженными максимумами, каждый из которых связан с процессом перехода электрона с одной орбиты на другую внутри атома, или с переносом электрона с орбиты одного атома на орбиту другого внутри молекулы комплексного соединения. Важнейшие характеристики любого вещества - положения этих максимумов (полос) в электромагнитном спектре, а именно: значения энергии, частоты, длины волны в точке максимума. Они определяются только природой вещества и не зависят от его концентрации.
Метод определения качественного и количественного состава вещества по его спектру называется спектральным анализом. Зная длины волн, испускаемых различными парами, можно установить наличие тех или иных элементов вещества. Этот метод очень чувствительный. Можно обнаружить элемент, масса которого не превышает 10
10 г. Спектральный анализ сыграл большую роль в науке. С его помощью был изучен состав звезд.
Благодаря сравнительной простоте и универсальности, спектральный анализ является основным методом контроля состава вещества в металлургии и машиностроении. С помощью спектрального анализа определяют химический состав руд и минералов. Спектральный анализ можно проводить как по спектрам поглощения, так и по спектрам испускания. Состав сложных смесей анализируется по молекулярному спектру.
В общем случае, поглощение электромагнитного излучения атомом, молекулой или ионом вызывает переход с низшего энергетического уровня на высший. Следует помнить, что только определенные переходы являются разрешенными. Энергия поглощенного излучения соответствует энергетической разности между двумя уровнями. На рис. 5 показана обобщенная схема абсорбционного спектрометра, который используется для измерения поглощения электромагнитного излучения. «Источник» создает электромагнитное излучение, частоту которого можно варьировать в некотором интервале. Когда излучение проходит через образец, часть его поглощается, а часть пропускается, детектируется и записывается в виде спектра. Спектр представляет собой график зависимости поглощения или пропускания излучения от его частоты. Интенсивность поглощения «пропускание» зависит от нескольких факторов:
• вероятности наблюдаемого перехода;
• заселенности уровней;
• количества (концентрации) образца.
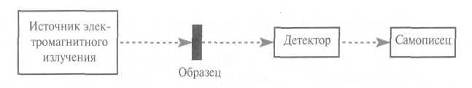
Рис. 5 – Обобщенная схема абсорбционного спектрометра
Излучение, прошедшее через образец, попадает на детектор и полученная информация выводится в виде спектра.
В спектрах поглощения измеряется частота и количество поглощенного излучения, т.е. удаленного из исходного излучения, в то время как в спектрах испускания измеряется излучение, испускаемое возбужденным состоянием частиц образца. В эмиссионном спектрофотометре образец подвергают возбуждению (термически, электрически или действием электромагнитного излучения) в короткоживущее высокоэнергетическое состояние. При обратном переходе на уровень с низкой энергией происходит испускание излучения. Спектр записывается как график зависимости интенсивности испускаемого излучения от частоты. Энергетическая разность между высоко- и низкоэнергетическим уровнями соответствует энергии испускаемого излучения. На рис. 6 показано, что из спектра можно получить информацию об интенсивности и частоте поглощения. Причем интенсивность можно измерять в единицах поглощения (а) или пропускания (б), а частоту можно пересчитать в величины энергии или длины волны.
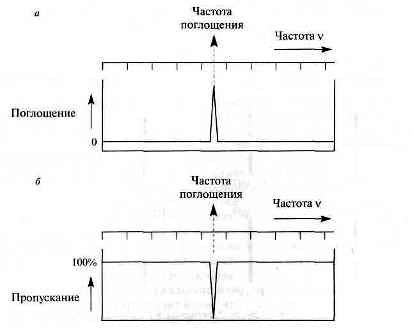
Рис. 6 – Схематическое изображение спектра поглощения, в котором наблюдается одна полоса
Для проведения эмиссионно-спектроскопического эксперимента важно определить достаточное время между исходным возбуждением и записью испускания. Если период между этими событиями слишком велик, то переход с высшего уровня на низший успеет закончиться, а если он слишком мал, эмиссия не успеет произойти.
Заключение
Применение методов аналитической химии в экспертной работе во многом способствует эффективному проведению следствия и судебного разбирательства. Среди инструментальных аналитических методов, применяющихся в криминалистической и судебно-медицинской экспертизе, большое распространение получили различные варианты спектрального анализа. Преимуществами спектральных методов являются достоверность, информативность, быстрота проведения анализа, возможность автоматизации измерений, наличие разнообразных методов математической обработки результатов.
Сегодня, наиболее совершенные спектрометры представляют собой единые модули с компьютерным управлением, оснащенные автоматической блокировкой лазера, имеют автоматические процедуры калибровки и широкий набор спектральных библиотек. Эти преимущества делают процедуру получения и использования спектров рутинным процессом.
Чтобы достичь более высокой чувствительности определения, воспроизводимости и точности, необходима обработка результатов измерения методами математической статистики.
При проведении спектрального анализа большую помощь оказывают таблицы, содержащие соответствующие физические постоянные и спектроскопические константы элементов и их наиболее важных соединений, а также таблицы для вспомогательных расчетов и рабочие инструкции, необходимые при качественных и количественных определениях.
Список использованной литературы:
Физико-химические методы анализа. Практическое руководство: Учеб. Пособие для вузов /В.Б. Алексовский, В.В. Бардин, М.И. Булатов ; под ред. В.Б. Алексовского – Л.: Химия, 1988. – 376 с.[4],[4.1]
Дроздов В.А., Кузнецов В.В., Рогатинская С.Л. Под общей редакцией Петрухина О.М. Введение в физико-химические методы анализа. М., Моск. хим. технол. ин-т им. Д.И. Менделеева, 1980.; 80 с.[3],[3.1]
Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. – М.: Химия, 1984. – 480 с.[5]
Методы анализа природных вод. Резников А.А., Муликовская Е.П., Соколов И.Ю. Изд. 3-е, перераб. и доп. М., изд-во «Недра», 1970, 488 с.[6]
Пономорев В.Д. Аналитическая химия в (двух частях).Учебник для фармац. и фак. мед. ин-тов. –М.: Высш. школа, 1982.198 с.[1],[1.1]
Васильев В.П. Аналитическая химия. В 2 ч. Ч. 2. Физико-химические методы анализа: Учеб. для химико-технол. спец. вузов. –М.: Высш. шк.,1989, – 384с.[2],[2.1],[2.2]
Тиходеев П. М., Световые измерения в светотехнике (Фотометрия), 2 изд., М.- Л., 1962.[7]
Львов Б. В., Атомно-абсорбционный спектральный анализ, М, 1966;
Зайдель А. Н., Основы спектрального анализа М., 1965,324с. С илл.;
|
|
|
 Скачать 154.42 Kb.
Скачать 154.42 Kb.


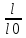 =lg
=lg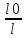 =A
=A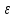 становится ясным, если принять
становится ясным, если принять 