курсовая1. курсовая Тихонова1. Введение Марганец
 Скачать 190.5 Kb. Скачать 190.5 Kb.
|
|
Содержание Введение……………………………………………………………………….…..3 1 Марганец………………………………………………………………………...5 1.1 Физико – химические свойства марганца…………………………………..5 1.2 Роль марганца в растениях…………………………………………………..9 1.2.1 Биохимические функции…………………………………………………...9 1.2.2 Недостаток (дефицит) марганца в растениях……………………………11 1.2.3 Избыток марганца в растениях…………………………………………...12 2 Береза…………………………………………………………………………...14 2.1 Применение березы………………………………………………………….14 2.2 Химический состав и свойства березы…………………………………….15 3 Методы ………………………………………………………………………...16 3.1 Пробоподготовка, разложение на СВЧ – минерализаторе «Минотавр – 2»………………………………………………………………………………….16 3.2 Атомно – абсорбционный спектрометр……………………………………20 Заключение Список использованных источников и литературы ВведениеАктуальность: Химические элементы, которые, входя в состав организмов растений, животных и человека, принимают участие в процессах обмена веществ и обладают выраженной биологической ролью, получили название биогенных элементов. К числу биоэлементов относятся: азот, водород, железо, йод, калий, кальций, кислород, кобальт, кремний, магний, марганец, медь, молибден, натрий, сера, стронций, углерод, фосфор, фтор, хлор, цинк. Основную массу живого вещества (99,4 %) составляют так называемые макроэлементы: О, С, Н, Са, N, К, Р, Мg, S, Cl, Na. К числу микроэлементов, содержание которых в организме исчисляется тысячными и даже триллионными долями процента, относятся: железо, кобальт, марганец, медь, молибден, цинк, кадмий, фтор, йод, селен, стронций, бериллий, литий и др. Микроэлементам, несмотря на их малое количественное содержание в организмах, принадлежит значительная биологическая роль. Помимо общего благоприятного влияния на процессы роста и развития, установлено специфическое воздействие ряда микроэлементов на важнейшие физиологические процессы – например, фотосинтез у растений. В настоящее время твердо установлена связь между микроэлементами и витаминами. Показано, что марганец необходим для образования в ряде растений витамина С (аскорбиновой кислоты), предохраняющего человека и некоторых животных от заболевания цингой. Есть данные, показывающие, что введением марганца можно вызвать образование аскорбиновой кислоты в организме тех видов животных, которые обычно неспособны к выработке этого витамина. Марганец, по – видимому, нужен и для действия витамина D (антирахитного) и B1 (антиневритного). Цель работы: Для достижения поставленной цели необходимо решить ряд задач: - изучить химические и физические свойства марганца; - изучить химический состав березы; - выявить биологическую роль марганца. Объект исследования: листья березы. Предмет исследования: марганец. 1 Физико-химические свойства маргнаца и его биологическая роль 1.1 Физико- химические свойства марганца Марганец – твердый, хрупкий металл, d-элемент VII группы периодической системы, с конфигурацией валентных электронов 3d54s2. В отличие от p-элементов, марганец образует химические связи за счет орбиталей как внешнего, так и предвнешнего квантовых слоев, за счет 3d -, 4s - и 4p - орбиталей. Для марганца характерны степени окисления +2, +4 и +7, что отвечает устойчивой не связывающей электронной конфигурации d5 или d3, а также d0. Существуют соединения марганца, в которых он проявляет степени окисления 0,+3, +5 и +6 [2]. На воздухе марганец окисляется, в результате чего его поверхность покрывается плотной оксидной пленкой, которая предохраняет металл от дальнейшего окисления. При прокаливании на воздухе выше 800° C марганец покрывается окалиной, состоящей из внешнего слоя Mn3O4 и внутреннего слоя состава MnO. Марганец образует несколько оксидов: MnO, Mn3O4, Mn2O3, MnO2 и Mn2O7. Все они, кроме Mn2O7, представляющего собой при комнатной температуре маслянистую зеленую жидкость с температурой плавления 5,9° C, твердые кристаллические вещества. Химически марганец достаточно активен, при нагревании энергично взаимодействует с неметаллами – кислородом (образуется смесь оксидов марганца разной валентности), азотом, серой, углеродом, фосфором и другими. При комнатной температуре марганец на воздухе не изменяется, очень медленно реагирует с водой. В кислотах (соляной, разбавленной серной) легко растворяется, образуя соли двухвалентного марганца. При нагревании в вакууме марганец легко испаряется даже из сплавов [11]. В соединениях марганец обычно проявляет валентность от 2 до 7 (наиболее устойчивы степени окисления +2, +4 и +7). С увеличением степени окисления возрастают окислительные и кислотные свойства соединений марганца. Соединения Mn+2 – восстановители. Оксид MnO – порошок серо-зеленого цвета; обладает основными свойствами, нерастворим в воде и щелочах, хорошо растворим в кислотах. Гидрооксид Mn(OH)3 – белое вещество, нерастворимое в воде. Соединения Mn+4 могут выступать и как окислители (1) и как восстановители (2) [6]: MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (1) MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O (сплавление) (2) Хлорид марганца (II) – в безводном состоянии представляет собой листочки светло – розового света и получается при обработке марганца, его оксида или карбоната сухим хлороводородом (3): MnCO3 + 2HCl = MnCl2 + CO2 + H2O (3) Сульфат марганца (II) – в безводном состоянии практически не имеющий цвета порошок, горький на вкус и получающийся при дегидратации соответствующих кристаллогидратов (MnSO4 · nH2O, где n = 1, 4, 5, 7). Гептагидрат сульфата марганца иногда встречается в природе в виде минерала миллардита и устойчив при температуре ниже 9° C. При комнатной температуре устойчив MnSO4 · 5H2O, называемый марганцевым купоросом. В промышленности сульфат марганца получают растворением пиролюзита в горячей концентрированной серной кислоте (4): 2MnO2 + 2H2SO4 = 2MnSO4 + O2 + 2H2O (4) Cоли двухвалентного марганца каталитически действуют на протекание некоторых окислительных процессов, особенно происходящих под действием атмосферного кислорода, на этом основано их применение в качестве веществ, которые будучи растворенными в льняном масле, ускоряют его окисление кислородом воздуха и, тем самым, способствуют более быстрому высыханию [12]. Из соединений марганца (IV) наибольшее значение имеет диоксид марганца, который является важнейшим минералом марганца. Различают несколько форм природного диоксида марганца: пиролюзит, рамсделит, псиломелан и криптомелан. Диоксид марганца в лаборатории можно получить прокаливанием на воздухе нитрата марганца (5): Mn(NO3)2 = MnO2 + 2NO2 (5) Диоксид марганца представляет собой черный порошок амфотерного характера, проявляющий как окислительные, так и восстановительные свойства. Диоксид марганца, введенный в состав стекла, уничтожает зеленую окраску, обусловленную силикатом железа и придает стеклу розовый цвет (или черный, если MnO2 добавлено много). Тонкодисперсный порошок диоксида марганца обладает адсорбирующими свойствами: поглощает хлор, соли бария, радия и некоторых других металлов [17]. Несмотря на огромную значимость пиролюзита, в быту гораздо чаще приходится встречаться с веществом, в котором марганец семивалентен, – перманганатом калия («марганцовкой»), получившим распространение благодаря его ярко выраженным антисептическим свойствам. Сейчас перманганат калия получают электролитическим окислением растворов манганата (VI) калия. Это соединение представляет собой кристаллы пурпурно-красного цвета, устойчивые на воздухе и умеренно растворимые в воде. Однако его растворы в воде быстро разлагаются на свету и медленно в темноте с выделением кислорода. Перманганат калия – сильный окислитель [18]. Оксид марганца (VII) Mn2O7 – марганцевый ангидрид представляет собой зелено-бурое тяжелое масло, получающееся при действии концентрированной серной кислоты на твердый перманганат калия (6): 2KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O (6) Это вещество – чрезвычайно сильный окислитель, взрывается при ударе или нагревании. Многие вещества, такие как сера, фосфор, древесная стружка, спирт, при малейшем соприкосновении с ним воспламеняются. При растворении в большом количестве воды образует марганцевую кислоту. 1.2 Роль марганца в растениях Биохимические функции марганца. Марганец поглощается растениями и распределяется по их органам в результате метаболических процессов. Имеет место и пассивная адсорбция, особенно при высоких и токсичных уровнях его содержания в растворе. Марганец отличается высокой степенью активности поглощения и быстрым переносом в растениях. В растительных жидкостях и экстрактах он присутствует в виде свободных катионных форм и транспортируется в растениях в виде Mn2+, но во флоэмных экссудатах обнаруживаются комплексные соединения марганца с органическими молекулами. Более низкая концентрация марганца во флоэмном экссудате по сравнению с листовой тканью и слабое перемещение элемента во флоэмных сосудах становится причиной низкого содержания марганца в семенах, фруктах и корнеплодах [1]. Марганец переносится в основном в меристематических тканях, и его значительные концентрации обнаруживаются в молодых органах растений. Марганец нужен всем растениям без исключения. Одна из наиболее важных его функций – участие в окислительно-восстановительных реакциях (ОВР). Mn2+ является компонентом двух ферментов: фосфотрансферазы и аргиназы. Кроме того, он может замещать в других ферментах магний и повышает активность некоторых оксидаз. Последнее происходит, вероятно, вследствие изменения валентности марганца [9]. Марганец активно участвует в процессе фотосинтеза, а именно, в его кислородообразующей системе, и играет основную роль в переносе электронов. Слабо связанная в хлоропластах форма марганца участвует непосредственно в выделении кислорода, а прочно связанная форма – в переносе электронов. Роль марганца в восстановлении NO2 не вполне прояснена. Однако, существует косвенная связь между активностью описываемого элемента и ассимиляцией азота растениями. Число истинных марганецсодержащих ферментов ограничено. На сегодняшний день известно более 35 ферментов, активируемых марганцем. Большинство из них являются катализаторами (ОВР), декарбоксилирования, гидролиза. Марганец активирует некоторые ферменты, катализирующие превращение шикимовой кислоты, биосинтез ароматических аминокислот (тирозин) и прочих вторичных продуктов (лигнина, флавоноидов) [3]. Марганцевозависимые ферменты принимают участие в биосинтезе каротиноидов и стеролов. Ионы марганца активно влияют на структуру и функции хроматина. Марганец оказывает влияние на увеличение содержания негистоновых белков и РНК в диффузной фракции хроматина. Марганец остро необходим для репликации и функционирования ДНК - и РНК -полимераз. Недостаток марганца в растениях и его последствия. Симптомы недостатка марганца чаще всего наблюдаются на карбонатных и кислых известкованных почвах. Критическая минимальная концентрация данного элемента в зрелых листьях варьирует от 10 до 25 мг/кг сухой массы. В условиях недостатка марганца в первую очередь снижается продуцирование фотосинтетического кислорода. Между тем, содержание хлорофилла и сухой массы листа меняется незначительно, но изменяется структура мембран тилакоидов [14]. При жестком дефиците марганца значительно снижается содержание хлорофилла в листьях, содержание липидов в хлоропластах тоже уменьшается. Нарушение системы фотосинтеза приводит к резкому уменьшению содержания углеводов в растении, особенно в корневой части. Это является ключевым фактором замедления роста корневой системы в условиях дефицита марганца. При недостатке марганца содержание белка в растениях почти не изменяется, одновременно увеличивается содержание растворимых форм азота [9]. Визуально симптомы недостатка марганца у различных видов растений несколько отличаются. Так, у двудольных это межжилковый хлороз, у трав – зеленовато-серые пятна на базальных листочках (серая пятнистость), у свеклы – темно-красный цвет листовой пластинки с пораженными бурыми участками. При остром недостатке марганца может наблюдаться полное отсутствие плодоношения у капусты, редиса, гороха, томата и других культур. Марганец способствует ускорению общего развития растений. Избыток марганца в растениях и его последствия. Переизбыток марганца приводит к угнетению и даже гибели растений. Ядовитость данного элемента ярче всего проявляется на кислых дерново-подзолистых почвах, особенно при повышенной влажности, образовании корки и внесении физиологически кислых удобрений без их нейтрализации. Подвижные формы алюминия и железа усиливают вредоносность марганца. Избыток марганца вызывает отмирание терминальных почек и усиливает рост боковых побегов. На поверхности листьев появляются коричневые пятна (MnO2), окруженные светло-зелеными или желтыми участками тканей. Предполагают, что осаждение марганца в листьях подвержено ферментативному регулированию [8]. Общие симптомы избытка марганца: угнетение роста, гибель растений. Так в огурцах при избытке марганца молодые жилки листа желтеют, с обратной стороны на жилках – темные точки фиолетового оттенка; такими же точками покрываются черешки листа и побеги; При усилении избытка элемента лист желтеет, жилки – темно - фиолетовые; На плодах темно - фиолетовые пятна; Томат. Рост приостанавливается; Молодые листья мельчают; На листьях раннего возраста – хлороз. На старых – некротические пятна и коричневые жилки. Картофель. Рост нарушается; Ткани растений отмирают; На стеблях растений появляются продолговатые полосы коричневого цвета; На нижних листьях – хлороз, позднее ткани отмирают, приобретают коричневый цвет, а пятна распространяются между жилками листовой пластинки; Пораженные листья опадают, а пятнистость продвигается вверх; Черешки и стебли водянистые и ломкие; Преждевременное засыхание ботвы; Снижение урожайности. Свекла. Листья темно-зеленые; Рост угнетенный; Мраморность листьев; Желтоватые округлые пятна 2 Объект и методы исследования Морфологическое описание березы обыкновенной Берёза (Bеtula) –род листопадных деревьев и кустарников семейства Берёзовые (Betulaceae). Берёза широко распространена в Северном полушарии; на территории России принадлежит к числу наиболее распространённых древесных пород. Общее число видов – около ста или немного больше. Многие виды берёзы – широко распространённые и важнейшие лесообразующие породы, в значительной мере определяющие облик и видовой состав лиственных и хвойно-лиственных (смешанных) лесов в умеренной и холодной части Евразии и Северной Америки. Большинство видов берёз – деревья высотой до 30 и даже 45 м, с обхватом ствола до 120-150 см, некоторые виды – кустарники от крупных до мелких, вплоть до стелющихся, едва приподнимающихся над землёй. Все представители рода – однодомные раздельнополые ветроопыляемые (анемофильные) растения. Корневая система берёз мощная, в зависимости от вида и условий произрастания либо поверхностная, либо, что чаще, уходит косо вглубь. Стержневой корень проростка отмирает очень быстро, зато боковые корни развиваются мощно и богаты тонкими мочковидными корешками. Берёза растёт медленно только в первые годы. Потом, наоборот, начинает расти быстро, и это обеспечивает ей победу над конкурирующей травянистой растительностью. Кора у большей части берёз белая, желтоватая, розоватая или красновато-бурая, у некоторых видов серая, коричневая или даже чёрная. Полости клеток пробковой ткани на стволах заполнены белым смолистым веществом – бетулином, который придаёт коре белую окраску. Внешняя част – берёста – обычно легко отслаивается лентами. У старых деревьев нижняя часть ствола нередко покрывается тёмной коркой с глубокими трещинами. Листья берёзы очерёдные, цельные, по краю зубчатые, яйцевидно-ромбические или треугольно-яйцевидные, моносимметричные, с широким клиновидным основанием или почти усечённые, гладкие, до 7 см длиной и 4 см шириной, перед опаданием желтеют. Молодые листья клейкие. Жилкование листовой пластинки совершенное перисто-нервное (перисто-краебежное): боковые жилки оканчиваются в зубцах. Почки попеременные, сидячие, покрытые спирально расположенными, часто клейкими чешуйками; боковые почки немного отстоящие. Мужские цветки в сложных соцветиях – серёжковидных тирсах – появляются ещё летом на вершинах удлинённых побегов, обычно по 2-3; сначала они стоячие и зелёного цвета, затем постепенно буреют. Их длина 2-4 см. Мужские серёжки состоят из многочисленных сросшихся с центральным цветочным стержнем щитовидных стебельчатых покровных чешуек, расширенных к вершине, снабжённых снизу двумя меньшими чешуйками и содержащих с внутренней стороны 3 цветка. Каждый цветок покрыт также чешуевидным околоцветником, в котором помещаются органыоплодотворения – тычинки. Снаружи вся серёжка покрыта непроницаемым для влаги смолистым веществом. В таком виде серёжки зимуют. Весной, в марте – мае (в зависимости от климата) стержень мужской серёжки удлиняется, вследствие чего окружающие цветок чешуйки раскрываются, и между ними становятся заметными жёлтые тычинки, обильно выделяющие цветочную пыльцу. В это время серёжки, стоявшие раньше прямо, сперва наклоняются, а затем и вовсе повисают. Женские серёжки вырастают на вершинах укороченных побегов (брахибластов), развивающихся из боковых почек прошлогодних побегов, и поэтому сидят всегда на боку ветки. Одновременно с зацветанием мужских серёжек распускаются листовые почки и женские серёжки. Во время цветения они всегда короче и уже мужских, которые после опыления сразу же опадают. Прицветные (плодовые) чешуйки женских серёжек глубоко трёхлопастные; боковые лопасти обычно короче средней. Женские цветки (то есть одна лишь завязь) сидят по три под каждой прицветной чешуйкой; в каждой завязи по две висячих семяпочки, из которых по опылении одна засыхает, а вторая разрастается, занимая всю полость завязи. Женская оплодотворённая серёжка в это время удлиняется, нередко у неё вырастает ножка, а самая она утолщается вследствие увеличения объёма чешуек, превращаясь постепенно в овальную или продолговато-цилиндрическую «шишку». После созревания плодов, которое происходит довольно скоро – в зависимости от климата, в июле – сентябре – плодовая серёжка (шишка) осыпается и от неё остаётся лишь стержень. Плод – сплюснутый чечевицеобразный орешек, несущий на вершине два засохших столбика и окружённый более или менее широким тонкокожим перепончатым крылышком. Плоды сидят по три в пазухах трёхлопастных плодовых (прицветных) чешуек. Семена очень лёгкие – в одном грамме насчитывается 5000 семян. Легко разносятся ветром (на расстояние до 100 м от материнского растения), плоды не вскрываются. Распространена береза практически на всей территории России. Растет и на сухих, и на влажных почвах различного химического и механического составов. Береза очень светолюбива, не любит темные места. Цветет береза с конца апреля по май, а процесс плодоношения происходит в июле и августе. Длительность жизни березы составляет примерно 100-120 лет [7]. В медицинских целях применяются почки, молодые листья, сок березовый, кора, деготь, уголь. Почки следует собирать ранней весной, когда они набухли, но ещё не распустились. Листья собирать следует только в мае, когда происходит цветение березы, когда они душистые и клейкие. Сушить необходимо на открытом воздухе обязательно в тени, срок, в течение которого их нужно использовать, составляет 2 года. Сок березы заготавливать нужно только с тех деревьев, которые подлежат вырубке, любые способы нарушения коры вредят березе. Деготь и уголь получают из древесины. Также используется ещё и прополис – вещество, которое получают пчелы, перерабатывая выделения почек березы [7]. 2.1 Химический состав тканей березы и ее применение Химический состав березы (почки, листья, сок, кора, прополис): эфирное масло (содержащее сесквитерпеновый спирт бетулол, пальмитиновую кислоту), алкалоиды, флавоноиды (апигерин, изорамнетин), смолы, дубильные вещества, воск, кумарины, витамины (большинство), макро и микроэлементы (бор, свинец, стронций, никель, селен, ванадий, барий, алюминий, хром, кобальт, цинк, медь, марганец, кальций, калий, магний, железо). Это отличное витаминное средство, содержащее к тому же очень много полезных микроэлементов [19]. Береза обладает широким спектром свойств: противовоспалительным, противомикробным, спазмолитическим, сосудорасширяющим, антигипоксантным, желчегонным. Так же береза обладает вяжущим, обволакивающим, отхаркивающим, секретолитическим, седативным, репаративным, мочегонным (под влиянием настоя из листьев значительно возрастает мочеотделение (с 400 мл до 2,5 л), исчезают отеки, уменьшается одышка), обезболивающим, общеукрепляющим, жаропонижающим, потогонным, противопаразитарным, противогрибковым свойствами. Листья березы применяются при: цинге, анемиях, неврозах, ушибах, пиелонефрите, экземах, печеночных заболеваниях и болезнях мочевого пузыря, камнях в выделительной системе, ревматизме, подагре, склерозе сосудов, воспалении дыхательных путей (верхних и нижних), ранениях, язвенной болезни, ожогах, дерматозах, выпадении волос [19]. В сборах совместно с другими растениями, береза (а именно листья) используется при всех заболеваниях, где возможно проведение фитотерапии. Это благодаря огромному количеству полезных свойств и отсутствию противопоказаний. Даже если при фитотерапии какой-то патологии в сборе не будет березы, то можно смело добавить её листья – сделаете только лучше. 2.3 Методы исследования Пробоподготовка. Сущность метода разложения на СВЧ-минерализаторе «Минотавр 2». Минерализатор предназначен для разрушения органических веществ в природных, питьевых и сточных водах, биологических объектах и пищевых продуктах при проведении физико-химического анализа на загрязняющие примеси тяжелых металлов любыми методами. СВЧ-минерализатор применяется для экологического контроля объектов окружающей среды, санитарного контроля и контроля технологических процессов. Кроме минерализации, выпаривания и концентрирования «МИНОТАВР – 2» может применяться для гидролиза, экстракции с использованием полярных и неполярных органических растворителей (с приставками для фильтрации и упаривания), СВЧ - сушки и СВЧ – синтеза [20]. Отличительные особенности системы пробоподготовки «МИНОТАВР - 2»: быстрая и эффективная минерализация сточных вод, пищевых продуктов, кормов, биологических объектов, фармацевтических препаратов; автоматическое выпаривание; сокращение расхода реагентов; улучшение воспроизводимости; минимизация потерь пробы; исключение потерь летучих элементов (селен, мышьяк, ртуть); методическое сопровождение; автоматический контроль параметров реакции и стравливание избыточного давления гарантируют безопасность персонала лаборатории; несколько режимов программно - управляемой регулировки мощности магнетрона во времени; точный и надежный контроль мощности, температуры и давления во времени; возможность управления компьютером или пультом; удобный пользовательский интерфейс; возможность работать независимо или в составе комплекса из нескольких приборов с единым управлением; полная безопасность. Системы управления давлением и автоматического выпаривания жидкостей, а также модульность минерализатора расширяют его методические возможности[20]. Управление давлением. При нагревании в процессе пробоподготовки окислительные реагенты вступают в реакцию с органической матрицей пробы, образуя углекислый газ и оксиды азота. Бурное газовыделение в начале процесса минерализации затрудняет дальнейшее озоление в закрытых контейнерах. Повышение давления заставляет отключать нагрев, при этом температура и скорость минерализации падают. Кроме того, закрытый контейнер может удержать только ограниченную массу газов, а это ограничивает и массу навески (например, навеска пробы, содержащей углеводы, в большинстве подобных систем составляет десятые доли грамма). В минерализаторе «МИНОТАВР –2» установлен блок управления давлением, который фиксирует повышенное газовыделение и выдает команды на отключение нагрева и удаление газов. Автоматический сброс давления занимает несколько секунд, после чего минерализация опять проходит с максимальной скоростью [20]. Потери пробы при сбросе давления исключены благодаря подобранным условиям минерализации (масса навески, объем окислительных реагентов, величина рабочего давления) и медленному стравливанию газов. Наличие блока управления давлением позволяет увеличить навеску пробы. Допустимая навеска до 2 грамм значительно сокращает требования к чувствительности метода анализа, улучшает представительность пробы и воспроизводимость результатов. При этом полнота минерализации позволяет подготовить пробу к анализу не только атомно-абсорбционными и атомно-эмисионными методами (в которых при атомизации пробы происходит дополнительное озоление), но и для фотометрического и люминесцентного анализов. Автоматическое выпаривание. Выпаривание жидкостей необходимо для подготовки жидких проб и для удаления излишков кислот по окончании минерализации (в тех случаях, когда величина pH среды значима для дальнейшего хода анализа). Во избежании потери элементов из-за пересушивания пробы объем остатка жидкости в приборе при выпаривании постоянно контролируется. Когда остаток достигает заданного значения, прибор автоматически отключает нагрев. Для некоторых растворов с повышенным содержанием солей возможно доведение пробы до сухого остатка. Проведение выпаривания и минерализации в одном контейнере исключает потери при переносе пробы. Процедура работы. Управление прибором осуществляется автоматически по заданной оператором программе, либо по стандартным программам, записанным в память прибора. Твердые пробы. Навеску объекта помещают в контейнер для минерализации, добавляют окислительные реагенты согласно методическим указаниям, контейнер переносят в экстрактор СВЧ – минерализатора и закрывают крышкой. Затем переводят пробу в раствор при атмосферном давлении и проводят разложение органических веществ под давлением 8 атм. После разложения удаляют излишки окислительных реагентов, минерализат доводят до нужного объема и анализируют. Для методов, предъявляющих высокие требования к полноте озоления, разложение под давлением можно провести повторно. Жидкие пробы. Аликвотную часть пробы помещают в контейнер для минерализации, контейнер переносят в экстрактор СВЧ – минерализатора и закрывают крышкой. Затем проводят выпаривание, добавляют окислительные реагенты согласно методическим указаниям, и осуществляют разложение под давлением. После разложения проводят выпаривание излишков окислительных реагентов, минерализат доводят до нужного объема и анализируют. Пробоподготовка листьев березы: 1. 2. 3. Атомно – абсорбционный спектрометрия. Атомно-абсорбционная спектрометрия (ААС) – распространенный в аналитической химии инструментальный метод количественного элементного анализа по атомным спектрам поглощения (абсорбции) для определения содержания металлов в растворах их солей: в природных и сточных водах, в растворах – минерализатах, технологических и прочих растворах. Приборы для атомно-абсорбционного анализа – атомно-абсорбционные спектрометры. Они представляют собой прецизионные высокоавтоматизированные устройства, которые обеспечивают воспроизводимость условий измерений, автоматическое введение проб и регистрацию результатов измерения [10]. Основными элементами данного устройства являются: источник света, излучающий характерную узкую спектральную линию анализируемого вещества; атомизатор для перевода данного вещества в атомный пар; спектральный прибор для выделения характерной аналитической линии вещества и электронная система, необходимая для детектирования, усиления и обработки аналитического сигнала поглощения [13]. Существует несколько видов источников света. Наиболее часто применяют лампы с полым катодом, безэлектродные лампы и настраивающиеся лазеры [15]. Лампа с полым катодом состоит из полого катода цилиндрической формы, рядом с которым находится вольфрамовая проволока – анод. Сама лампа представляет собой цилиндрический стеклянный баллон, который наполнен инертным газом. Катод лампы изготовлен из определяемого в ходе анализа элемента или его сплава. Свет необходимой длины волны, поглощаемый в атомизаторе атомами определяемого элемента, в результате излучается [4]. Внутри безэлектродной лампы с помощью катушки, по которой проходит ток высокой частоты, создается сильное электромагнитное поле. В это поле помещается маленькая кварцевая ампула, содержащая летучее соединение определяемого вещества. Принцип действия аналогичен принципу лампы с полым катодом. Основной недостаток такого вида источника света – необходимость в дополнительном устройстве для питания – высокочастотном генераторе [15]. Настраивающиеся лазеры в качестве источников излучения стали применять с 1974 года. Их применение позволяет обойтись без большого набора ламп, так как один такой лазер можно использовать для всех элементов, однако широкому его использованию препятствует дороговизна. Атомно-абсорбционный метод анализа основан на поглощении излучения оптического диапазона свободными атомами. В связи с тем, что в оптическом диапазоне, соответствующем энергиям валентных электронов, свободные атомы и многоатомные частицы дают различные спектры. Поэтому важнейшей предпосылкой АА определений является перевод определяемого вещества в атомный пар. Для этого используется источник высокой температуры – атомизатор[5]. Существуют два основных метода атомизации, широко применяемых на практике: пламенный электротермический (непламенный). Пламенная атомизация характеризуется тем, что источником высокой температуры служит пламя. Атомизатор представляет собой горелку, в которую непрерывно подаются горючие газы в смеси с окислителями. В атомизатор с помощью форсунки - распылителя подается анализируемый раствор. Наиболее распространенными в атомной абсорбции являются следующие составы смесей: светильный газ – воздух: пламя с температурой в интервале 1500 – 1800° С; ацетилен – воздух: пламя с температурой до 2200-2300° С (зависит от соотношения потоков ацетилен – воздух); ацетилен – закись азота: высокотемпературное пламя (до 2900° С). Воздушно-ацетиленовое пламя применяют для определения щелочных и щелочноземельных металлов, а также Cr, Fe, Со, Ni, Mg, Mo, Sr и благородных металлов. Такое пламя обладает высокой прозрачностью в области длин волн более 200 нм, слабой собственной эмиссией и обеспечивает высокую эффективность атомизации более 30 элементов. Частично ионизируются в нём только щелочные металлы. Пламя ацетилена и оксида азота (I) имеет гораздо бо́льшую температуру, так как закись азота является термодинамически неустойчивым соединением. В пламени оно быстро распадается, высвобождая значительную дополнительную энергию, в то время как при сгорании воздушно - ацетиленовой смеси часть тепла расходуется на нагрев азота до температуры пламени. Пламя ацетилена и N2O отличается высокой прозрачностью во всем интервале длин волн, используемых в атомно - абсорбционном анализе (190 – 850 нм). Основными его недостатками являются сильное собственное свечение и высокая степень ионизации ряда элементов. Эти два вида пламени совместно позволяют определить около 70 элементов, когда другие типы газовых смесей имеют более узкое применение. Например, воздушно-пропановое пламя используется, как правило, только для определения щелочных металлов, Cd, Cu, Ag и Zn [16].. Метод электротермической атомизации характеризуется тем, что атомизатором служит графитовая печь (трубка, длиной 50 мм и внутренним диаметром 4-5 мм), которая нагревается электрическим током большой силы. Анализируемое вещество вводится на торец графитового электрода, который после высушивания нанесенной капли подается в предварительно нагретую графитовую печь через коническое отверстие в её стенке. В момент соприкосновения электрода с трубкой происходит дополнительный разогрев электрода мощным дуговым разрядом, зажигаемым между внешним концом введенного в печь электрода с пробой и вспомогательным электродом. В итоге внутри печи происходит эффективная атомизация вещества. Для того, чтобы предотвратить быстрое выгорание графита, трубку помещают в атмосферу инертного газа (аргона высокой чистоты) [5, 16]. Атомно-абсорбционная спектрометрия наиболее широко разработана для работы с жидкими веществами. Исходя из этого, для проведения анализа выполняют следующие операции [13]: Проводят пробоотбор (отбирают часть вещества от объекта анализа, которая максимально полно отражает его химический состав). От твердой пробы отбирают определенную навеску, растворяют её в подходящих растворителях с целью перевода изучаемого элемента в раствор. От жидкой пробы отбирают фиксированную аликвоту и подготавливают рабочий раствор для анализа по тем же принципам. Готовят серию рабочих градуировочных растворов, охватывающих необходимый диапазон градуировочного графика. Подготавливают к работе атомно-абсорбционный спектрометр для регистрации сигнала в оптимальных условиях абсорбции изучаемого элемента. Вводят анализируемое вещество в атомизатор, создают поглощающий слой атомного пара и производят измерение аналитического сигнала. Последовательно вводя в атомизатор градуировочные растворы, получают градуировочную характеристику (функциональную зависимость между аналитическим сигналом и концентрацией элемента в градуировочном растворе). С её использованием определяют концентрацию изучаемого элемента в растворе пробы и в исходной пробе. 3 Содержание марганца в листьях березы г. Горно-Алтайска 3.1 Марганец в объектах окружающей среды 3.2 Содержание марганца в листьях березы г. Горно-Алтайска На содержание марганца были отобраны образцы листьев березы повислой и белой с разных районов г. Горно-Алтайска (район университета, Бочкаревки, Каяса). Среднее содержание марганца в листьях березы г. Горно-Алтайска составляет – 140,60 мг/кг, что находится в пределах допустимых концентраций (ПДК – 300 мг/кг). Содержание марганца было определено в разных видах березы. Результаты исследований показали, что среднее содержание марганца в листьях Безеры повислой () в 4 раза больше, чем Березы белой () (таблица 1). Этот факт требует дальнейшего и детального изучения. Значительное отличие концентраций марганца в листьях этих видов березы наблюдается по всем точкам исследования (таблица 2, рисунок 1). Таблица 1 – Содержание марганца в листьях разных видов березы г. Горно-Алтайска, мг/кг
Таблица 2 – Содержание марганца в листьях разных видов березы, произрастающих в разных районах г. Горно-Алтайска, мг/кг
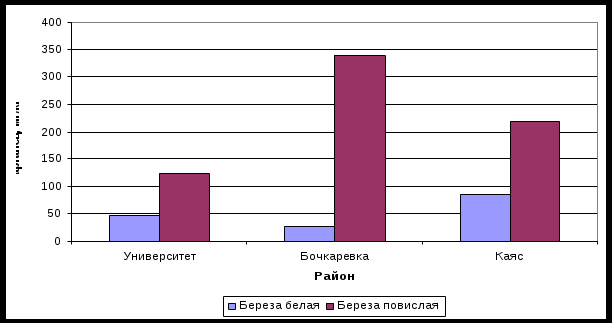 Рисунок .. – Содержание марганца в листьях березы г. Горно-Алтайска Выводы: 1. Марганец это микроэлемент. 2. Содержание марганца в листьях березы г. ггг ниже фоновых концентраций и составляет в среднем по всем изученным образцам – 140,60 мг/кг. Содержание марганца в листьях березы повислой выше его содержания в листьях березы белой. Объяснение данного факта, требует детального изучения. Список использованных источников и литературы: 1. Алексеев, Ю. В. Тяжёлые металлы в почвах и растениях / Ю.В. Алексеев. – Л.: Агропромиздат, 1987. – 170 с. 2. Ахметов, Н. С. Общая и неорганическая химия / Н. С. Ахметов. - М.: Высшая школа, 1989. – 278 с. 3. Битюцкий, Н. П. Микроэлементы и растение. Учебное пособие / Н. П.Битюцкий. – СПб.: Издательство Санкт-петербургского университета, 1999. – 232 с. 4. Брицке, М. Э. Атомно-абсорбционный спектрохимический анализ / М. Э. Брицке. – М.: Химия, 1982. – 224 с. 5. Гармаш, А. В. Введение в спектроскопические методы анализа. Оптические методы анализа / А. В. Гармаш. – М.: ВХК РАН, 1995. – 38 с. 6. Глинка, Н.Л. Общая химия : учебное пособие / Н.Л. Глинка. – Изд. стер. – М.: КНОРУС, 2012. – 642 – 644 с. 7. Ботаника. Энциклопедия «Все растения мира»: Пер. с англ. = Botanica / ред. Д. Григорьев и др. – М.: Könemann, 2006 (русское издание). – 142 – 144 с. 8. Добролюбский, О.К. Микроэлементы и жизнь / О.К. Добролюбский. – М.: Мол. Гвардия, 1956. – 94 – 97 с. 9. Дробков, А.А. Микроэлементы и естественные радиоактивные элементы в жизни растений и животных / А.А. Дробков. – М.: АН СССР, 1958. – 146 с. 10. Кнунянц, И. Л. Химическая энциклопедия / И. Л. Кнунянц. – М.: Советская энциклопедия, 1988. – Т. 1. – 623 с. 11. Коттон, Ф., Уилкинсон, Дж. Основы неорганической химии / Ф. Коттон, Дж. Уилкинсон. – М.: Мир, 1979 – 423 с. 12. Некрасов, Б. В. Учебник общей химии / Б. В. Некрасов. – М.: Химия, 1981. – 326 – 328 с. 13. Пупышев, А. А. Атомно-абсорбционный спектральный анализ /А. А. Пупышев. – М.: Техносфера, 2009. – 784 с. 14. Стайлс, В. Микроэлементы в жизни растений и животных / В. Стайлс. – М.: Изд-во иностр. лит.,1949. – 123 с. 15. Хавезов, И., Цалев, Д. Атомно - абсорбционный анализ / И. Хавезов, Д. Цалев. – Л.: Химия, 1983. – 144 с. 16. Чегринцев, С. Н. Атомно - абсорбционный анализ / С. Н. Чергинцев. – Томск: Изд-во ТПУ, 2014. – 44 с. 17. Шилов, Ю.М. Общая химия / Ю.М. Шилов, Ю.И. Смушкевич, П.М. Чукуров, М.И.Тарасенко. – М.: Медицина, 1983. – 278 с. 18. Шульпин, Г.Б. Химия для всех / Г.Б. Шульпин. – М.: Знание, 1987. – 98 с. 19. Энциклопедический словарь лекарственных растений и продуктов животного происхождения / Под ред. Г.П. Яковлева и К.Ф. Блиновой. – 2-е изд., испр. и доп. – СПб.: СпецЛит, 2002. – 80 – 81 с. 20. [Электронныйресурс], – http://www.lumex.ru/catalog/minotavr-2.php (Дата обращения 12.03.2017 г.) |
