иНФО. Инфо. Введение. Окружающая среда и ее объекты
 Скачать 44.18 Kb. Скачать 44.18 Kb.
|
|
Ход работы Цветность можно определять визуально. Для этого в колориметрический цилиндр наливают 100 мл профильтрованной исследуемой воды, после чего просматривая окраску контрольных растворов сверху вниз, находят цилиндр, окраска жидкости в котором совпадает с окраской воды в цилиндре с исследуемой водой. Цветность можно более точно определить на фотоколориметре. Для этого строят градуированный график по хромово-кобальтовой шкале цветности. Растворы с различной цветностью фотометрируют в кювете на 5 см в синей части спектра относительно профильтрованной дистиллированной воды. При цветности выше 35 °С водопотребление ограничивают. Задание 6. Определение вкусов и привкусов Определяются в баллах. Без привкусов называется такая вода, привкусы которой не превышают 2 баллов. Определение ведется с заведомо безопасной водой при 20°С. Воду набирают в рот малыми порциями, не проглатывая. Отмечают наличие вкуса (соленый, горький, кислый, сладкий) или привкуса (щелочной, железистый, металлический, вяжущий и т. д.) и их интенсивность в баллах по шкале, аналогично определению интенсивности запаха. При интенсивности запахов и привкусов выше 2 баллов ограничивается водопотребление, т.к. сильные запахи и привкусы могут быть показателями загрязнения воды загрязненными сточными водами или свидетельствуют о наличии биологически активных веществ, выделяемых сине-зелеными водорослями. Лабораторная работа № 2 Качественное определение основных ионов в природных водах Цель работы: Изучение качественных реакций на ионы, наиболее распространенные в природных водах. Задание 1. Качественные реакции на ионы а) Обнаружение ионов калия. Выполнение работы. Взаимодействие с гексанитрокобальтатом (III) натрия Na3[Co(NО2)6]. В пробирку с 5-6 каплями раствора KCl или KNO3 добавить 3-4 капли раствора Na3[Co(NО2)6]. Выпадает желтый кристаллический осадок К2Na[Co(NО2)6]. Запишите уравнение реакции. б) Обнаружение ионов магния. Капельная реакция Н.А. Тананаева. Поместите на фильтровальную бумагу каплю раствора фенолфталеина, каплю нейтрального раствора хлорида магния и каплю раствора аммиака. При этом появляется красное пятно, обусловленное щелочностью аммиачного раствора и образующегося гидроксида магния. При подсушивании мокрого пятна над пламенем спиртовки избыток аммиака улетучивается, гидроксид магния обезвоживается и красное пятно обесцвечивается. Если затем вновь смочить пятно дистиллированной водой, то вновь появляется красная окраска, обусловленная образованием Mg(OH)2. Запишите уравнение реакции. в) Обнаружение ионов кальция Выполнение работы. Реакция с оксалатом аммония (NH4)2C2O4. К 5-6 каплям раствора соли кальция добавляют 3-4 капли раствора оксалата аммония. Смесь нагрейте до кипения и дайте ей постоять 2-3 мин. Выпадает белый кристаллический осадок СаC2O4, растворимый в соляной и азотной кислотах, но не растворимый в уксусной кислоте даже при нагревании. Проверьте и запишите соответствующие уравнения реакций в молекулярной и ионной форме. г) Обнаружение ионов железа (III). Выполнение работы. 1. Реакция с гексацианоферратом (II) калия K4[Fe(CN)6]. В пробирку помещают 5-6 капель раствора FeCl3 и добавляют столько же раствора K4[Fe(CN)6]. Выпадает осадок темно-синего цвета Fe4[Fe(CN)6]3, называемый берлинской лазурью. Запишите уравнение реакции. Осадок не растворяется в кислотах и растворяется в щелочах с образованием красно-бурого осадка Fe(OH)3: Fe4[Fe(CN)6]3 + 12NaOH = 4Fe(OH)3 + 3Na4[Fe(CN)6]. 2. Реакция с роданидом аммония. Поместите в пробирку 1 каплю раствора FeCl3, разбавьте 5 каплями раствора дистиллированной воды и добавьте 3-5 капель раствора NH4SCN. При этом появляется кроваво-красное окрашивание, вызванное образованием малодиссоциирующих молекул роданида железа (III) [Fe(SCN)3]. Запишите уравнение протекающих реакций. д) Обнаружение ионов железа (II). Выполнение работы. Реакция с гексацианоферратом (III) калия K3[Fe(CN)6]. В пробирку помещают 5-6 капель раствора соли Fe2+ и добавляют столько же раствора K3[Fe(CN)6]. Выпадает осадок темно-синего цвета (турнбулева синь) Fe3[Fe(CN)6]2. Осадок не растворяется в кислотах и растворяется в щелочах с образованием гидроксида железа (II). Проверьте и запишите соответствующие уравнения реакций. е) Обнаружение ионов свинца (II). Выполнение работы. Реакция с иодидом калия. В пробирку помещают 3-5 капель раствора нитрата свинца (II) и приливают 3-6 капель раствора иодида калия. Выпадает золотисто-желтый осадок. Запишите уравнение реакции в молекулярной и ионной форме. ж) Обнаружение ионов меди (II). Выполнение работы. 1. Реакция с аммиаком. К 3-4 каплям раствора соли сульфата меди по каплям добавить раствор появляется интенсивное синее окрашивание, вызванное образованием аммиаката меди (II). Запишите уравнение реакции. 2. Реакция с роданидом калия. К 2-3 каплям соли меди прибавляют 3-4 капли раствора KSCN. Образуется черный осадок роданида меди. Запишите уравнение протекающих реакций. з) Обнаружение ионов хлора. Выполнение работы. Реакция с нитратом серебра. К нескольким каплям раствора хлорида калия добавьте несколько капель нитрата серебра. В присутствии хлорид-ионов образуется белый осадок хлорида серебра, который не растворяется в азотной кислоте, но растворяется в растворах аммиака, карбоната аммония. Запишите соответствующие уравнения реакций в молекулярной и ионной форме. и) Обнаружение сульфат-ионов. Выполнение работы. Реакция с хлоридом бария. К нескольким каплям раствора сульфата натрия добавьте несколько капель раствора хлорида бария. В присутствии сульфат-ионов образуется белый осадок сульфата бария, который не растворим в азотной кислоте. Запишите соответствующие уравнения реакций в молекулярной и ионной форме. к) Обнаружение карбонат-ионов. Выполнение работы. 1. Реакция с уксусной кислотой. К 3-5 каплям раствора карбоната натрия добавляют избыток 2 М уксусной кислоты. Бурное выделение пузырьков газа указывает на присутствие СО32–. Проверьте. Запишите уравнение реакции. 2. Реакция с нитратом серебра. К 3-5 каплям раствора карбоната натрия добавляют 2-3 капли раствора нитрата серебра. В присутствии карбонат-ионов выпадает белый осадок, растворимый в азотной кислоте. Проверьте. Запишите соответствующие уравнения реакций в молекулярной и ионной форме. Опыт 2. Определение ионного состава пробы воды. Выполнение работы. Получите у преподавателя пробу воды и с помощью качественных реакций проделанных в опыте 1 определите, какие ионы присутствуют в воде. Результаты анализа занесите в таблицу (пример).
Лабораторная работа № 3 Определение окисляемости воды Цель работы: Определить перманганатную окисляемость воды. Задание 1. Определение перманганатной окисляемости воды. КМnО4 Определение перманганатной окисляемости (метод Кубеля) состоит в окислении вещества пробы раствором перманганата калия в серной кислоте. После кипячения в пробу добавляется стандартный раствор щавелевой кислоты, которая реагирует с остатками перманганата. Избыток щавелевой кислоты оттитровывается стандартным раствором перманганата калия. Определению мешают хлориды (>300 мг/л), которые можно маскировать добавкой сульфата ртути (II). Железо (II), сульфиды, нитраты также мешают определению. Они определяются другими методами анализа, а затем полученные значения содержания этих примесей вычитаются из результата определения перманганатной окисляемости. 1 мг нитратов потребляет 0,3 мг атомарного кислорода, 1 мг железа (II) -0,14 мг кислорода. 2 KMnO4 + 3H2SO4 = K2SO4 +2 MnSO4+3H2O +5О Оборудование и реактивы 1. Серная кислота. 2. Перманганат калия. 3. Колбонагреватель. 4. Спиртовка. 5. Бюретка. 6. Воронка. 7. Щавелевая кислота. Ход работы. К 100 мл анализируемой пробы добавить 5 мл H2SO4 (1:3) и 10 мл 0,01н КМnО4, Смесь нагреть до кипения за 5 минут и кипятить точно 10 минут, закрыв конической воронкой колбу, чтобы уменьшить испарение жидкости. После кипячения к горячему раствору добавить 10 мл 0,01н щавелевой кислоты. Горячую смесь титровать 0,01 н КМnO4 до появления розового окрашивания Одновременно с анализом исследуемой пробы провести холостой опыт с дистиллированной водой, не упуская ни одной стадии анализа. Величину перманганатной окисляемости рассчитать по формуле: 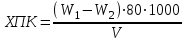 , где , гдеХПК = (V1 -V2)80/W, где V1 и V2 - эквивалентные объемы перманганата калия, израсходованные на титрование анализируемой и холостой проб; W - объем пробы. Нормальность перманганата следует устанавливать в день проведения анализа, титруя стандартный раствор щавелевой кислоты. Оформление результатов работы. Описать последовательность выполнения работы, на основании полученных данных рассчитать окисляемость воды и дать заключение об ее чистоте. |
