1 лекция бх-2. Введение в биологическую химию Биологическая химия
 Скачать 186.19 Kb. Скачать 186.19 Kb.
|
|
Введение в биологическую химию Биологическая химия – наука, которая изучает молекулярный состав живых организмов и протекающие в них химические реакции, которые лежат в основе жизнедеятельности одно- и многоклеточных организмов, в том числе и человека. «Медик без довольного познания химии совершенен быть не может» М.В. Ломоносов Задачи биохимии Идентификация биохимических процессов Выяснение взаимосвязи между структурой и функциями биомолекул, участвующих в реакциях метаболизма Выявление молекулярных механизмов процессов в живом организме Основная задача медицинской бх Сохранение здоровья человека Выяснение причин различных заболеваний и изыскание путей их эффективного лечения Разделы биохимии Статическая Динамическая Функциональная P.S. 1.Лекционные тетради должны быть у каждого студента на практическом занятии по биохимии 2.Роспись преподавателя должна быть в лекционной тетради студента в теме, соответствующей теме занятия 3. Наличие и соответствующее оформление лекционной тетради будет учтено в БРС дисциплины. Домашнее задание 1  .Повторить структурные формулы 20 аминокислот, согласно классификации по полярности радикалов Дополнение к дз  3. Физик- химические свойства белков (растворимость, изоэлектрическая точка, движение белков в электрическом поле) ФЕРМНЕТЫ Ферменты (энзимы, обозначаются буквой Е) – это высокомолекулярные соединения белковой природы, биокатализаторы, ускоряющие химические реакции в организме, за счет снижения энергии активации Энергия активации – это то количество энергии, которое необходимо для перевода всех молекул 1 моль вещества в активное состояние при данной температуре. Энергетический барьер – это такое количество энергии, которое необходимо преодолеть молекулам для вступления в химическое взаимодействие. Величина энергии активации равна величине энергетического барьера Свойства ферментов Специфичность – наиболее важное свойство ферментов, определяющее ДОПИСАТЬ Способность каждого фермента взаимодействовать Дописать Каталитичсекая специфичность Лабильность ферментов Каталитическая эффективность Способность ферментов к регуляции (активаторы и ингибиторы) Все ферменты белки, функционирующие в третичной структуре Метаболический путь – цепь биохимических реакций, у которых продукт одной реакции становится субстратом для дальнейшей реакции. Они могут иметь различное строение Линейный (гликолиз) Разветвленный (синтез нуклеотидов) Циклический (синтез мочевины) Спиральный (синтез жирных кислот) Строение ферментов Фермент Субстрат – это вещество или лиганд, который взаимодействует с АЦ фермента и претерпевает в нем химические превращения (НАИЗУСТЬ)Активный центр(АЦ) – имеет все ферменты. Это небольшой участок молекулы фермента, который располагается в гидрофобной нише, образован боковыми радикалами кислотных остатков, которые на уровне третичной структуры формируют центр комплементарного взаимодействия субстратом. Состоит из 2ух участков 1.Якорный – закрепление 2.Каталитический – необходим для химического превращения субстрата. Комплементарность – это геометрическая или пространственная и электростатическое соответствие между активным центром фермента и субстратом. Продукт реакции – это вещество, получаемое из субстрата после его взаимодействия и химического превращения в АЦ. Активатор – лиганд, который взаимодействует с аллостерическим центром и включает его действие Ингибитор – это лиганд, который функционирует в аллостерическом центре фермента и прекращает его действие Строение регуляторных или аллостерических ферментов – имеют, как правило, 2 и более субъеденицы. В регуляторных ферментах выделяют каталитическую часть и регуляторную субъединицу на котором находится вырезанный аллостерический регуляторный центр. В регуляторный центр присоединяется какой – либо субстрат (активатор или ингибитор) Олигамерные белки – состоят из 2ух и более белков. В 4 структуре белковой молекулы !Аллостерические или белковые катализируют ключевые скорость – лимитируещие, регуляторные реакции метаболических путей Ферменты могут содержать не белковый компонент (сложный фермент, холофермент.) Небелковая часть – кофактор, коэнзим Ионы металлов Коферменты 1.Гемы 2.Нуклеотиды 3.глутатион 4.Производные витаминов 5.ФАФС 6.Убихинон Располагаются рядом с АЦ !!!ДЗ – структурные формулы НАД и ФАД. Расшифровка, их названия, функции. ЗНАТЬ! Номенклатура ферментов 1.Название субстрата 2.Тип катализируемой реакции 3.Окончание аза Классификация ферментов (КФ, ЕС) Все ферменты разбиты на 6 основных классов. По типам химической реакции ЕС1: Оксидуредуктазы – катализирует ОВР – реакции переноса или отщепления присоединения электронов. Отщепление или присоединение атомов водорода. С ними работают НАД и ФАД ЕС2: Трансферазы – перенос межмолекулярный групп атомов, кроме атомов водорода ЕС3: Гидролазы – катализирует реакции расщепление связей в присутствии воды ЕС4: Лиазы – катализируют реакции расщепления связей, отщепление воды и карбоксильных групп, но без участия воды ЕС5: Изомеразы – катализируют реакции переноса любой группы, даже водорода, но в пределах одной молекулы. ЕС6: Лигазы – синтетазы, единственный класс, который катализирует образование новых связей. Могут соединять 2 вещества в одно, используя энергию молекулы АТФ. С ними работает кофермент Н – биотин Механизм действия ферментов Уравнение ферментативного катализа 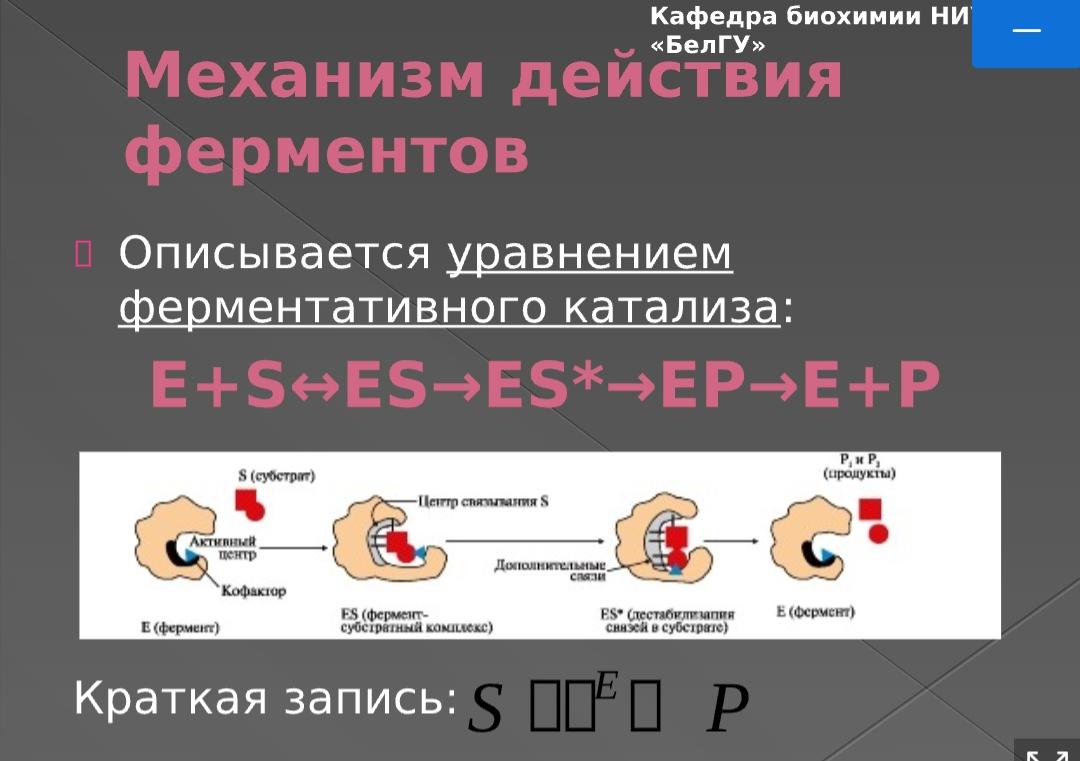 Е – энзим S – субстрат Р – продукт 1.Субстарт подходит к ферменту и располагается в строго определённом положении. 2.Так как имеет трехмерную структуру и благодаря своей комплементарности образуется нестойкий ЕS комплекс, который может обратимо распадаться 3.Образуется стойки фермент – субстратный комплекс. Происходит перераспределение связей 4.И образуется Р – продукт. Не комплементарный ферменту 5. Отсоединяется от АЦ фермента. Количество фермента при этом не меняется. Теории ферментативного катализа Теория «ключ – замок» - статическая модель (1890г. Эмиль Фишер) Теория «рука – перчатка» - индуцированного соответствия, динамическая модель (1959г. Дэниел Кошланд) еденица ферментативной активности – след тема |
