Введение Важнейшие проблемы народного хозяйства России Улучшение качественных характеристик
 Скачать 3.48 Mb. Скачать 3.48 Mb.
|
|
Марганцевые руды широко используются для производства стали. Общие запасы марганцевых руд оцениваются в 4,9 млрд. т; они связаны преимущественно с горными породами докембрийского возраста. Наиболее крупными ресурсами располагают ЮАР, Украина, Габон, Австралия, Бразилия. Современная добыча достигает 22 млн. т. Огромные запасы марганцевых руд сконцентрированы в железомарганцевых конкрециях, с содержанием марганца до 25-30%, Fe- 10-12%, устилающих на обширных пространствах дно Мирового океана, Их количество, по приближенным расчетам, превышает 2.5х10' т, что в сотни раз больше общих запасов этого сырья на суше. Опытная добыча ведется в США, Германии и Японии. Руды цветных металлов находят широкое применение в разнообразных отраслях промышленности - электронике, радио- и электропромышленности, космической и атомной технике, ракета- н самолетостроении и многих других. Их мировая добыча и потребление за последние 25 лет возросли в несколько раз. Общие запасы бокситов (сырье для производства алюминия) составляют 232 млрд. т, а извлекаемые - 28 млрд. т. Наиболее крупные и качественные залежи сосредоточены в Гвинее, Австралии, Камеруне, Бразилии, Индии, Ямайке. Руды тропиков возникли в палеогене и имеют осадочное происхождение. Всего разработка бокситов ведется в 22 странах мира (в основном в тропиках) и достигла в 1986 г. 97млн. т. Медь добывается очень давно (с конца IV тысячелетия до н.э.), имеет широкое применение, но ее руды отличаются крайне низкой концентрацией: жилы с содержанием меди 2-3% считаются богатыми, и разрабатываются руды даже при содержании Cu до 0,5%. Общие запасы медных руд, по разным оценкам варьируют от 570 до 1 625 млн. т, а разведанные извлекаемые - 590 млн. т. Добыча превосходит 8,4 млн. т в год (1986). Основная часть запасов принадлежит США (90 млн. т), Чили (120млн.т), странам СНГ (54млн.т), Австралии, Замбии, Заиру, Перу. Предполагают, что к 2000 г. из недр будет извлечено около 275 млн. т, т. е. около 70%, современного медно-рудного потенциала. Свинец и цинк используются с VI-VII тысячелетия до н.э. В зарубежных странах общие запасы свинцовых руд оцениваются в 125 млн. т, а цинковых -95 млн. т. В 1986 г. добыча этих руд поднялась до 3,4 млн. т. свинца и 7,0 млн. т цинка. Обычно свинец и цинк встречаются в рудах совместно с другими элементами (золотом, медью, серебром), образуя полиметаллические руды; реже встречаются самостоятельные месторождения. Наиболее крупными запасами свинцово-цинковых руд обладают США, Канада Австралия; остальные материки и страны существенно уступают в этом отношении. Олово известно с начала бронзового века; его содержание в земной коре крайне незначительно - руды с концентрацией Sn в 1% считаются богатыми. Общие мировые ресурсы оцениваются в 7,4-6,8 млн. т, а извлекаемые - в 4,2 млн. т; добыча достигает 200 тыс. т. Основная часть оловосодержащих руд возникла в мезозойскую и альпийскую эпохи. Наиболее крупные месторождения находятся в Бразилии (650 тыс. т), в Боливии (140 тыс. т; здесь открыта уникальная жила, протяженностью в 2 км), в оловяно-вольфрамовой провинции Юго-Восточной Азии (Малайзия, Индонезия, Китай), вмещающей свыше половины общих и разведанных запасов олова зарубежных стран. Олово-дефицитный металл спрос на него растет. По прогнозам к 2000 г. известные запасы иссякнут, и в обработку поступят хвосты обогатительных фабрик. Вольфрам, так же как и олово, в сочетании с которым он часто встречается, образует очень низкие концентрации. Руды с содержанием Wo 1% считаются богатыми. Преобладающая часть разведанных запасов находится в 5 странах - Южной Корее, Канаде, США, Турции и Австралии; в основном руды Wo образовались в мезозойскую и альпийскую эпохи. По прогнозам общие запасы вольфрама будут исчерпаны уже к 2000 г., и надежд на новые крупные приращения этого сырья мало. Благородные металлы - золото, серебро, платина и металлы ее группы. Золото - первый металл, известный человеку; золотые изделия начали получать еще 4-5 тыс. лет до н. э. В настоящее время в сейфах банков накоплено около 40 тыс. т золота. К концу XX в. всего будет добыто 110 тыс. т, хотя ежегодно добывается. 800-1200 т Au. Золотоносные руды образовывались в ранние эпохи: например, в архейскую - золоторудные месторождения зеленокаменных поясов Канады, Индии, Австралии, в протерозойскую -уникальные золотоносные конгломераты Витватерсранда (ЮАР) с запасами 25 тыс. т (75% мировой добычи). Понятие промышленных материалов Конструкционный материал – материал, предназначаемый для изготовления деталей машин и механизмов и способный выдержать прикладываемые к деталям нагрузки. 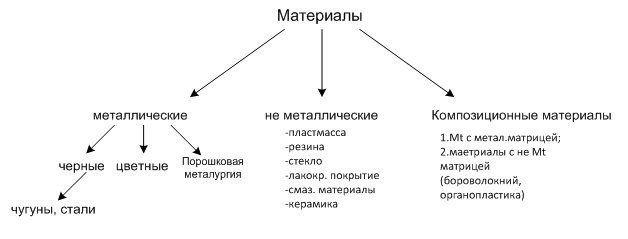 Рис. 7. Классификация конструкционных материалов Под металлами понимают определенную группу элементов, расположен ную в левой части Периодической таблицы Д.И.Менделеева. В технике под металлом понимают вещества, обладающие "металлическим блеском", в той или иной мере присущим всем металлам, и пластичностью. По этому приз наку металлы можно легко отличить от неметаллов, например дерева, кам ня, стекла или фарфора. Особенность строения металлических веществ заключается в том, что они все построены в основном из таких атомов, у которых внешние элект роны слабо связаны с ядром. Это обусловливает и особый характер хими ческого взаимодействия атомов металла, и металлические свойства. Элект роны имеют отрицательный заряд, и достаточно создать ничтожную раз ность потенциалов, чтобы началось перемещение электронов по направле нию к положительно заряженному полюсу, создающие электрический ток. Вот почему металлы являются хорошими проводниками электрического тока, а неметаллы или не являются. Слабая связь наружных электронов с ядром обусловливает химические и физические свойства металлов. В силу указанных выше особенностей металлы и их сплавы имеют сле дующее атомно-кристаллическое строение. В определенных местах кристал лической решетки располагаются положительно заряженые ионы, а наруж ные свободные электроны создают внутри металла, как бы легкотекучую жидкость, или электронный газ, который беспорядочно движется во всех направлениях. При определенных условиях, например при создании разнос ти потенциалов, движение электронов получает определенное направление и возникает электрический ток. Теория металлического состояния рассматривает металл как вещест во, состоящее из положительно заряженных ионов, окруженных отрицатель но заряженными частицами - электронами, слабо связанными с ядром. Эти электроны непрерывно перемещаются внутри металла и принадлежат не од ному какому-то атому, а всей совокупности атомов. Таким образом, характерной особенностью атомно-кристаллического строения металлов является наличие электронного газа внутри металла, слабо связанного с положительно заряженными ионами. Легкое перемещение этих электронов внутри металла и малая их связь с атомами обусловлива ют наличие у металлов определенных металлических свойств (высокая электро- и теплопроводность, металлический блеск, пластичность и др.) Все металлы можно разделить на две большие группы - черные и цветные металлы. Черные металлы темно-серого цвета, с большой плотностью (кроме щелочноземельных) , высокой температурой плавления, и во многих случаях обладают полиморфизмом. Наиболее типич ным металлом этой группы является железо. Цветные металлы чаще всего имеют характерную окраску: красную, желтую, белую. Обладают большой пластичностью, малой твердостью, отно сительно низкой температурой плавления, для них характерно отсутствие полиморфизма. Наиболее типичным металлом этой группы является медь. Все металлы - можно подразделить следующим об разом: 1. Железные металлы - железо, кобальт, никель и близкий к ним по своим свойствам марганец. Кобальт, никель и марганец часто применяют как добавки к сплавам железа, а также в качестве основы для соответс твующих сплавов, похожих по своим свойствам на высоколегированные стали. 2. Тугоплавкие металлы (вольфрам), температура плавления которых выше, чем железа (т.е. 1539 оС),применяют как добавки к легированным сталям, а также в качестве основы для соответствующих сплавов. 3. Редкоземельные металлы (РМЗ) - лантан, церий, неодим, празео дим и др., объединяемые под названием лантаноидов, и сходные с ними по свойствам иттрий и скандий. 4. Щелочноземельные металлы (литий, калий, натрий и др) в свободном металлическом состоянии не применяются, за исключением специальных случаев. Цветные металлы подразделяются: 1. Легкие металлы - бериллий, магний, алюминий, обладающие малой плотностью. 2. Благородные металлы - серебро, золото, металлы платиновой группы. 3. Легкоплавкие металлы - цинк, кадмий, ртуть, олово, свинец, висмут, таллий, сурьма и элементы с ослабленными металлическими свойс твами - галлий, германий. Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определённым порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решётка. Это понятие используют для описания атомно-кристаллической структуры и является воображаемой пространственной сеткой с ионами (атомами) в узлах. Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело. Для упрощения пространственное изображение принято заменять схемами, где центры тяжести частиц представлены точками. В точках пересечения прямых линий располагаются атомы; они называются узлами решетки. Расстояния a, b и c между центрами атомов, находящихся в соседних узлах решетки, называют параметрами, или периодами решетки. Величина их в металлах порядка 0,1–0,7 нм, размеры элементарных ячеек — 0,2–0,3 нм. Элементарная ячейка – элемент объёма из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл. 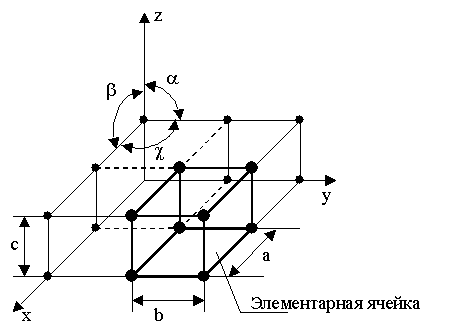  Рис. 8. Схема кристаллической решетки Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются размеры рёбер элементарной ячейки. a, b, c – периоды решётки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определёнными. - углы между осями (∠ α ∠ β ∠ χ ). - координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке. - базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки. - плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74) Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа; - примитивный – узлы решетки совпадают с вершинами элементарных ячеек; - базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях; - объемно-центрированный – атомы занимают вершины ячеек и ее центр; - гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней 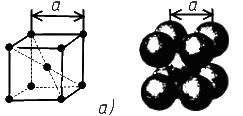 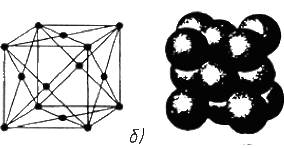 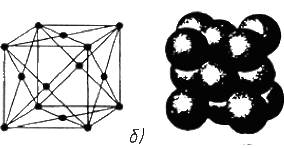 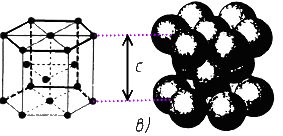 Рис. 9. Типы кристаллических решеток Основными типами кристаллических решеток являются:
Стали, классификация сталей, свойства сталей Сталь – сплав железа с углеродом, в котором углерода меньше 2.14%. I.По химическому составу. 1)углеродистые: - низкоуглеродистые (до 0,25%) - среднеуглеродистые (с 0,25-0,6%) - высокоуглеродистые (от 0,6%) 2)Легированные: - низколегированные (до 2%) - среднелегированные (с 2-10%) - высоколегированные (свыше 10%) II.По назначению: -конструкционные -инструментальные -специальные стали III.По структуре: - доэфтектический (углерода до 0,8% - Ф+П) - эвтектический (углерода 0,8% - П) - заэфтектический (углерода свыше 0,8-0,14% - Ц+П) IV.По качеству: -обыкновенного (S-0,05%, P-0,08%) -качественная (S-0,0035%, Р-0,0035%) -высококачественная (S-0,025%, Р-0,0025%) - в конце маркировки «А» -особовысококачественная (S-0,075%, P-0,0625) – в конце маркировка «Ш» Маркировка стали: - стали обыкновенного качества: Ст0, Ст1…Ст6 0,1…6 – показатели прочности А – механические свойства гарантированы – ВСт6 Б – гарантированный химический состав – АСтО В – гарантированные механические свойства и химические состав – БСт1 - качественные стали: Сталь: 08; 10; 15; 20 …85% 08; 10; 15; 20… - количество углерода в сотых долях С% - 0,08; 0,1; 0,15; 0,2…0,85% - инструментально – углеродистые стали: У7; У8; У9…У13 7; 8; 9…13 – количество углерода в десятых долях 0,7; 0,8; 0,9…1,3 - легированные стали: В основу классификаций положена, буквенно-цифровая система по ГОСТ-4547-71: Х – хром (Cr) Н – никель (Ni) Г – марганец (Mn) C – кремний, силициум (Si) М – No (молибден) Т – Ti (титан) В – Wi (вольфрам) Ю – Al (алюминий) Д – Cu (медь) Р – B (бор) К – Co (кобальт) Ц – (цирконий) А – (азот)  Рис. 10. Пример маркировки сталей Автоматные стали: А-12/А-20/А30 – на машинах автоматах 12; 20; 30 – показатели в сотых долях (углерод %) 0,12 – не ответственные детали 0,2; 0,3 – ответственные детали Быстрорежущая сталь: Р8 8 – количество вольфрама (W-8%) P6M4 Шарикоподшипниковая сталь: ШХ-15; Cr 1,5%, углерода свыше 1% Машиностроительные стали предназначены для изготовления различных деталей машин и механизмов. Они классифицируются:
Углеродистые стали Низкоуглеродистые стали 05 кп, 08, 10, 10 пс обладают малой прочностью высокой пластичностью. Применяются без термической обработки для изготовления малонагруженных деталей – шайб, прокладок и т.п. Среднеуглеродистые стали35, 40, 45 применяются после нормализации, термического улучшения, поверхностной закалки. В нормализованном состоянии по сравнению с низкоотпущенным обладают большей прочностью, но меньшей пластичностью. После термического улучшения наблюдается наилучшее сочетание механических свойств. После поверхностной закалки обладают высокой поверхностной твердостью и сопротивлением износу. Высокоуглеродистые стали60, 65, 70,75 используются как рессорно-пружинные после среднего отпуска. В нормализованном состоянии – для прокатных валков, шпинделей станков. Достоинства углеродистых качественных сталей – дешевизна и технологичность. Но из-за малой прокаливаемости эти стали не обеспечивают требуемый комплекс механических свойств в деталях сечением более 20 мм. Цементуемые и улучшаемые стали Цементуемые стали. Используются для изготовления деталей, работающих на износ и подвергающихся действию переменных и ударных нагрузок. Детали должны сочетать высокую поверхностную прочность и твердость и достаточную вязкость сердцевины. Цементации подвергаются низкоуглеродистые стали с содержанием углерода до 0,25%, что позволяет получить вязкую сердцевину. Для деталей, работающих с большими нагрузками, применяются стали с повышенным содержанием углерода (до 0,35 %). С повышением содержания углерода прочность сердцевины увеличивается, а вязкость снижается. Детали подвергаются цианированию и нитроцементации. Цементуемые углеродистые стали 15,20,25 используются для изготовления деталей небольшого размера, работающих в условиях изнашивания при малых нагрузках (втулки, валики, оси, шпильки и др.). Твердость на поверхности составляет 60…64 HRC, сердцевина остается мягкой. |
