Олимпиадные задачи по химии. Яковлева-олимп.задания. Задача 1 (8 класс)
 Скачать 1.19 Mb. Скачать 1.19 Mb.
|
|
Задача 1 (8 класс) Экскурсию в музей В одной из школ учитель 8Б организовал экскурсию в музей ‘древнегреческой истории’. Во время экскурсии один из учеников решил поспорить с своими одноклассниками что он сможешь не заметно взять камень из музея.Через некоторое время пропажа была обнаружена,мальчик сильно испугался и выбросил камень из окна.После дождливой недели сотрудники музей решили провести генеральную уборку территории,где и обнаружили пропажу.Но почему то камень изменил свою окраску.Сотрудники решили отправить камень в научную лабораторию.Лаборант произвёл анализ и выяснил причину возникновения такого феномена. 1.Допишите уравнения реакции и расставьте соответствующие коэффициенты. а) CaCO3+ H2SO4 → ......+ .....+ CO2 б)Na2CO3 + H2SO4 → ......+ ...... + ....... в)CaCO3 + H2SO4 →...... +....... + ....... г)Na2CO3 + H2SO4 → ......+ ......+ ....... д)CaCO3 + H2SO4 →...... + ...... +....... 2.Выберите какая реакции лежит в основе изменения окраски и почему ? 3.Где применяется Кальций?(не менее трёх приминени) 4.напишите ваши действия первой помощи человеку,отравившегося промышленным газом в задании 1 под буквой а). 5.При нейтрализации гидроксида натрия серной кислотой образуется средняя соль сульфат натрия и вода. Реакция при н.у. протекает активно и до конца. Уравнение реакции можно записать в виде: 2 NaOH + H2SO4 = Na2SO4 + H2O (12 баллов)
Задача 1 (8 класс) Испорченный газ Три химика независимо друг от друга сделали один и тот же опыт. Они пропускали воздух через раскалённый уголь, а потом через водный раствор гидроксида натрия. Оставшуюся часть воздуха они собрали в сосуды и отметили, что в нём гасли горящие лучины. Химики посчитали, что раскалённый уголь испортил воздух, и назвали газ "удушливым и ядовитым воздухом". 1. О каком газе идет речь? Напишите лабораторный и промышленный способ получения этого газа. 2. Опишите ваши действия первой помощи человеку, отравившегося промышленным газом. 3. Какие газы образуются во время грозы? Напишите уравнения реакций их взаимодействия с алюминием, учитывая, что реакции не относятся к реакциям соединения, а в продуктах реакции есть одно простое вещество. Расставьте коээфициенты в уравнениях реакций. 4. Какая масса О2 выделится при разложении 1 моль бертоллетовой соли (KClO3) массой 0,0153 кг? (16 баллов)
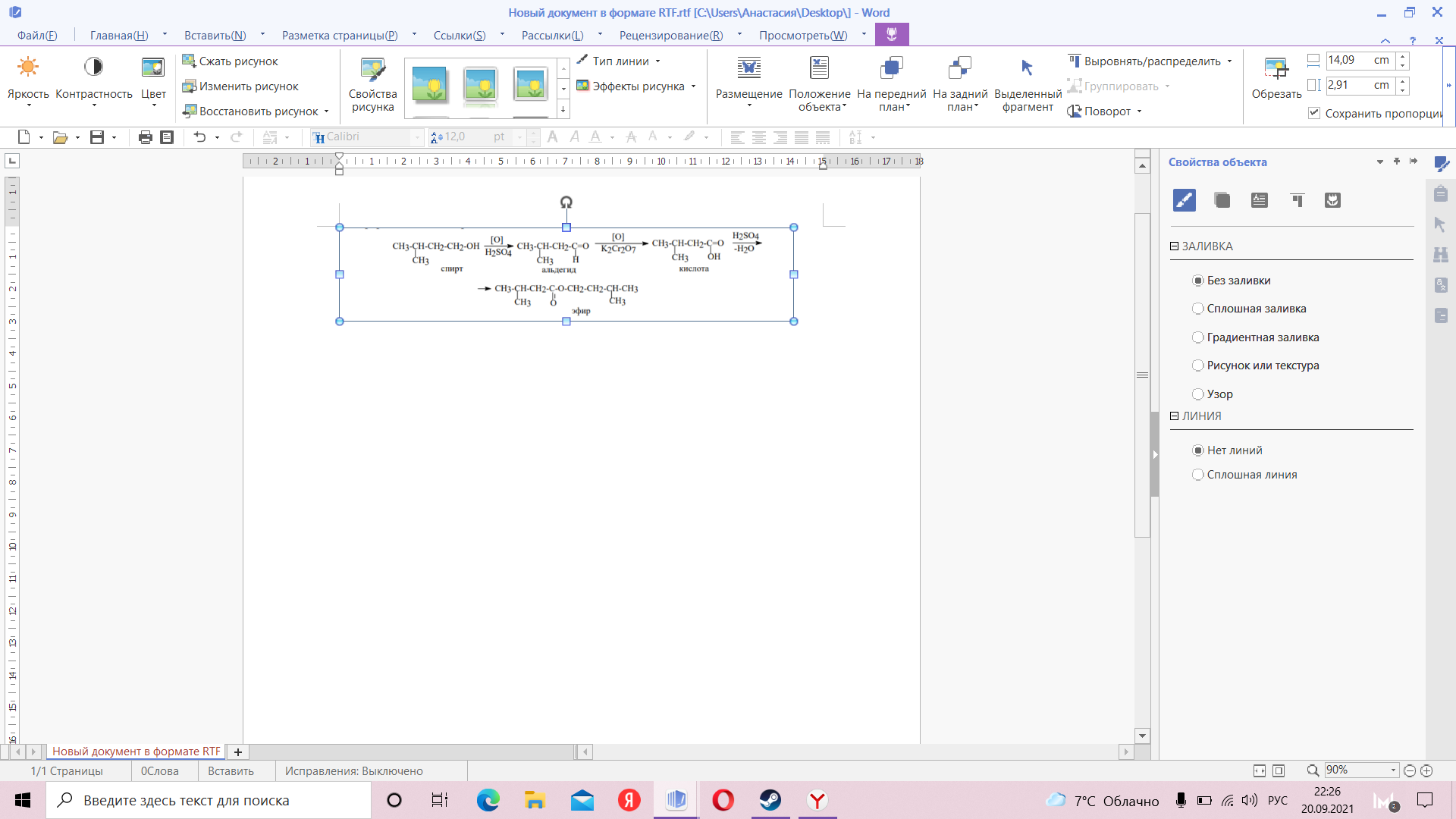
Задача 3 (10 класс) Получение эссенции Исследователи в области химии решили провести интересный опыт. Они налили в пробирку изоамилового спирта (3-метил-бутанола), затем ледяной водой и осторожно по каплям добавили концентрированной серной кислоты. В результате раствор приобрел красноватый цвет. Затем в колбу поместили раствор бихромата калия в воде. И смешали два полученных раствора. Началась бурная реакция. Появился запах банана, переходящий в сильный фруктовый. Колбу, снабженную обратным холодильником, нагревают на кипящей водяной бане в течение нескольких часов. Реакционная масса приобретает темно-зеленый цвет, появляется запах валерианы. В колбу добавляют дистиллированной воды и проводят простую перегонку. В приемнике собирается дистиллят, который разделяется на два слоя: верхний – альдегид и эфир, нижний – валериановая кислота. Напишите все возможные реакции описанные в тексте. Зная, следующую схему: Спирт => альдегид => кислота => эфир Подпишите под цифрами все составляющие установки. 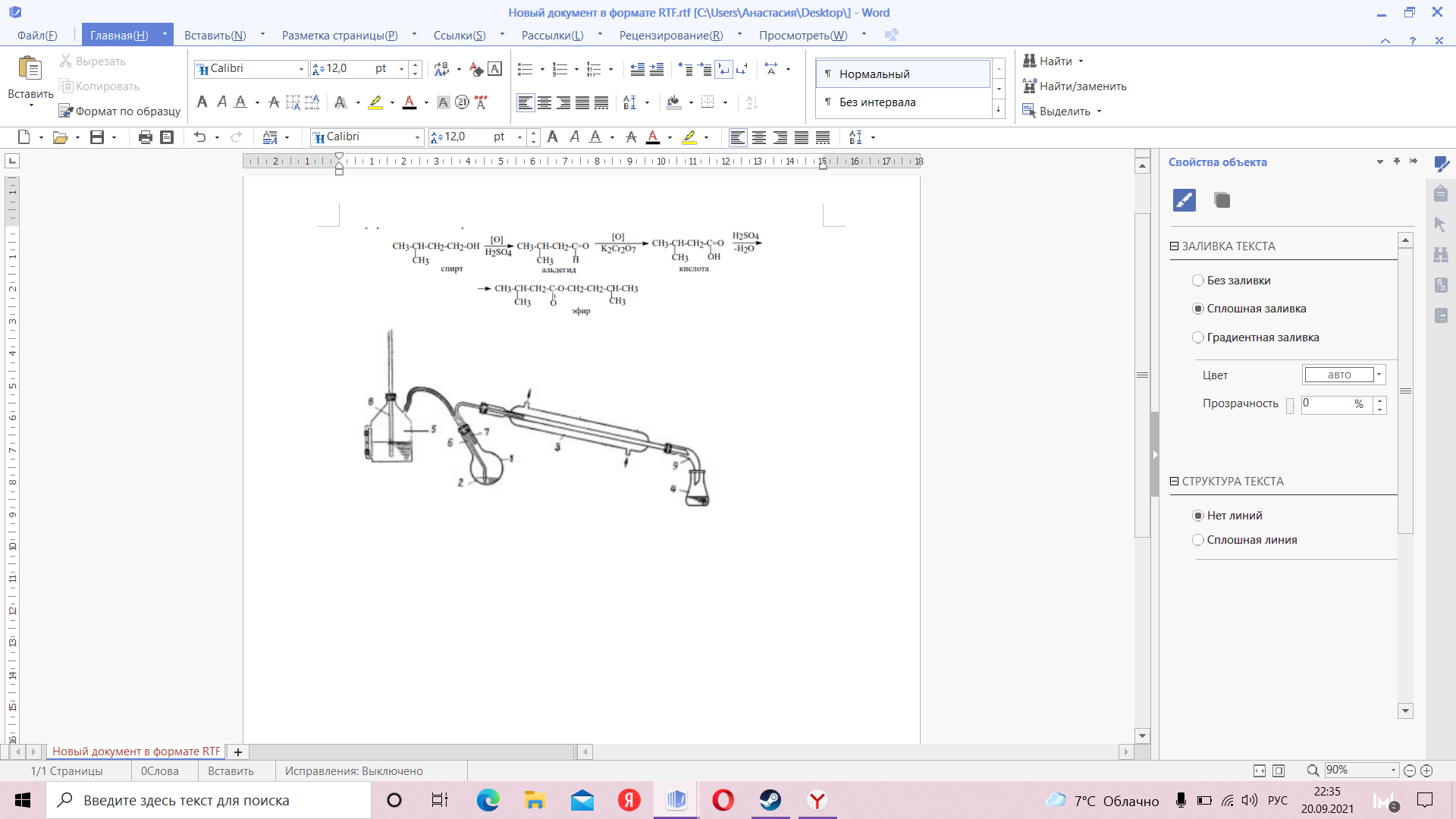 Напишите общую формулу для формальдегида и ацетона. При окислении алканола оксидом меди (II) получили 9.73 г альдегида, 8.65г меди и воду. Определите молекулярную формулу исходного спирта. (18 баллов)
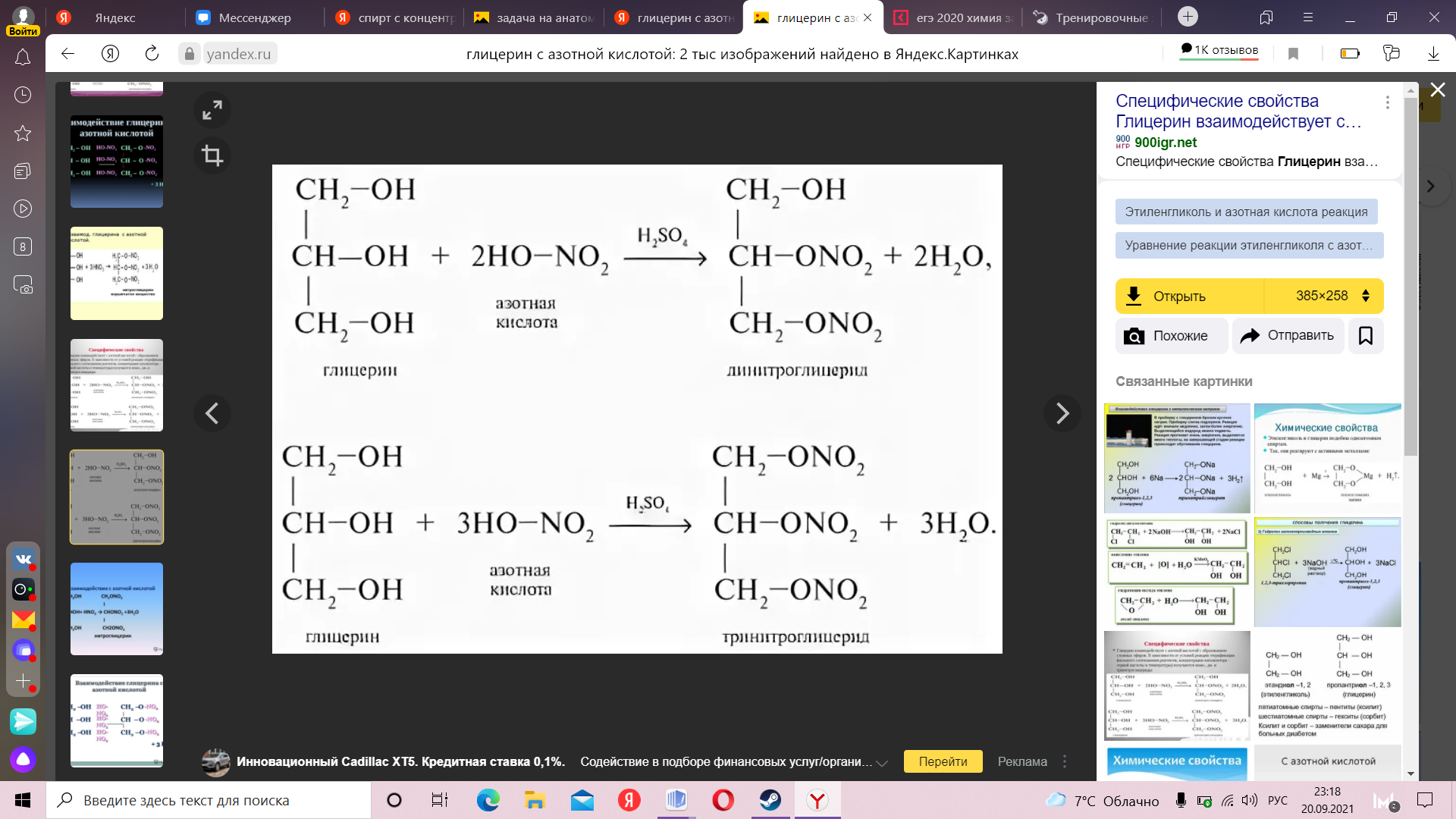
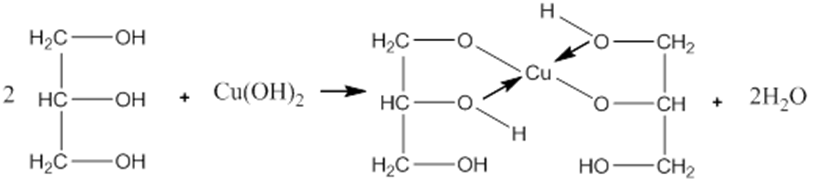
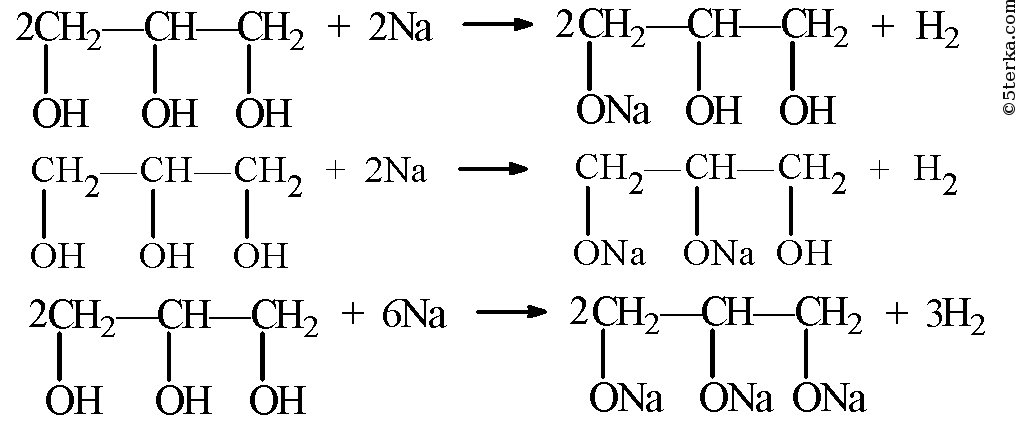
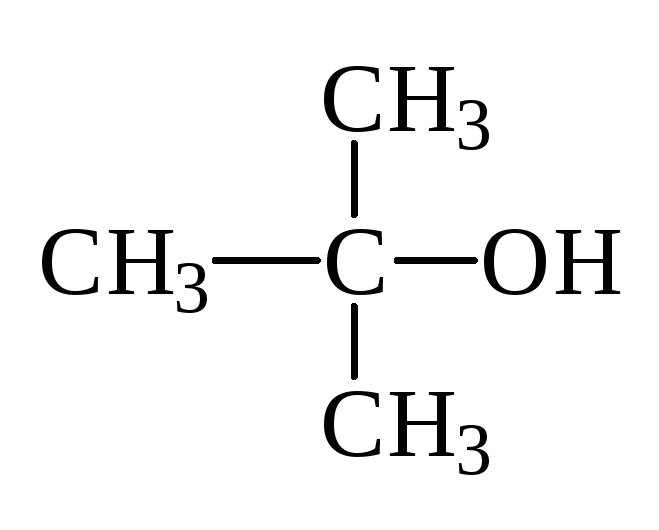
Задача 4 (11 класс) Неизвестная жидкость Шведский исследователь Карл нагрел оливковое масло с оксидом свинца, в результате чего образовался раствор сладкого вкуса. Дальнейшее выпаривание раствора позволило ему получить сиропообразную тяжелую жидкость. Ему стало интересно, почему так произошло и он обратился в лабораторию. В лаборатории провели ряд исследований и выяснили, что при взаимодействии этой жидкости с концентрированной азотной кислотой образуется взрывчатое вещество и одновременно лекарственный препарат, который позже будет применяться в качестве средства, расширяющего сосуды сердца. Ученые из лаборатории рассказали об этих открытиях Карлу, а также сказали, множество названий этому препарату. Карл так обрадовался своей находкой, что по приходу домой забыл все названия, но в голове крутилось лишь одно из них “тринитрин”. Напишите реакцию получения лекарственного препарата. Назовите какую сиропообразную жидкость принес в лабораторию шведский исследователь. Составьте уравнение реакции взаимодействия этой жидкости с гидроксидом тяжелых металлов, а также назовите продукт реакции. Будут ли признаки реакции? Если да, то какие? Напишите уравнение образования дизамещенного продукта с “тринитрином”. Назовите продукт реакции. Взяли навеску 7.4г неизвестного соединения и подвергли сжигаю в избытке кислорода. В качестве продуктов сгорания образовались только 8.96 л СО2 и 11.2 л Н2О. Установите молекулярную формулу неизвестного соединения и его строение, если известно, что оно реагирует с щелочными металлами, а также устойчив к окислению KMnO4. (19 баллов)
|