Задача 1 Часть Вводные данные р со 2 0,0045 pK co2 1,47 pk h2co3 6,35
 Скачать 116.68 Kb. Скачать 116.68 Kb.
|
|
Работу выполнил Никаноров Дмитрий 306 Задача 1Часть 1.Вводные данные Рсо2 = 0,0045 pKco2 = 1,47 pKH2co3 =6,35 pKHco3 = 10,33 pKw = 13,99 t=25℃ Постановка задачи Рассчитать растворимость углекислого газа при заданном парциальном давлении. Растворение газа — это одновременно физическое растворение CO2=CO2aq и реакция взаимодействия с водой физически растворенного газа. CO2aq + H2O↔H2CO30 CO2aq + OH↔HCO3- Расчёт равновесия воды с углекислым газом. CO2 + H2O ↔H2CO3 H2CO3 – сумма физически растворенного углекислого газа и недиссоциированной угольной кислоты. Тогда равновесие: KCO2 = 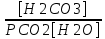 [1] [1] [H2CO3] = KCO2PCO2 KCO2– константа Генри для абсорбции или растворения газа. Активность газа определяется его концентрацией в газовой фазе (используем парциальное давление) [H+] = 2[CO32-] + [HCO3-] + [OH-] - равновесие воды с углекислым газом с учетом уравнения электронейтральности. Представляем через константы диссоциации, константу Генри, парциальное давление газа и [H+]: H2CO3 ↔ H++ HCO3- pKH2CO3 = 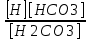 [2] [2]pKH2CO3 = 6,35 HCO3-↔ CO32-+ H+ pKHCO3 = 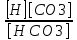 [H+] = 2[CO32-] + [HCO3-] + [OH-] [HCO3-] = 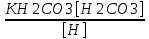 = = 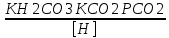 [CO32-] = 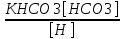 = = 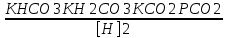 Из произведения растворимости воды получаем уравнение для гидрооксида: H2O↔H++ OH- Kw = [H+][OH-] [H2O] = 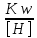 [H+]3- (KH2CO3KCO2PCO2+Kw) [H+] - 2KHCO3KH2CO3KCO2PCO2= 0 [H+]3- (10-6,3510-1,470,0045+ 10-13,99) [H+] – 2* 10-10,33 10-6,35 10-1,47 0,0045= 0 [H+]3– 1,16*10-10[H+] – 1,09*10-20 = 0 Уравнение решается графически построением функции в зависимости от pH, где точка перехода через 0 и есть решение. Решил данное уравнение через вольфрам-альфа и получил три корня. Аналитическое решение   Рис. 1. Корни уравнения, полученные с помощью сайта вольфрам альфа. Из результатов вычисления, представленных на рис. 1, следует, что для наших вычислений подходит только один корень данного уравнения = 8,25356*10^-6 [H] = 8,25356*10^-6; pH = -Lg[H] = 5,08 [H2CO3] = KCO2PCO2 = 0,0045* 10-1,47 = 0,00015моль/л [HCO3-] = 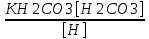 = = 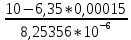 = 8,11802*10-6 моль/л = 8,11802*10-6 моль/л[CO32-] = 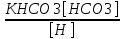 = = 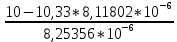 = 4,39*10-7моль/л = 4,39*10-7моль/лИтого растворилось углекислого газа: С = [H2CO3] + [HCO3-] + [CO32-] = 0,00015 + 8,11802*10-6 + 4,39*10-7 = 0,000158557 моль/л Расчёты путём моделирования В результате гидрогеохимического моделирования были получены следующие значения растворимостей: С = [H2CO3] + [HCO3-] + [CO32-] = 1.5519101E-04 + 8.383627E-06 + 4.753190E-11 = 0,000163575 моль/л Данные, полученные путем вычислительных расчётов вручную и компьютерного моделирования практически совпадают. Часть 22.1. Вводные данные Рсо2 = 0,0045 pKco2 = 1,47 pKH2co3 =6,35 pKHco3 = 10,33 pKw = 13,99 t=25℃ C = 10-4,43моль/л 2.2. Постановка задачи На основании приведенных уравнений можно оценить распределение форм углекислоты как отношение концентрации данной формы к валовому карбонату, а заодно определить изменение долей этих форм в зависимости от концентрации иона водорода или рН. Для неонизированной формы H2CO3 делим обе части на концентрацию недиссоциированной угольной кислоты. 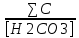 = 1+ = 1+ 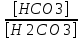 + + 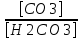 Используем уравнения диссоциации карбонатных ионов 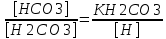 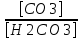 = = 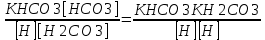 После подстановки получаем долю неионизированной формы 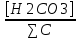 = (1 + = (1 +  -1 -1или 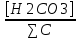 =(1 + KH2CO3 10pH + KHCO3 KH2CO3 102pH)-1 =(1 + KH2CO3 10pH + KHCO3 KH2CO3 102pH)-1Далее проделываем аналогичные преобразования для гидрокаронат – иона и карбонат – иона 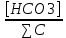 = (1 + = (1 + 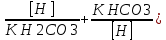 -1 -1или 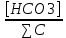 = (1 + 10-pH/ KH2CO3+ KHCO3 10pH)-1 = (1 + 10-pH/ KH2CO3+ KHCO3 10pH)-1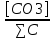 = (1 + = (1 + 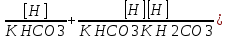 -1 -1или 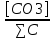 = (1 + 10-pH/ KHCO3+ 10-2pH/ KHCO3KH2CO3 = (1 + 10-pH/ KHCO3+ 10-2pH/ KHCO3KH2CO3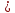 -1 -12.3. Расчёт задачи 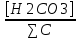 = (1 + = (1 + 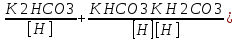 -1 = -1 =(1 + 10-6.35/ x + 10-10.33*10-6.35 / x^2)-1 = 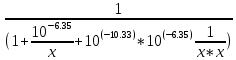 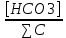 = (1 + = (1 + 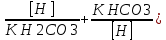 -1 = -1 = 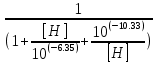 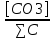 = (1 + = (1 + 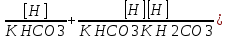 -1 = -1 =(1 + 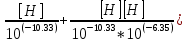 -1 -1По приведенным формулам построен график зависимости форм карбонатов углекислоты в воде от pH (рис.2).  Рис.2. График зависимости форм карбонатов углекислоты в воде от pH. 2.4. Расчёты путём моделирования. В результате моделирования мы получили такую зависимость. (рис.3) Результаты совпали – при нашем pH = 5,08 доминирующая форма карбонатов в обоих расчетах является H2CO3.  Рис.3. График зависимости форм карбонатов углекислоты в воде от pH по результатам моделирования. Часть 3.3.1. Вводные данные Рсо2 = 0,0045 pKco2 = 1,47 pKH2co3 =6,35 pKHco3 = 10,33 pKw = 13,99 t=25℃ C = 10-4,43моль/л 3.2. Постановка задачи На основании приведенных уравнений можно оценить распределение форм углекислоты как отношение концентрации данной формы к валовому карбонату, а заодно определить изменение долей этих форм в зависимости от концентрации иона водорода или рН. Для неонизированной формы H2CO3 делим обе части на концентрацию недиссоциированной угольной кислоты. 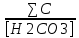 = 1+ = 1+ 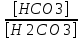 + + 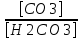 Используем уравнения диссоциации карбонатных ионов 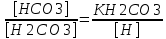 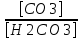 = = 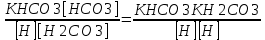 После подстановки получаем долю неионизированной формы 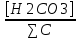 = (1 + = (1 +  -1 -1или 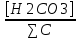 =(1 + KH2CO3 10pH + KHCO3 KH2CO3 102pH)-1 =(1 + KH2CO3 10pH + KHCO3 KH2CO3 102pH)-1Далее проделываем аналогичные преобразования для гидрокаронат – иона и карбонат – иона 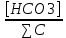 = (1 + = (1 + 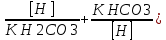 -1 -1или 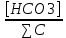 = (1 + 10-pH/ KH2CO3+ KHCO3 10pH)-1 = (1 + 10-pH/ KH2CO3+ KHCO3 10pH)-1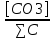 = (1 + = (1 + 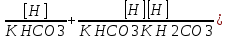 -1 -1или 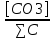 = (1 + 10-pH/ KHCO3+ 10-2pH/ KHCO3KH2CO3 = (1 + 10-pH/ KHCO3+ 10-2pH/ KHCO3KH2CO3 -1 -13.3. Расчёт задачи [H] = 8,25356*10^-6; pH = -Lg[H] = 5,08 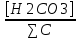 = (1 + = (1 + 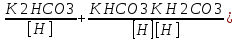 -1 = -1 = = (1 + 10-6.35/ x + 10-10.33*10-6.35 / x^2)-1 = = 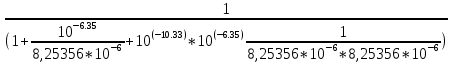 = 0.948658 = 0.948658[H2CO3] = 0.00015 моль/л 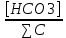 = (1 + = (1 + 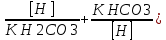 -1 = -1 = 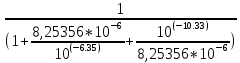 = 0.0513415 = 0.0513415[HCO3] = 8,11802*10-6 моль/л 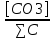 = (1 + = (1 + 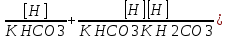 -1 = = (1 + -1 = = (1 + 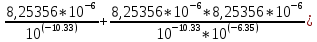 -1 = 2,90956*10-7 -1 = 2,90956*10-7[CO3] = 4,39*10-7моль/л 3.4. Расчёты путём моделирования [H2CO3] = 1.519101E-04 [HCO3] = 8.383627E-06 [CO3] = 4.753190E-11 pH = 5.078 Вывод: доминирующая форма карбонатов при pH = 5.078 – H2CO3. Часть 44.1. Вводные данные Рсо2 = 0,0045 pKco2 = 1,47 pKH2co3 =6,35 pKHco3 = 10,33 pKw = 13,99 t=25℃ L = 10-8.48 4.2. Постановка задачи Распространенность карбонатов различных металлов определена наличием углекислоты, части воздуха атмосферы и зоны аэрации. Распространенный минерал – кальцит. В случаях загрязнения подземных вод кальцит и углекислота воздуха являются источником карбонатов, образующих с другими металлами собственные карбонаты или твердые растворы. Растворимость кальцита в зоне аэрации (АЕ) Система CaCO3 – H20 – CO2 открыта к кальциту и углекислому газу Вполне подвижные компоненты Твердая фаза постоянного состава Кальцит – CaCO3 Газовая фаза с постоянной активностью (парциальным давлением) CO2 Жидкая фаза переменного состава включает воду – H2O Основные ионы CaCO3 HCO3 HOH И их комплексные соединения H2CO3 CaOHCa(OH)2 CaHCO3 CaCO3 В обычных пресных водах даже гидрокарбонатно-кальциевого состава минерализация выше. К этому приводит наличие посторонней кислоты – в природе наиболее распространенной кислотой является углекислота, получаемая при растворении углекислого газа, который есть в воздухе почвы и ЗА. Воздух содержит активные газы, растворение которых в воде приводит к усилению взаимодействия с минералами, и инертные. В контакте с воздухом ЗА и на поверхности грунтовых вод полагается постоянной равновесие воды с углекислым газом ЗА. Кальцит также равновесен с водой. Углекислый газ создает угольную кислоту, а она растворяет кальцит. Раствор равновесен с углекислым газом, значит по закону действия масс: CO2 + H2O = H2CO3 KCO2 = 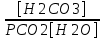 = [H2CO3] = KCO2 PCO2 = [H2CO3] = KCO2 PCO2pKCO2 = 1.47 t=25℃ Найдем все компоненты диссоциации кислоты и выразим их концентрации через парциальное давление углекислого газа и концентрацию ионов водорода. H2CO3 = H + HCO3 KH2CO3 = 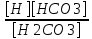 pK H2CO3 = 6.35 pK H2CO3 = 6.35[HCO3] = 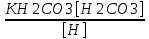 = = 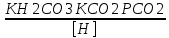 HCO3 = H + CO3 KHCO3 = 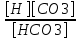 pKHCO3 = 10.33 pKHCO3 = 10.33[CO3] = 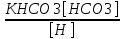 = = 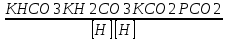 Уравнение для гидроксида из произведения растворимости воды H2O = H + OH Kw = [H][OH] pK = 13.99 [OH] = 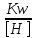 Однако вещества, содержащие карбонат, получаются и из растворяющегося кальцита CaCO3 = Ca + CO3 Сначала карбонат – ион, затем он может диссоциировать с гидроксонием в гидрокарбонат – ион HCO3, и далее в молекулу углекислоты. Остается выразить концентрацию растворенного кальция через парциальное давление углекислого газа и концентрацию ионов водорода. [Ca] = 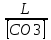 [Ca] = 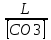 = = 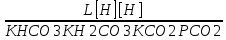 Уравнение электронейтральности 2[Ca] +[H] = 2[CO3] + [HCO3] + [OH] Подставляем и 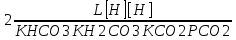 + [H] =2 + [H] =2 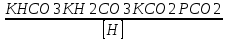 + + 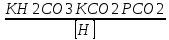 + + 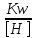 Домножаем на [H]2 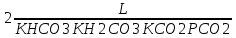 [H]4 + [H]3 – ( [H]4 + [H]3 – (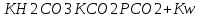 ) [H] - ) [H] - 2 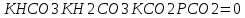 4.3. Расчёт задачи 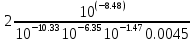 [H]4 + [H]3 – ( [H]4 + [H]3 – (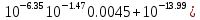 ) [H] - 2 ) [H] - 2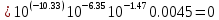 2,07882*1012*[H]4+ [H]3 - 6,81205*10-11[H] -6,37151* 10-21 = 0 (рис.4.) 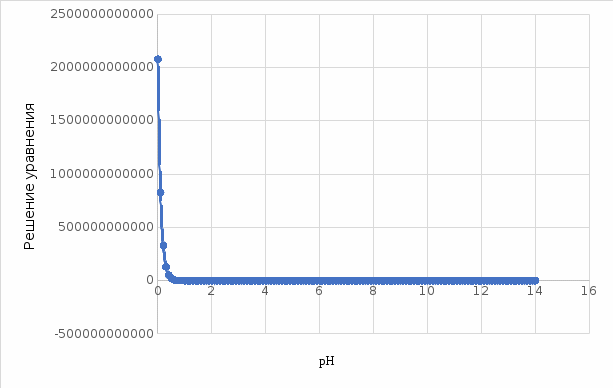 Рис.4. Графическое решение уравнения Значение pH в точке пересечения с нулём =7.495, тогда [H]=3,1989*10-8 [HCO3] = 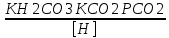 = = 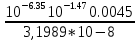 = 2,12918*10-3 = 2,12918*10-3[CO3] = 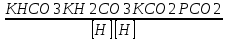 = = 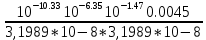 = 3,11323*10-6 = 3,11323*10-6[Ca] = 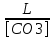 = = 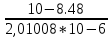 = 1,06363*10-3 = 1,06363*10-34.4. Расчёты путём моделирования По результатам моделирования были получены следующие значения pH = 7.536 [HCO3] = 2,565513*10-03 [CO3] = 5,049451*10-06 [Ca] = 1,266711*10-03 Наши значения расходятся более, чем на 12%. Но, в расчетных методах не была учтена ионная сила раствора. 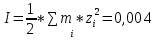 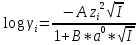 Откуда, 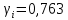 , , 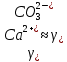 а, значит: а, значит: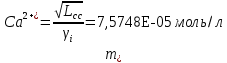 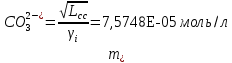 А, следовательно, общая концентрация [𝐶𝑎2+]=1,06363E-03+2*7,5748E-05=1,215126E-03 моль/л. Ошибка между рассчитанными значениями и полученными в ходе моделирования составляет 0,4%, соответственно, можно сказать, что данные сходятся и данную программу можно использовать для расчета растворимости кальцита в воде при заданном парциальном давлении. |
