рр. Теор-задания. Задача 91 Нюхательные соли порошок с резким запахом, который применялся как средство от дурноты. Г. БичерСтоун, Хижина дяди Тома
 Скачать 379 Kb. Скачать 379 Kb.
|
Девятый класс Задача 9-1 «Нюхательные соли – порошок с резким запахом, который применялся как средство от дурноты.» Г. Бичер-Стоун, «Хижина дяди Тома». Не так давно, ещё каких-то сто лет назад у каждой уважающей себя дамы был при себе флакончик с нюхательной солью. Они использовали её, чтобы не упасть в обморок, когда становилось душно. 1. Предложите состав нюхательной соли, считая, что это индивидуальное соединение, выделяющее газ с резким запахом. Ответ аргументируйте. Напишите уравнение реакции получения из этого соединения газа с резким запахом. 2. Предложите способ получения этого соединения природных минералов. 3. Что является современным аналогом нюхательной соли? Приведите его тривиальное название. 4. Предложите состав нюхательной соли, состоящей из смеси двух солей (желательно из доступных в XVIII веке), приведите их тривиальные названия. В каком соотношении необходимо смешивать эти соли? Задача 9-2 Из раствора, оставшегося в колбе после получения газа X из поваренной соли и вещества Y, были выделены кристаллы А (реакция 1). При нагревании до 59 С кристаллы А плавятся, превращаясь в бесцветную жидкость, а при дальнейшем нагревании расплав затвердевает, превращаясь в соль В (реакция 2). Соль В плавится при 186 С, а при более сильном нагревании её расплав затвердевает, образуя вещество С (реакция 3). При температуре выше 500 С вещество С разлагается, превращаясь в соль D и выделяя едкие пары вещества E (реакция 4). При действии на вещество D раствора вещества Y образуется раствор, из которого кристаллизуется А (реакция 5). Вещество E реагирует с углём (реакция 6), образуя два газа (F и G), вызывающие помутнение известковой воды (реакции 7, 8), но лишь один из которых (газ G) обесцвечивает раствор перманганата калия (реакция 9). При действии хлора на газ G образуется бесцветная жидкость L (реакция 10), в которой вещество E растворяется с образованием жидкости M (реакция 11). Известно, что E, M и L реагируют с водой, давая раствор (реакция 12, 13, 14), реагирующий с хлоридом бария с образованием белого кристаллического осадка (реакция 15). Раствор, полученный действием воды на вещества L и М, даёт также белый творожистый осадок с нитратом серебра (реакция 16). Определите все описанные вещества, если известно, что А содержит 58,0 % кислорода по массе, в то время как вещество M – 37,2 %. Запишите уравнения упомянутых реакций. Изобразите строение вещества М. NaCl + Y X + A 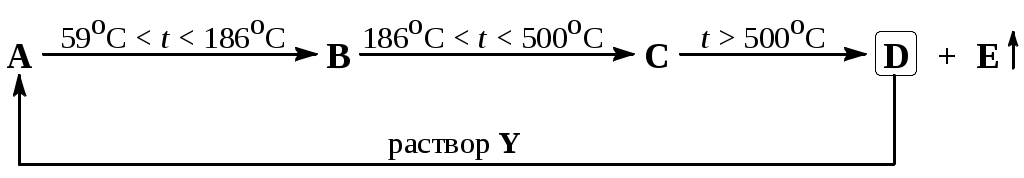 E + Cуголь F + G G + Cl2 L L + E M Задача 9-3 Содержание элемента А в земной коре по данным различных исследователей составляет от 7,45 до 8,14 %. Природный A состоит практически полностью из единственного стабильного изотопа nA, со следами n–1A, радиоактивного изотопа с периодом полураспада 720 тыс. лет. Простое вещество А впервые было получено в 1825 году Гансом Эрстедом, который пропускал хлор через раскалённую смесь оксида А с углём, а образовавшиеся кристаллы нагревал с амальгамой калия. В 1855 г. французский химик Анри Этьенн Сент-Клер Девиль разработал первый промышленный способ получения А, основанный на взаимодействии натриевой соли его тетрахлорокомплекса с металлическим натрием. Но уже в 1886 г американцем Чарльзом Холлом и французом Полем Эру независимо друг от друга были разработаны основы метода, с помощью которого это вещество получают в промышленности до сих пор! Простое вещество А – лёгкий, серебристо-белый металл, обладающий высокой тепло- и электропроводностью, легко поддающийся формовке, литью, механической обработке. При нормальных условиях стоек по отношению к коррозии и к действию концентрированных азотной и серной кислот, но легко растворяется в этих кислотах при нагревании или разбавлении их водой. Продукты взаимодействия А с серой и углеродом (эти реакции идут при нагревании) взаимодействуют с водой с образованием студенистого белого осадка и газов. Металл А взаимодействует и со щелочами. В ходе проведённых в лаборатории экспериментов обнаружено, что растворение 0,675 г металла А в 100 мл 1 М раствора гидроксида натрия привело к выделению 0,840 л газа в пересчёте на н. у. Вопросы: 1. Установите металл А. Воспользовавшись данными по растворению металла в растворе щёлочи, подтвердите ответ расчётом. 2. Напишите уравнения реакций получения металла А, проведённых Эрстедом и Девилем, а также реакции металла со щёлочью. Опишите (схематично) суть метода, предложенного Холлом и Эру. 3. Напишите уравнения реакций, которыми охарактеризованы химические свойства А и его соединений в условии. Всего 8 реакций. 4. Какое место по его распространённости в земной коре занимает элемент А: а) среди металлов; б) среди всех элементов? Напишите уравнение радиоактивного распада изотопа n–1A, зная, что при его распаде образуется позитрон. Во сколько раз уменьшается содержание этого изотопа в образце каждые 2 млн. 160 тыс. лет? Раствор, полученный растворением 0,675 г А в 100 мл 1 М NaOH, подвергли дальнейшим лабораторным испытаниям. В охлаждённый до 0 C раствор пропустили избыток углекислого газа, в результате чего образовался насыщенный раствор вещества Б и выпал белый осадок 1. Осадок 1 отфильтровали и несколько раз прокалили до постоянной массы при разной температуре. Его масса после прокаливания при 250 C составила 2,454 г (полученный остаток обозначим цифрой 2), после прокаливания при 600 C – 2,229 г (остаток 3), после прокаливания при 1200 C – 1,833 г (остаток 4) и осталась равной 1,833 г после прокаливания при 2000 C. 5. Воспользовавшись результатами экспериментов по прокаливанию, определите качественный состав осадка 1 и остатков 2–4. Назовите Б и рассчитайте его молярную концентрацию в насыщенном при 0 C растворе (объём раствора можно считать постоянным). Напишите уравнения реакций, проведённых в ходе лабораторных испытаний. Задача 9-4 Элемент X играет важнейшую роль в процессах жизнедеятельности всех живых организмов. Соединения этого элемента составляют существенную часть костной ткани и зубной эмали человека. Среди продуктов питания по содержанию Х наиболее богата рыба. Этот элемент входит в состав многих минеральных удобрений. Для получения вещества А, образованного элементом Х, в промышленности минерал B нагревают при высокой температуре ( | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Вещество | Формула | Q, кДжмоль–1 |
| Метан | CH4 (г) | 74,81 |
| Пропан | C3H8 (г) | 103,9 |
| Бутан | C4H10 (г) | 126,2 |
| Октан | C8H18 (ж) | 249,9 |
| Этанол | C2H5OH (ж) | 277,7 |
| | CO2 (г) | 393,5 |
| | H2O (ж) | 285,8 |
| Безводная соль | Содержание элементов (% по массе) | |
| Na | Ж | |
| Д | 36,48 | 25,44 |
| Е | 58,92 | 41,08 |
Попытки получить крайне нестабильную кислоту В подкислением соляной кислотой водного раствора соли А безуспешны и приводят к образованию осадка Ж и выделению газа З с резким запахом (реакция 3), поэтому для получения В используют безводные среды и низкую температуру.
При добавлении к водному раствору Б избытка соляной кислоты на холоду ( 10 C) удаётся получить Г в виде маслянистой жёлто-оранжевой жидкости (реакция 4), которая, однако, довольно быстро разлагается (реакция 5): она мутнеет и наблюдается выделение отвратительно пахнущего ядовитого газа И с плотностью по аммиаку 2,0.
1. Определите вещества А – И. Приведите их названия.
2. Напишите уравнения описанных в задаче реакций 1–5.
3. Раствор соли А широко используется в аналитической химии в количественном анализе (иодометрическое титрование). Запишите уравнение реакции, лежащей в основе этого метода (взаимодействие с иодом). Как изменится состав продуктов реакции при замене иода на хлор (приведите уравнение реакции)?
4. Напишите уравнения реакций, происходящих при добавлении избытка раствора 1) соли Б; 2) соли Е к растворам: а) хлорида железа(III); б) хлорида сурьмы(III) (реакции 6–9).
Задача 10-3
Газовые смеси А и В имеют плотность по водороду 18 и содержат в своём составе по два компонента в равных мольных соотношениях. При поджигании смеси А электрическим разрядом образуется такой же объём смеси В (реакция 1). При пропускании А и В над раскалённым углём плотность обеих смесей по водороду уменьшается до 14, а объём увеличивается в 1,5 раза (реакции 2, 3). Известно, что один из компонентов газовой смеси А взаимодействует с оксидом иода(V) (реакция 4), а в смеси В присутствует газ, вызывающий помутнение известковой воды (реакция 5), но не обесцвечивающий раствор перманганата калия.
1. Определите составы смесей А и В, напишите уравнения всех описанных реакций (1–5).
2. Изобразите структурные формулы молекул компонентов газовых смесей А и В.
3. Как можно получить каждый компонент смесей А и В в лаборатории? Приведите уравнения соответствующих реакций (по одному способу для каждого из компонентов с указанием условий их проведения).
4. Напишите уравнения реакций (с указанием условий их проведения), происходящих при взаимодействии более лёгкого компонента смеси А с гидроксидом натрия (реакция 6) и более тяжёлого компонента этой смеси с амидом натрия (реакция 7).
5. Напишите уравнения реакций, происходящих при сжигании магниевой ленты в атмосфере смеси В (реакции 8, 9)
Задача 10-4
Озоновый слой в атмосфере Земли
Озоновый слой в атмосфере Земли представляет собой естественный ультрафиолетовый фильтр, который поглощает опасное ультрафиолетовое излучение Солнца до того, как оно достигнет поверхности Земли. Уменьшение содержания озона в атмосфере может привести к опасным последствиям для жизни на Земле. Озон содержится в основном в стратосфере на высоте от 15 до 50 км с максимальной концентрацией на высоте около 25 км.
В 1930 г английский учёный С. Чепмен предложил механизм образования атмосферного озона, состоящий из четырёх реакций (так называемый цикл Чепмена):
1. O2 + h
2. O + O2 + M
3. O3 + h
4. O3 + O
Поглощением ультрафиолетового излучения в реакции 3 объясняются защитные свойства озонового слоя. Молекула M может быть любой молекулой, находящейся в атмосфере (чаще всего N2).
В результате протекания этих реакций устанавливается стационарное состояние, и концентрация озона в атмосфере поддерживается приблизительно постоянной. Содержание озона в стратосфере изменяется в зависимости от географической широты и времени года, но в среднем не превышает нескольких частей на миллион (ppm). Хотя такая концентрация кажется малой, она достаточна для того, чтобы задерживать 95–98 % ультрафиолетового излучения Солнца.
Справочные данные:
Энергия света равна
Концентрация [M] на высоте 25 км составляет приблизительно 1018 молекулсм–3.
Значения констант скорости на этой высоте приведены рядом с реакциями.
Экспериментально установленное значение [O3] / [O2] составляет около 10 ppm.
Вопросы:
1. Рассчитайте максимальную длину волны солнечного света, способного вызывать диссоциацию молекул кислорода по реакции 1, если энергия связи в молекуле кислорода равна 498 кДж/моль.
2.Используя приведённый выше механизм, объясните (качественно), почему концентрация озона изменяется по высоте немонотонно и проходит через максимум.
3. Объясните, для чего в реакции 2 необходимо присутствие молекулы М.
4. Известно, что температура в стратосфере выше, чем в тропосфере. Температура в стратосфере увеличивается от приблизительно –60 С на нижней границе до приблизительно 0 С на верхней границе. Объясните, почему цикл Чепмена приводит к повышению температуры стратосферы. Какие реакции играют в этом главную роль? Почему?
5. Используя кинетический закон действующих масс, запишите выражения для скорости каждой реакции в цикле Чепмена. Считая концентрации O и O3 стационарными (то есть полагая, что для каждого из них скорость образования равна скорости распада), выведите выражение для отношения [O3] / [O2].
6.Используя выведенное выражение, рассчитайте отношение [O3] / [O2] на высоте 25 км над поверхностью Земли. Сравните рассчитанное значение [O3] / [O2] с экспериментально установленной величиной. Объясните, почему они различаются.
Задача 10-5
Из школьного курса химии хорошо известно, что близость химических свойств щелочных металлов обусловлена сходством электронного строения их атомов. Поэтому если в какой-нибудь химической реакции в качестве одного из реагентов требуется использовать, например, раствор щёлочи, мы обычно не задумываемся над тем, будет ли это гидроксид натрия или калия. Тем не менее, есть примеры реакций, направление которых существенным образом зависит от того, какой именно катион (натрий или калий) будет входить в состав исходного реагента. Одним из таких примеров является реакция Кольбе–Шмидта, широко используемая в промышленности для синтеза самых разных соединений. Ниже Вашему вниманию предлагается схема получения известного лекарственного препарата (соединение Х) и консерванта (соединение Y).
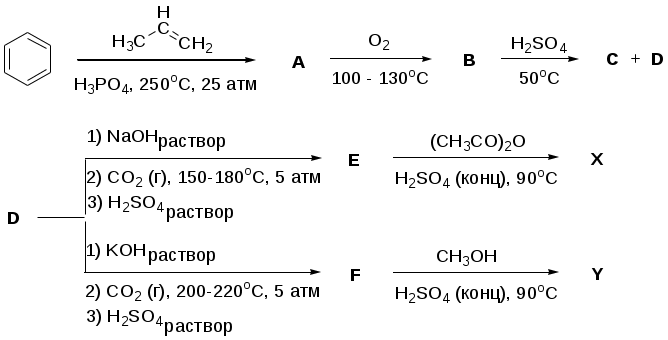
Дополнительно известно:
Соединение B является неустойчивым промежуточным продуктом;
C является ценным растворителем, используется для хранения и транспортировки ацетилена (в 1 л C растворяется до 250 л ацетилена), молекулярная масса C меньше, чем D;
Соединения E и F являются изомерами, причём в молекуле E образуется внутримолекулярная водородная связь, а в молекуле F – нет.
Приведите структурные формулы соединений А–F, Х и Y.
Одиннадцатый класс
Задача 11-1
Неорганические соединения А, B, C, D, E, F, G, Н состоят из металла X и неметалла Y (содержание металла приведено в таблице). Все они – твёрдые вещества.
Таблица 1 Содержание металла в соединениях B–Н
| Вещество | (Х), % | Цвет |
| B | 89,26 | бледно-жёлтый |
| C | 94,32 | коричнево-красный |
| D | 80,60 | золотисто-коричневый |
| E | 98,31 | бронзовый |
| F | 97,08 | фиолетовый |
| G | 96,14 | тёмно-зелёный |
| Н | 96,82 | фиолетово-голубой |
А взаимодействует с газом М (Dвозд.= 0,9655), при этом выделяется газ N (Dазот= 1,1429) и образуется вещество К, масса которого составляет 90,06 % от исходной навески А. Если растворить К в воде и добавить хлорную кислоту, то выделяется газ L и выпадает осадок Т.
1. Определите зашифрованные буквами вещества.
2. Напишите уравнения реакций.
3. Будут ли соединения B, C и D реагировать с газом L? Напишите уравнения соответствующих реакций.
4. Как получают соединения A, B, C и D?
5. Каким образом был открыт элемент Х?
Задача 11-2
Юный химик Юра Б., разбирая старый захламлённый шкаф, на полке с простыми и бинарными веществами нашёл четыре красивых банки без этикеток, в которых находились вещества различных оттенков красного цвета. «А где же этикетки?» – с досадой подумал будущий учёный. «Не выкидывать же – значит нужно узнать, что это?» – проблеснула мысль у Юры.
Будучи аккуратным и педантичным молодым человеком, Юра подписал банки буквами латинского алфавита от A до D, а все свои действия последовательно записал в лабораторный журнал. Вот, что можно там найти:
Вещество А. Вещество красновато-коричневое. Небольшое количество вещества растворили в концентрированной азотной кислоте при небольшом нагревании. Наблюдали выделение бурого газа и образование прозрачного раствора A1. 0,1 М раствором гидроксида натрия pH раствора довели до 10. К части полученного раствора добавили нитрат серебра – выпал жёлтый осадок. К другой части раствора добавили несколько капель молибденовой жидкости – выпал яркий жёлтый осадок. Ура! Загадка №1 решена.
Вещество В. Вещество насыщенно красно-оранжевого цвета и высокой плотности. Вещество обработали азотной кислотой. Выделение газа не наблюдалось. В результате получили прозрачный раствор и тяжёлый коричневый осадок. Осадок отфильтровали. К фильтрату по каплям приливали 10 %-ный раствор соляную кислоту. В результате выпал белый осадок, который растворяется в концентрированной соляной кислоте. На коричневый осадок подействовали концентрированной соляной кислотой – выделился противный зеленоватый газ. Небольшое количество коричневого осадка прокалили – опять получили В. Всё понятно!
Вещество С. Вещество светло-красное, рассыпчатое. Небольшое количество вещества обработали азотной кислотой – выделился бурый газ, образовался бесцветный раствор С1 и выпал белый осадок С2. Осадок отфильтровали. Фильтрат С1 даёт белый осадок при добавлении раствора хлорида бария. Осадок С2 растворяется в концентрированной соляной кислоте. Если к осадку С2 добавить цинка и соляной кислоты, то выделяется неприятно пахнущий газ, который разлагается с образованием серого зеркала. Вопрос решён!
Вещество D. Вещество киноварно-красного цвета. Небольшое количество вещества растворили в азотной кислоте – выделился бурый газ, образовался бесцветный раствор D1. Через полученный раствор D1 пропустили SO2 – опять образовалось киноварно-красное вещество D. Что же это может быть?
Попробуйте и Вы разгадать, что юный химик Юра нашёл в шкафу.
Вопросы.
1. Определите вещество A. Напишите уравнения реакций, которые помогли Юре определить вещество А. Что наблюдал бы Юра, если раствор, полученный после растворения вещества А, не был бы доведён до рН 10? Что такое молибденовая жидкость?
2. Определите вещество B. Напишите уравнения реакций. Какова степень окисления металла в данном соединении?
3. Определите вещество С. Какова роль цинка и соляной кислоты? Напишите уравнения реакций.
4. Определение вещества D вызвало трудности у Юры. Что может являться веществом D? Напишите уравнения реакций. Как можно подтвердить Ваше предположение?
Задача 11-3
Правило Зайцева – термодинамический или кинетический контроль?
Смесь изомерных несимметричных алкенов – B и C – получена в результате превращений:
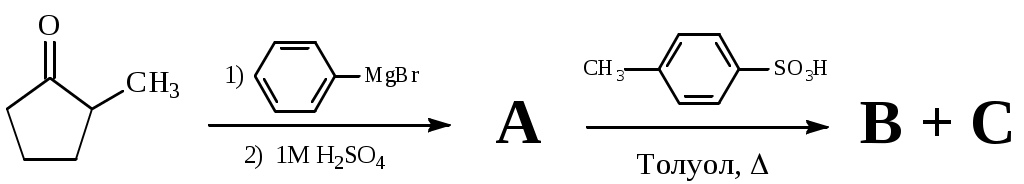
B – менее замещённый алкен.
1. Изобразите структуры веществ A, B и C (без стереохимии).
Вторую стадию – обратимую каталитическую дегидратацию вещества A – можно описать с помощью кинетической схемы:
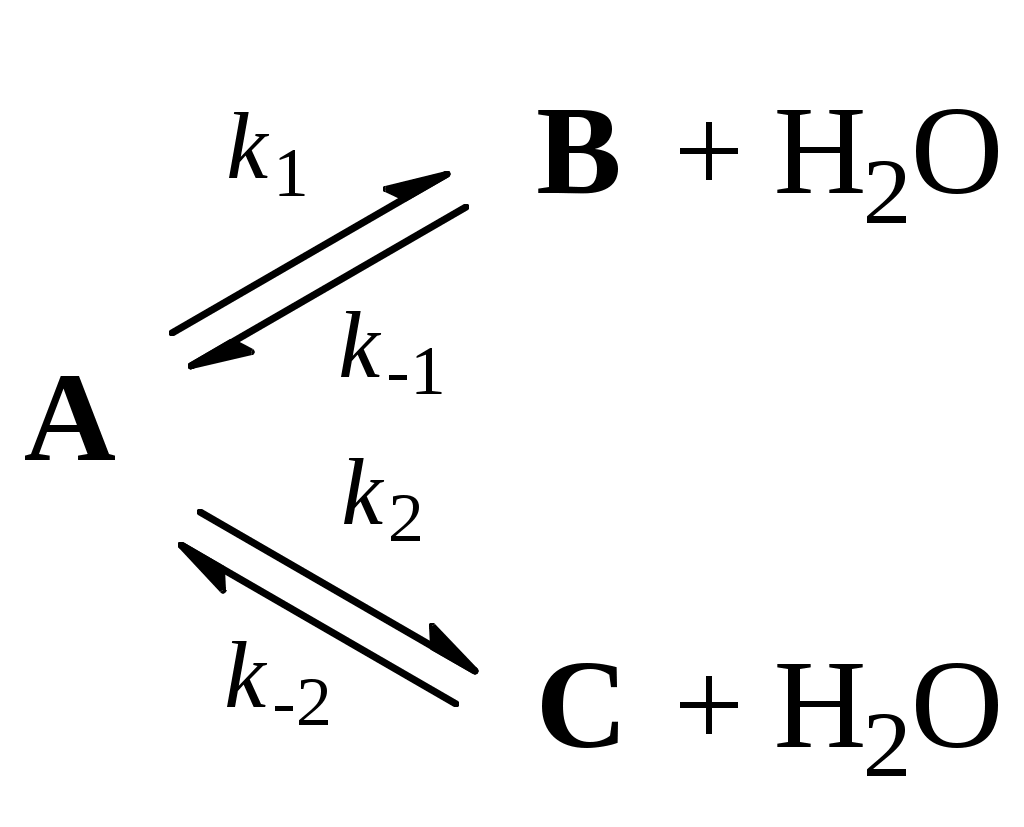
2. Найдите связь между константой равновесия K1 реакции A ⇄ B и константами скорости отдельных стадий.
3. Используя кинетический закон действующих масс, выразите скорости образования веществ B и C через концентрации участвующих в реакции веществ. Определите, чему равно отношение [B] / [C]: а) в начале реакции, когда обратными реакциями можно пренебречь; б) в конце реакции, когда устанавливается равновесие между реагентом и продуктами.
4. При 60 °С в начале реакции содержание B в смеси изомеров составляет 55 %, а через 2 ч, когда состав смеси перестаёт меняться, доля B снижается до 9 %. Какой принцип – кинетический или термодинамический – определяет в данном случае правило Зайцева для преимущественного образования несимметричных алкенов? Кратко объясните.
5. При 70 °С содержание B в начале и в конце реакции составляет 50 % и 11 % соответственно. Определите, чему равны значения E1 и H (в кДж/моль) на изображённой ниже энергетической диаграмме.
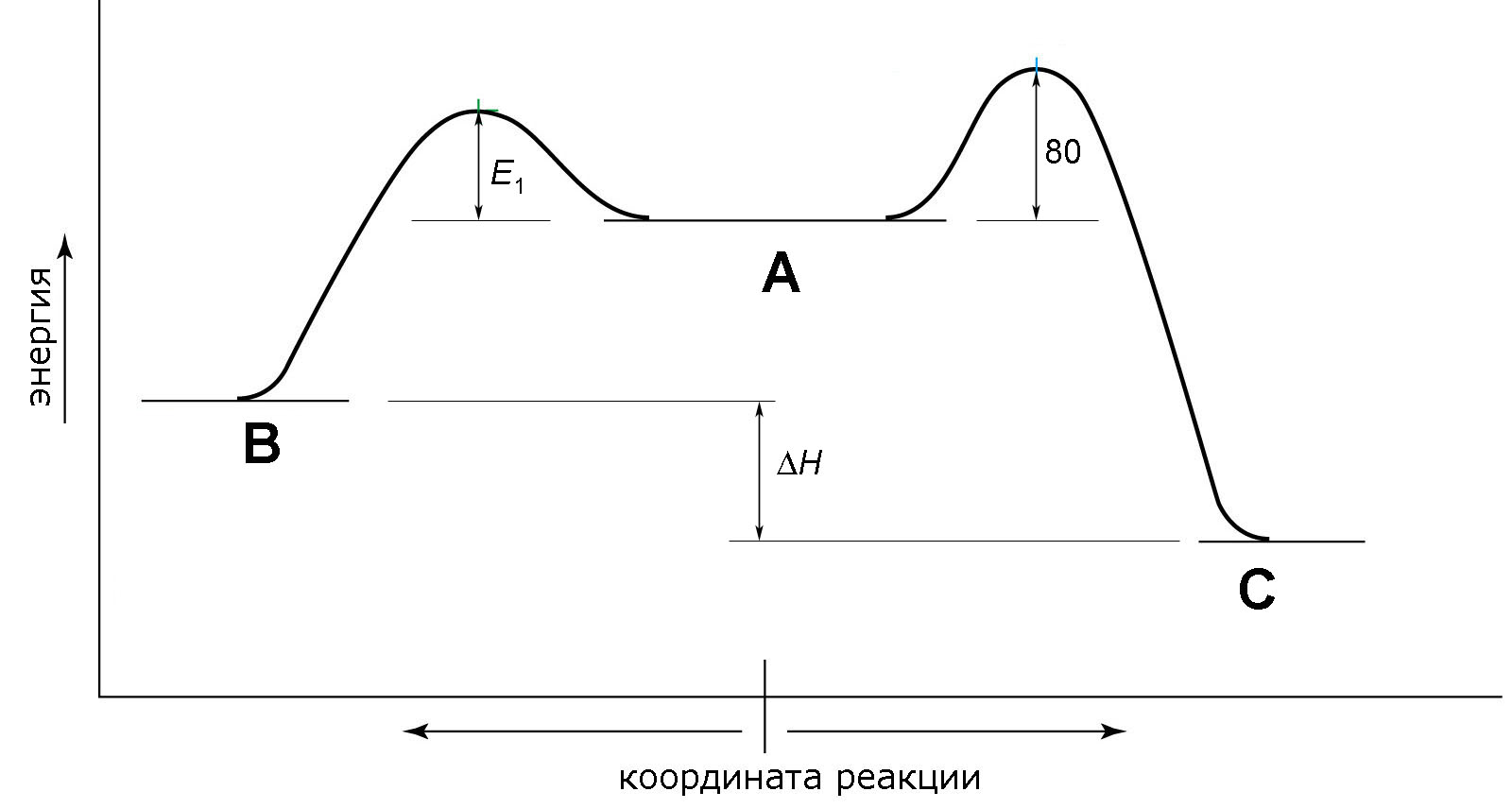
Необходимые уравнения:
Зависимость константы скорости от температуры: ln k = const – E/RT.
Зависимость константы равновесия от температуры: ln K = const – H/RT.
Задача 11-4
В органических соединениях связи углерод-углерод и углерод-гетероатом являются ковалентными полярными или (в случае симметричных молекул типа R–R) ковалентными неполярными. Электроны, образующие ковалентную полярную связь, неравномерно распределяются между атомами: более электроотрицательный атом удерживает электроны лучше, чем менее электроотрицательный. Поэтому в метилгалогенидах атом углерода несёт частичный положительный заряд, а в метиллитии и других соединениях со связью H3C–металл, – частичный отрицательный заряд. Первое металлоорганическое соединение со связью С–металл было получено в 1849 г. Э. Франклендом, который пытался удалить атом иода из этилиодида цинком, но получил бесцветную жидкость, которая бурно реагировала с водой.
1. Напишите структурную формулу соединения, полученного Франклендом, если известно, что массовое содержание углерода в нём составляет 38,9 %.
С тех пор реакции металлоорганических соединений активно изучались в Германии Э. Франклендом, во Франции Ф. Барбье, а в России школой Бутлерова. Так, в 1874 г. А. Зайцев и Е. Вагнер писали: «Действием цинка на смесь иодистого этила с муравьиным этиловым эфиром мы получили …<X>».
2. Напишите структурную формулу Х, если известно, что это соединение содержит 68,2 % углерода и 13,6 % водорода (по массе).
Чуть ранее Франкленд изучал реакцию избытка диэтилцинка с диэтиловым эфиром щавелевой кислоты и нашёл, что после гашения реакционной смеси водой образуется соединение Y, содержащее 60,0 % углерода и 10,0 % водорода.
3. Напишите структурную формулу соединения Y.
На основании этих и других данных был сделан вывод, что цинкорганические соединения проявляют высокую селективность, реагируя с альдегидами, кетонами и активированными сложными эфирами, но не реагируя с обычными сложными эфирами. Ученик Барбье, В. Гриньяр предложил использовать вместо цинка магний. Получаемые магнийорганические соединения (реактивы Гриньяра) существенно активнее и реагируют со всеми типами соединений, содержащих связь С=О. Например, при взаимодействии галогеналкана А, содержащего 22,0 % углерода по массе и имеющего в масс-спектре пик молекулярного иона в виде двух сигналов с интенсивностью 1 : 1, с магнием в эфире получили раствор соединения В, содержание водорода в котором равно 3,75 %. Раствор разделили на две равные части и ввели в реакцию с СО2. При этом половину раствора медленно вылили на «сухой» лёд и после нейтрализации получили вещество C. Ко второй половине раствора медленно добавили «сухой» лёд, а после гидролиза выделили вещество D. При обработке 3,7 г C одним эквивалентом В выделилось 1,12 л газа (н. у.). При обработке D раствором В и последующем гидролизе образуется соединение E. Вещества D и E можно получить и из C следующим способом. Вещество А обрабатывают водным раствором NaOH, получая вещество F, которое при кипячении с C в присутствии каталитических количеств H2SO4 даёт вещество G. Обработка G одним эквивалентом В приводит к образованию D, а двумя эквивалентами – к E.
4. Напишите структурные формулы соединений A–G.
Задача 11-5
Принципы ферментативного катализа. Трипсин
Ферменты – это белки, которые представляют собой высокоэффективные специфические катализаторы химических реакций, протекающих в живой клетке. Между ферментативным и химическим катализом принципиальных различий нет, химические механизмы реакций, лежащих в их основе, сходны. Для упрощения полагают, что с субстратом (веществом, которое превращается) взаимодействует не весь фермент, а только его активный центр – часть белковой молекулы, часто расположенная на поверхности фермента, и иногда имеющая форму щели или впадины. Активный центр состоит из зоны связывания субстрата и собственно зоны катализа. Зона связывания ответственна за выбор субстрата, его закрепление и правильную ориентацию относительно каталитического центра. При этом субстрат взаимодействует с ферментом за счёт разного типа нековалентных взаимодействий, а именно электростатических, Ван-дер-Ваальсовых, водородных и др. Функциональные группы аминокислот каталитического центра непосредственно участвуют в превращении субстрата.
1. а) За счёт изменения каких параметров реакции (температура, энергия активации, давление, путь реакции, объём) катализатор увеличивает скорость реакции? б) Для реакции разложения пероксида водорода рассчитайте, во сколько раз эффективность (увеличение скорости реакции) фермента каталазы больше, чем мелкодисперсной платины, если энергия активации:
без катализатора 18 ккал/моль
катализируемая платиной 12 ккал/моль
катализируемая ферментом 5,6 ккал/моль
Уравнение Аррениуса для константы скорости реакции k = A·exp(–EA/RT). 1 кал = = 4,184 Дж. Считать, что температура равна 300 К, R = 8,31 Дж/(моль·К) и что для одной и той же реакции значение параметра А одинаково. Написать уравнение реакции.
Трипсин – это фермент, катализирующий гидролиз пептидных связей в белках. Он гидролизует связи, образованные карбоксильной группой аминокислот лизина (Lys) и аргинина (Arg). Дан небольшой пептид (запись по номенклатурным правилам осуществляется от N-конца пептида к его С-концу):
Arg-Ala-Leu-Gly-Lys-Ala-Arg-Gly-Gly-Lys
2. а) Напишите все пептиды, которые получаются из данного пептида при его частичном гидролизе трипсином. б) Как можно добиться того, чтобы гидролиз прошёл не полностью?
Лизин в боковом радикале содержит аминогруппу:

3.Если боковую аминогруппу лизина модифицировать, например ацилировать, будет ли трипсин гидролизовать связи в пептидах после модифицированного лизина? Почему?
4. Напишите продукты реакции аминокислоты лизина со следующими реагентами:
а) 2,4-динитрофторбензол, б) R–C(O)H, в) малеиновый ангидрид (в щелочной среде),
г) C2H5–S–CO–CF3, д) KNCO, е)
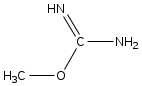
5. Сколько пептидов получится из пептида, указанного в вопросе 2, при модификации всех лизинов 2,4-динитрофторбензолом и последующем неполном гидролизе трипсином?
6. Перечислите те аминокислоты из указанных ниже, которые могут входить в зону связывания трипсина. Обоснуйте своё предположение.
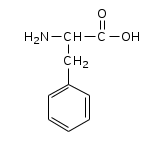 | 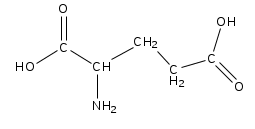 | 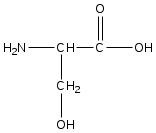 | 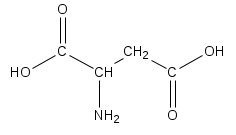 |
| Фенилаланин | Глутаминовая кислота | Серин | Аспарагиновая кислота |
7. Расшифруйте вещества A, B и С в цепочке превращений, если известно, что в составе вещества А (C) = 71,64 %, и оно даёт реакцию серебряного зеркала, реакция получения вещества А протекала в мягких условиях, а борную кислоту используют для стабилизации вещества В.
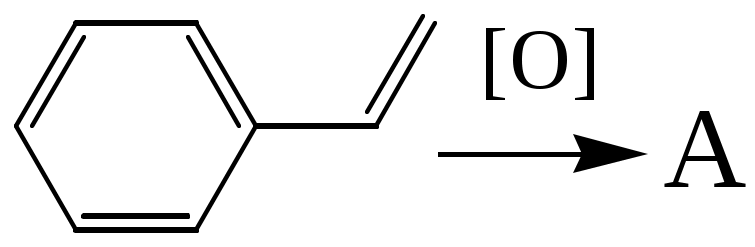 ; ; | 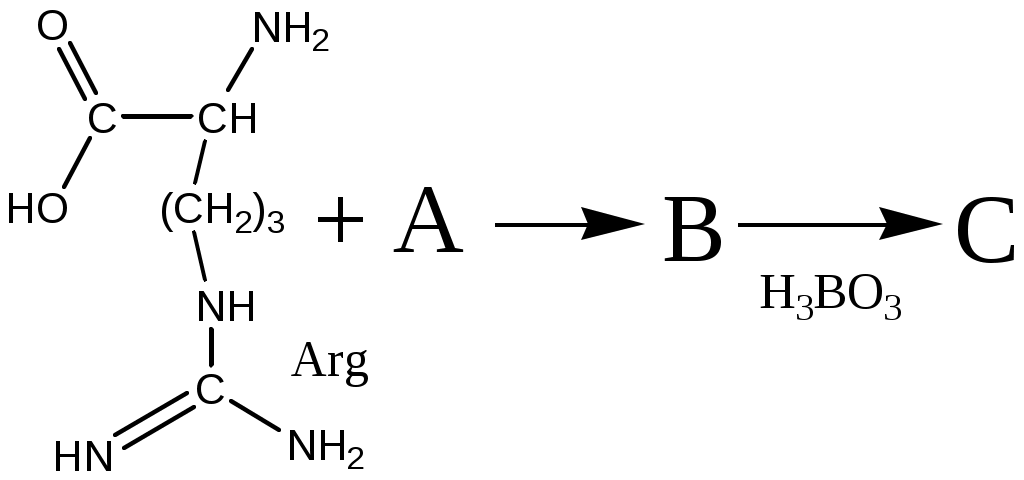 |
