ответы на лабораторные по химии. ответы по химии. Задача химии. Значение химии
 Скачать 270 Kb. Скачать 270 Kb.
|
, ОН"). Иногда роль лигандов играют молекулы, не содержащие неподеленных пар электронов, но имеющие электроны, участвующие в образовании л-связи. Донорные свойства лигандов реализуются за счет s- и р-атомных орбиталей, а акцепторные— за счет вакантных р- и d-орбиталей.  В – донорно-акцепторный механизм. В – донорно-акцепторный механизм.Вопрос 8. σ-, π-, δ- связь. В зависимости от направления перекрывания атомных орбиталей различают σ-, π- и δ-связи. σ-Связь возникает при перекрывании атомных орбиталей вдоль оси, соединяющей ядра взаимодействующих атомов (рис. II.4). Простейший случай σ-связи наблюдается у молекулы Н2, образующейся за счет перекрывания s-орбиталей атомов водорода (рис. II.4,а). Вследствие сферической формы s-орбиталей два s-электрона могут образовывать только такую связь, при которой перекрывание атомных орбиталей происходит вдоль оси, соединяющей ядра атомов. σ-Связь может возникнуть также при перекрывании s- и р-орбиталей (рис. 11.4,6), двух р-орбиталей (рис. 11,4, в), двух d-орбиталей (рис. II.4, г) d- и s-орбиталей и d- и р-орбиталей. σ-Связь возникает, если атомные р- и d-opбитали ориентированы вдоль оси связи. 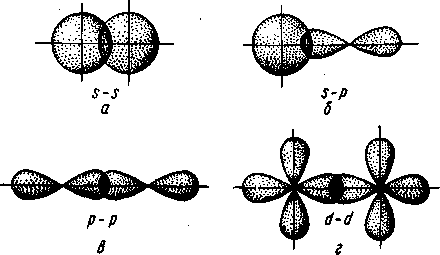 Рис. II.4. Перекрывание различных электронных облаков при образовании σ–связи π-Связь осуществляется при перекрывании атомных орбиталей по обе стороны оси, соединяющей ядра атомов. При взаимодействии двух р-орбиталей (рис. II.5, а), расположенных перпендикулярно оси, соединяющей ядра атомов, возникают две области перекрывания. Соответственно π-связь характеризуется двумя областями перекрывания, расположенными по обе стороны оси, соединяющей ядра атомов. π-Связь также может образоваться при перекрывании р- и d-орбиталей (рис. 11.5,6) или двух d-opбиталей (рис. П.5,в). δ-Связь возникает при перекрывании двух d-орбиталей, расположенных в параллельных плоскостях (рис. II.6). Таким образом, s-электроны могут участвовать лишь в образовании σ-связи, р-электроны — в образовании σ- и π-связей, a d-электроны — как в образовании σ- и π-связей, так и δ-связей. Еще более разнообразны способы взаимодействия f-электронов. π- и δ-Связи налагаются на σ-связи, вследствие чего образуются двойные и тройные связи. Число связей, образующихся между атомами, называется кратностью (порядком) связи. С увеличением кратности (порядка) связи изменяется длина связи и ее энергия. Энергия двойной связи не увеличивается в два раза, а энергия тройной связи не увеличивается в три раза по сравнению с энергией одинарной связи. Это обусловлено разницей в энергии σ- и π-связей. 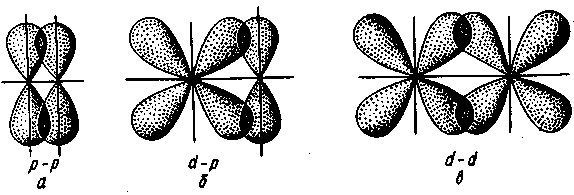 Рис. II.5. Перекрывание электронных облаков при образовании π-связи   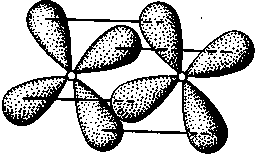 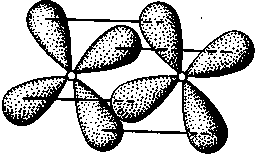 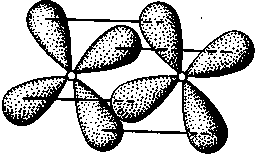 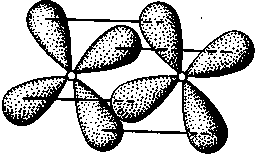 Рис. II.6. Перекрывание электронных облаков при образовании б-связи Рис. II.6. Перекрывание электронных облаков при образовании б-связи Рис. II.6. Перекрывание электронных облаков при образовании б-связи Рис. II.6. Перекрывание электронных облаков при образовании б-связи Рис. II.6. Перекрывание электронных облаков при образовании б-связи Рис. II.6. Перекрывание электронных облаков при образовании б-связи Рис. II.6. Перекрывание электронных облаков при образовании б-связи Рис. II.6. Перекрывание электронных облаков при образовании δ-связи Вопрос 9. Ионная связь и ее свойства. Ионная связь осуществляется в результате образования и электростатического взаимодействия противоположно заряженных ионов. Ионная связь может возникать лишь при больших различиях в значениях электроотрицательностей атомов. Так как электрическое поле иона имеет сферическую симметрию, то в отличие от ковалентной ионная связь не обладает направленностью. Взаимодействие двух противоположно заряженных ионов не приводит к полной взаимной компенсации их полей, они сохраняют способность притягивать и другие ионы. Поэтому в отличие от ковалентной ионная связь не обладает насыщаемостью. Из-за отсутствия у ионной связи направленности и насыщаемости каждый ион окружен ионами противоположного знака, число которых определяется размерами и силой отталкивания одноименно заряженных ионов. Поэтому соединения с ионной связью представляют собой кристаллические вещества. Весь кристалл можно рассматривать как единую гигантскую молекулу, состоящую из очень большого числа ионов. Лишь при высоких температурах, когда вещество переходит в газообразное состояние, ионные соединения могут существовать в виде неассоциированных молекул. Ионную связь можно рассматривать как предельную полярную химическую связь, для которой эффективный заряд атома близок к единице. В то же время для неполярной ковалентной связи эффективный заряд атомов равен нулю. Химическая связь большинства соединений является полярной, т. е. имеет промежуточный характер между неполярной ковалентной и ионной связями. Ковалентная связь имеет частично ионный характер. Долю ионного характера связи называют степенью ионности, которая количественно характеризуется эффективными зарядами атомов в молекуле. Степень ионности связи возрастает с увеличением разности электроотрицательности образующих ее атомов. Вопрос 10. Водородная связь и межмолекулярное взаимодействие. Водородная связь. возникает между положительно поляризованным атомом водорода и отрицательно поляризованным атомом с большой электроотрицательностью. Положительно поляризованный атом водорода обладает уникальными свойствами: очень малым размером и отсутствием внутренних электронных слоев, поэтому он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Между двумя молекулами возникает взаимодействие, которое имеет электростатический и частично донорно-акцепторный характер. Водородную связь условно записывают как X—H---Y, где X и Y — атомы F, N, О или S (точками обозначается собственно водородная связь). Энергия и длина водородной связи в значительной мере определяются электрическим моментом диполя связи и размерами атома. Длина связи уменьшается, а энергия водородной связи возрастает с увеличением разности ЭО у атомов X и Y и соответственно электрического момента диполя связи X—Н и с уменьшением размера атома Y. Самая прочная связь образуется между HF. Обычно же энергия водородной связи лежит в пределах 5— 25 кДж/моль, т. е. она больше энергии межмолекулярного взаимодействия, но значительно меньше энергии ковалентной связи. Водородная связь имеет весьма широкое распространение. Она встречается в неорганических и органических соединениях. Водородная связь иногда определяет структуру вещества и заметно влияет на физико-химические свойства. Важную роль играет водородная связь в процессах кристаллизации и растворения веществ, образования кристаллогидратов, ассоциации молекул. Вопрос 11. Комплексные соединения: строение, характер связи, диссоциация. Соединения сложного состава, у которых можно выделить центральный атом (комплексообразователь) и непосредственно связанные с ним молекулы или ионы (лиганды), называются комплексными соединениями. Первые комплексные соединения были синтезированы в середине прошлого века, однако теоретические представления о них стали развиваться после опубликования в 1893 г. швейцарским химиком А. Вернером координационной теории. Большой вклад в химию комплексных соединений внесли русские ученые Л. А. Чугаев, И. И. Черняев и их ученики. По координационной теории Вернера в каждом комплексном соединении различают внутреннюю и внешнюю сферы. Внутреннюю сферу называют комплексом. При написании химических формул комплексных соединений внутреннюю сферу заключают в квадратные скобки. Центральный атом внутренней сферы комплексного соединения, вокруг которого группируются ионы или молекулы, называется комплексообразователем. Частицы, непосредственно связанные с комплексообразователем, называются лигандами. Число лигандов в комплексе называется координационным числом комплексообразователя. Координационное число показывает число мест во внутренней сфере комплексного соединения или число мест вокруг комплексообразователя, на которых могут разместиться лиганды. Координационные числа разных комплексообразователей имеют значения от 2 до 12. Чаще Других встречаются комплексные соединения с координационным числом, равным 4 или 6, затем 8 или 2. Заряд комплекса численно равен суммарному заряду внешней сферы и противоположен ему по знаку. Различают катионные, анионные и нейтральные комплексы. Комплекс с положительным зарядом называют катионным, с отрицательным зарядом — анионным, с нулевым зарядом — нейтральным. Заряд комплексообразователя равен и противоположен по знаку алгебраической сумме зарядов всех остальных ионов. Координационная емкость лиганда — число мест, занимаемых каждым лигандом во внутренней сфере комплекса. Лиганды, которые занимают одно координационное место у центрального атома, называют монодентатными. Однако лиганды могут занимать два и более (до восьми) координационных мест за счет образования с комплексообразователем соответствующего числа химических связей. Такие лиганды называются полидентатными. Комплексообразователи. Способность элемента к образованию комплексных соединений относится к важнейшим его химическим свойствам. Она зависит от строения внешнего электронного уровня атома элемента и определяется его положением в периодической системе Д. И. Менделеева. Как правило, комплексообразователями являются атомы или чаще ионы металлов, имеющие достаточное число свободных орбиталей. При образовании химических связей с лигандами комплексообразователи выполняют роль акцепторов. Возможность участия тех или иных орбиталей центрального атома в комплексообразовании меняется от периода к периоду. Способность элементов к комплексообразованию от периода к периоду растет. При последовательном переходе от одного периода к другому растет координационное число элементов. Лиганды. Лигандами в комплексных соединениях могут служить анионы F-, ОН", CN_, SCN-, N0^, С023 ", С2ОтГ и др.; нейтральные молекулы Н20, NH3, CO, NO, F2, N2H4, NH2—СН2— —СН2—NH2 (этилендиамин) и т. д. Почти все лиганды обладают одной или несколькими неподеленными парами электронов (NH3, Н20, F |
