задачи для самост работы. Задачи для самостоятельного решения теме Растворы
 Скачать 34.88 Kb. Скачать 34.88 Kb.
|
Задачи для самостоятельного решения теме «Растворы»Определите парциальный мольный объём азотнокислого аммония в воде, если объём раствора, содержащий 20 г NH4NO3 в 100 г раствора, равен 92,35 см3, а объём растворителя в растворе 80,14 см3. Парциальные мольные объемы воды и метанола в растворе с мольной долей метанола x= 0,4 равны 17,35 и 39,01 см3моль1, соответственно. Рассчитайте объем раствора, состоящего из 0,4 моль метанола и 0,6 моль воды, а также объем компонентов до их смешения. Плотности воды и метанола равны 0,998 и 0,791 гсм3, соответственно. Парциальные мольные объемы воды и этанола в растворе с мольной долей этанола 0,2 равны 17,9 и 55,0 см3моль1 соответственно. Рассчитайте объемы воды и этанола, необходимые для приготовления 1 дм3 такого раствора. Плотности воды и этанола возьмите из справочника [1]. Парциальные мольные объемы ацетона и хлороформа в растворе с мольной долей хлороформа 0,469 равны 74,17 и 80,23 см3моль1, соответственно. Рассчитайте объем такого раствора, имеющего массу 1000 г. Общий объем раствора этанола, содержащего 1000 г воды, при 25°С описывается выражением: 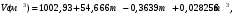 где т - моляльность раствора. Рассчитайте парциальные мольные объемы воды и этанола в растворе, содержащем 500 г этанола в 1000 г воды. Парциальный мольный объем K2SО4 в водном растворе при 25 °С в зависимости от его моляльности m: 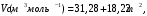 Используя уравнение Гиббса-Дюгема, получите выражение для вычисления парциального мольного объема воды в этом растворе. Мольный объем чистой воды при 25°С равен 18,08 см3моль1 . При 18°С общий объем раствора, образующегося при растворении MgSO4 в 1000 г Н2О, описывается уравнением 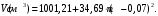 РассчитайтеV компонентов при m = 0,05. Какова должна быть концентрация водного раствора сахара, чтобы давление пара раствора было на 1 % ниже, давления пара чистой воды? Давления пара чистых бензола и толуола при 60oС равны 51,3 и 18,5 кПа соответственно. При каком давлении закипит при 60oC раствор, состоящий из 1 моля бензола и 2 молей толуола? Каков будет состав пара? Константы Генри для кислорода и азота в воде при 0oС равны 2,56104 атм и 5,47104 атм соответственно. Рассчитайте понижение температуры замерзания воды, вызванное растворением воздуха, состоящего из 80 об. % N2 и 20 об. % O2 при давлении 1 атм. Криоскопическую константу воды примите равной 1,86. Давление пара диэтилового эфира при 25оС равно 537 мм рт. ст. Чему равно давление пара над раствором, состоящим из 2 г бензальдегида и 100 г эфира при этой температуре? (Бензальдегид в этих условиях практически не летучий). Определите температуру замерзания раствора, температуру его кипения и давление паров воды над 0,08 m раствором хлоруксусной кислоты при 25°С, если степень её диссоциация при указанных условиях 0,13. Давление пара воды при 25°С равно 23,756 мм рт. ст. Криоскопическая постоянная воды 1,86, эбуллиоскопическая постоянная воды 0,513. Рассчитайте растворимость СО2 в воде при 25°С и 5,065105 Па, если константа Генри 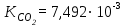 . .Теплота плавления металлического свинца равна 5188,2 Джмоль-1 при температуре плавления 327,5°С. Вычислите температуру замерзания раствора, содержащего 1 мол. % примесей, которые не растворяются в твёрдом свинце. Рассчитайте растворимость антрацена в бензоле при 25°С (m2). Энтальпия плавления антрацена при температуре плавления (217оС) равна 28,85 кДжмоль1. При 30°С давления паров над чистой водой и над водным раствором сахарозы равны 4241,8 и 4159 Па, соответственно. Вычислите осмотическое давление данного раствора. Температура кипения чистого CS2 319,2 К. Раствор, содержащий 0,217 г серы в 1,918 г CS2, кипит при 319,30 К. Эбулиоскопическая постоянная CS2 равна 2,37. Вычислите число атомов, из которых состоит молекула серы, растворённая в сероуглероде. Молярная масса серы 32 гмоль1. Рассчитайте растворимость нафталина в бензоле при 25°C, считая, что они образуют идеальный раствор. Теплота плавления нафталина при температуре его плавления (80,0°C) равна 19,29 кДжмоль1. Рассчитайте растворимость антрацена в толуоле при 25°C, считая, что они образуют идеальный раствор. Теплота плавления антрацена при 217°C (температура его плавления) равна 28,8 кДжмоль1. Рассчитайте температуру, при которой твёрдый кадмий находится в равновесии с жидким раствором Cd-Bi, мольная доля Cd в котором равна 0,846. Энтальпия плавления кадмия при температуре его плавления (321,1°C) равна 6,23 кДжмоль1. При 57,2 °С и давлении 1 атм мольная доля ацетона в паре над его раствором в метаноле равна уА= 0,516 (мольная доля ацетона в растворе 0,40). Рассчитайте активности и коэффициенты активности компонентов данного раствора. Давления пара чистых ацетона и метанола при указанной температуре 786 и 551 Торр, соответственно. ДОМАШНЕЕ ЗАДАНИЕ (тема: «ТЕРМОДИНАМИКА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ»)При температуре 20 °С плотность воды и глицерина составляет 998,2 и 1259,4 кгм-3 соответственно. Определите относительные парциальные мольные объёмы воды и глицерина в растворе, содержащем 5 мол. % глицерина, если плотность такого раствора составляет 1208,3 кгм3. Парциальный мольный объём глицерина в этом растворе составляет 70,92 гмоль1. Раствор гомологов октана, нонана и декана является практически идеальным (совершенным). Определите изменение внутренней энергии, энтальпии, энергии Гиббса, энергии Гельмгольца и энтропии при образовании раствора, содержащего 100 г октана, 10№ г нонана и 50+5№ г декана при температуре 300+2№ К. Зависимость объёма раствора, образованного из 1 кг воды и n2 моль серной кислоты при температуре 293 К, описывается следующим уравнением: 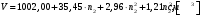 Определите парциальные мольные объёмы воды и серной кислоты в растворе, содержащем 2 кг воды и 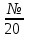 моль серной кислоты. моль серной кислоты.В табл. 6 приведены результаты измерения теплового эффекта образования 1 моля раствора, состоящего из азотной кислоты и воды, при 298 К. Определите парциальные мольные теплоты растворения воды и азотной кислоты во всем интервале концентраций компонентов. Таблица 6
Вычислите эбуллиоскопическую постоянную бензола. Определите температуру начала кристаллизации раствора глюкозы в воде, содержащего 100 г воды и № г глюкозы. Криоскопическую постоянную воды рассчитайте. Определите осмотическое давление водного раствора глицерина при температуре 300+№ К, если молярная доля глицерина составляет 2 %. Во сколько раз больше будет осмотическое давление водного раствора хлорида натрия той же концентрации. Температура начала кипения водного раствора хлорида натрия 100,51°С. Рассчитайте давление паров воды над этим раствором при температуре 30°С. При температуре 293 К над этанолом пропускали смесь воздуха с газообразным бензолом. Определите равновесную массу бензола, растворившегося в 100 г этанола, если парциальное давление бензола в газовой смеси составило 10 мм рт. ст., а константа Генри при данных условиях имеет величину 319,6 мм рт. ст. Для водного раствора азотной кислоты, концентрация которого 30 мол.%, была экспериментально измерена зависимость парциальных давлений азотной кислоты и воды над раствором от температуры. Полученные результаты приведены в табл. 7. Зависимость равновесного давления пара над чистыми компонентами (в мм рт. ст.) от температуры описывается следующими уравнениями: 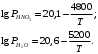 Таблица 7
Постройте график зависимости коэффициентов активности компонентов раствора от температуры в координатах lnγi – 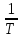 , определите также теплоту смешения чистых компонентов с образованием 1 моль раствора. , определите также теплоту смешения чистых компонентов с образованием 1 моль раствора.11.Используя данные таблицы 20 [1], постройте график в координатах Pi = f(хi) и Р = f(хi), сделайте выводы о характере отклонений от закона Рауля. (№1 вода –метанол, №2 вода-ацетон, №3 вода – диоксан, №4 тетрахлорид – трихлорметан, №5 этанол-бензол, №6 ацетон-диэтиловый эфир. Далее для последующих номеров все повторяется). |
