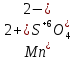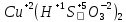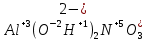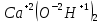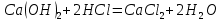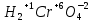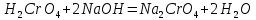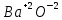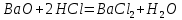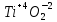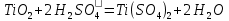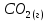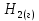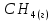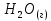многовар, вар11. Задание Охарактеризуйте соединения по приведенным формулам
 Скачать 26.96 Kb. Скачать 26.96 Kb.
|
|
Задание 2.1. Охарактеризуйте соединения по приведенным формулам 2.1.1. Определите степени окисления атомов элементов в соединениях. 2.1.2. Определите класс соединения. Для оксидов и гидроксидов укажите химический характер (основный, кислотный, амфотерный), для солей – тип соли (средняя, кислая, основная), для кислот – тип кислоты (кислородсодержащая или бескислородная). 2.1.3. Назовите соединения. 2.1.4. Подтвердите химический характер оксидов и гидроксидов (составьте уравнения реакций солеобразования).
Задание 4.2. Дайте термодинамическую характеристику реакции  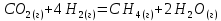 на основании количественных расчетов 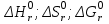 . .4.2.1. Стандартные термодинамические свойства веществ, участвующих в реакции:
4.2.2. Рассчитаем стандартную энтальпию химической реакции. Определим, является реакция экзо- или эндотермической, выделяется или поглощается теплота в результате протекания реакции: Изменение энтальпии химической реакции рассчитываем по формуле из следствия закона Гесса: 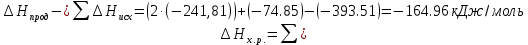 В ходе реакции энергия выделяется ∆Н < 0, реакция экзотермическая. Выделение тепла вызывает повышение температуры. 4.2.3. Рассчитаем стандартную энтропию реакции, объяснить изменение энтропии, проведя анализ агрегатного состояния всех участвующих в реакции веществ и сравнив число газообразных молекул исходных веществ и продуктов реакции: Изменение стандартной энтропии химической реакции рассчитываем по формуле из следствия закона Гесса: 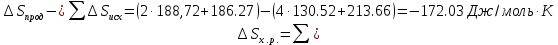 В ходе реакции энтропия уменьшается, что можно объяснить тем, что в ходе реакции число молей газообразных веществ уменьшается, что ведет к увеличению упорядоченности системы. 4.2.4. Рассчитайте стандартную энергию Гиббса по стандартным энергиям Гиббса образования веществ и по уравнению Гиббса. Сравните полученные величины. Укажите направление протекания реакции. Определить знак энергии Гиббса и направление протекания реакции при низких температурах, при высоких температурах. Изменение стандартной энергии Гиббса химической реакции рассчитываем по формуле из следствия закона Гесса: 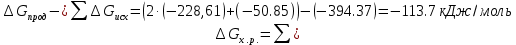 По уравнению Гиббса: 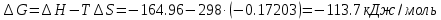 Отрицательный знак изобарного потенциала (∆G< 0) свидетельствует о возможности протекания реакции в стандартных условиях. При низких температурах энергия Гиббса, будет иметь отрицательное значение, и самопроизвольно будет протекать прямая реакция, при высоких температурах энергия Гиббса приобретет положительное значение и станет возможным протекание обратной реакции. 4.2.5. Сделаем вывод об обратимости процесса. Для обратимой реакции рассчитаем равновесную температуру. Учитывая, что знаки энтальпии и энтропии одинаковы, реакция является обратимой. Рассчитаем равновесную температуру исходя из уравнения Гиббса. 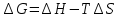 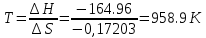 Реально достижимой температурой является температура, не выше 3000 К. Рассчитанная равновесная температура ниже указанного значения, практически реализуема, то есть данная реакция обратима и может протекать и в прямом и в обратном направлении. 4.2.6. Изобразим схематически график зависимости энергии Гиббса от температуры, используя результаты анализа уравнения Гиббса. 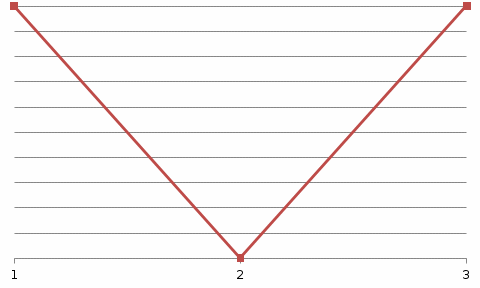 4.2.7. При температурах меньше равновесной протекает прямая реакция, при температуре, больше равновесной будет протекать обратная реакция. Задание 5.1. Дайте кинетическую характеристику реакции  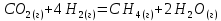 5.1.1. Определите тип прямой и обратной реакции по фазовому состоянию реагирующих веществ. Поскольку все вещества и исходные, и продукты реакции, газообразные, реакция является гомогенной. 5.1.2. Напишем выражение скорости для прямой и обратной реакции, в соответствии с законом действующих масс. 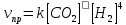 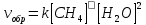 5.1.3. Рассчитаем, как изменится скорость прямой реакции при увеличении: -концентрации первого вещества в три раза: 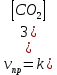 При увеличении концентрации углекислого газа в три раза скорость реакции возрастает в 3 раза. -давления в системе в два раза: При увеличении давления в два раза, концентрация каждого из веществ в системе также увеличивается в два раза: 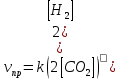 При увеличении давления в системе в два раза скорость реакции возрастает в 32 раза. -температуры на 20К при температурном коэффициенте равном 3,9 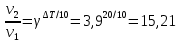 Повышение температуры в системе на 20 градусов приведет к увеличению скорости реакции в 15,21 раз. Задание 5.2. Для обратимой химической реакции охарактеризуйте состояние химического равновесия и возможность его смещения. 5.2.1. Напишем выражение для константы химического равновесия. 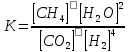 5.2.2. Как следует изменить температуру, давление, концентрацию исходных веществ, концентрацию продуктов реакции, чтобы сместить равновесие в сторону прямой реакции (повысить выход продуктов реакции): Прямая реакция является экзотермической (теплота выделяется), следовательно для смещения равновесия в сторону образования продуктов реакции, температуру следует понизить. В результате протекания прямой реакции число газообразных веществ уменьшается, следовательно, для смещения равновесия в сторону образования продуктов реакции давление необходимо повысить. Для смещения равновесия в сторону образования продуктов реакции концентрацию исходных веществ необходимо повысить, а концентрацию продуктов реакции понизить. Задание 10.1. Металл Ag поместили в водный раствор каждого из электролитов – AuCl3, Hg(NO3)2, ZnSO4. Используя величины стандартных электродных потенциалов металлов и стандартного потенциала водородного электрода, определите возможность взаимодействия металла с электролитами. Напишите молекулярные и электронные уравнения соответствующих реакций. Возможность вытеснения металла из водного раствора соли другого металла и водорода из ряда кислот (восстановительная способность металла в водных растворах электролитов) определяет величина его стандартного электродного потенциала. Чем меньше величина стандартного электродного потенциала металла, тем выше его химическая активность, т. е. восстановительная способность. 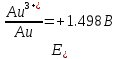 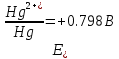 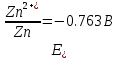 Так как электродный потенциал серебра (+0,799В) меньше, чем у золота, но больше, чем у цинка и ртути, то серебро будет вытеснять золото из растворов его солей, взаимодействие с солями цинка и ртути происходить не будет. 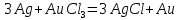 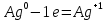 окисление окисление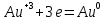 восстановление восстановлениеЗадание 11.1. Металлическая конструкция, в которой контактируют Mn - Pb эксплуатируется во влажном воздухе, содержащем газ H2S 11.1.1. Определите тип коррозии по механизму ее протекания. Тип коррозии – электрохимическая, протекает в среде, имеющую ионную проводимость. 11.1.2. Определите какой из металлов будет корродировать. Стандартный электродный потенциал марганца –(-1,180) В, свинца – (-0,126 В). Потенциал марганца меньше, чем свинца, поэтому анодом является марганец и он будет корродировать. 11.1.3. Укажите реакцию коррозионной среды (кислая, нейтральная или щелочная). Для определения реакции среды рассмотрите возможность взаимодействия газа с водой во влажном воздухе, напишите соответствующее уравнение химической реакции. Во влажном воздухе содержащем газ Н2S реакция среды кислая H2S = 2H+ + S2- 11.1.4. Определите тип деполяризации (водородная или кислородная) для электрохимической коррозии. В кислой среде протекает коррозия с водородной деполяризацией. 11.1.5. Составьте схему коррозионного гальванического элемента. 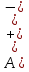 11.1.6. Напишите электронные уравнения электродных процессов. анодный процесс: Mn0 - 2e– = Mn2+ катодный процесс: 2H+ + 2е– =Н20 11.1.7. Напишите уравнение токообразующей реакции, протекающей в элементе. 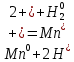 или 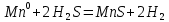 11.1.8. Укажите состав продуктов коррозии. Продуктом коррозии в данной среде является нерастворимая соль сульфида магния. |