экзамен по ттд. Закон Бойля Мариотта
 Скачать 1.13 Mb. Скачать 1.13 Mb.
|
|
Понятие об идеальном газе. Основные законы идеальных газов. Идеальным газом называется газ, в котором отсутствуют силы притяжения или отталкивания между молекулами и не учитывается объем молекул (молекула = мат. точка). Закон Бойля — Мариотта: при постоянной температуре объем, занимаемый идеальным газом, изменяется обратно пропорционально его давлению: 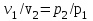 Закон Гей-Люссака: при постоянном давлении объемы одного и того же количества идеального газа изменяются прямо пропорционально абсолютным температурам: 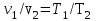 Закон Шарля: для данной массы газа при постоянном объеме давление прямо пропорционально температуре: P1/P2 = T1/T2 Универсальное уравнение состояния идеального газа. Универсальная газовая постоянная. 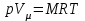 - уравнение Менделеева – Клайперона - уравнение Менделеева – Клайперона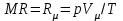 Произведение M·R называют универсальной (молярной) газовой постоянной Универсальная газовая постоянная Rm есть работа 1 моль идеального газа в процессе при постоянном давлении и при изменении температуры на 1°. Уравнение состояния Ван-дер-Ваальса. Ван-дер-Ваальс ввел две поправки первая поправка, зависящая от объема самих молекул 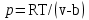 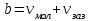 b – наименьший объем до которого можно сжать газ. Вторая поправка учитывает влияние сил взаимодействия между молекулами Поправка Δp прямо пропорциональна как числу притягиваемых, так и числу притягивающих молекул, или прямо пропорциональна квадрату плотности газа, или обратно пропорциональна квадрату его удельного объема: 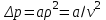 а — коэффициент пропорциональности, принимающий для каждого газа определенное числовое значение, не зависящее от параметров состояния В итоговом виде уравнение ВДВ: 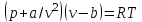 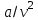 - внутреннее давление - внутреннее давление(для воды при температуре 293 К а/v2 ≈ 1080 МПа) Возьмем уравнение ВДВ, все скобки раскроем и получим характеристическое уравнение 3-го порядка. 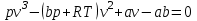 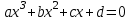 - уравнение третьей степени относительно удельного объема газа 1) все три корня различны и действительны; 2) все три корня действительны и равны между собой; 3) один корень действительный и два мнимых (комплексных) [реальное значение имеет только один действительный корень]. 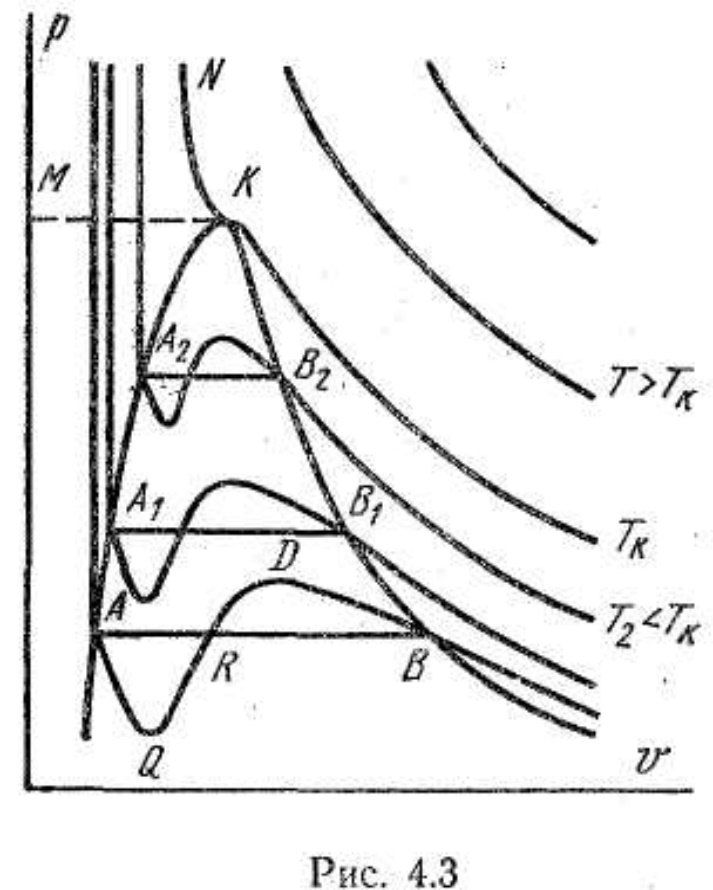 Прямая АВ, пересекающая такого типа изотерму, дает три действительных значения удельного объема в точках A, R и В, т. е. эти изотермы соответствуют первому случаю решения уравнения Ван-дер-Ваальса (три различных действительных корня). При определенной температуре, называемой критической, изотерма уравнения Ван-дер-Ваальса не будет иметь волнообразного участка. На этой изотерме есть точка перегиба, касательная к которой должна быть горизонтальной. Это соответствует второму случаю решения уравнения Ван-дер-Ваальса, когда все три корня действительны и равны между собой (рис. 4.3, точка К). При температурах T > Tк имеет место третий случай решения уравнения Ван-дер-Ваальса, когда один корень действительный, а два мнимых. Кривую АК, на которой жидкость находится в состоянии кипения, называют пограничной кривой жидкости (нижней пограничной кривой); криваяВК, называемая пограничной кривой пара (верхней пограничной кривой), представляет собой совокупность состояний сухого насыщенного пара. Таким образом, для реального вещества рv-диаграмму можно разбить на три характерные области: 1) область жидкого состояния, расположенную левее пограничной кривой жидкости; 2) область двухфазных состояний (влажного пара), расположенную между пограничными кривыми жидкости и пара; 3) область перегретого пара, расположенную правее пограничной кривой пара и выше критической точки. Критические параметры вещества. Критические точки – это точки соответствующие температуре, при которой пропадает различие между жидкостью и газом, поверхностное натяжение воды становится = 0. Критические параметры, выраженные через константы уравнения a и b: 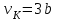 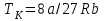 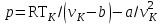 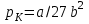 Константы а и b при известных критических параметрах: 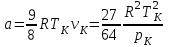 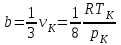 Общее аналитическое выражение первого закона термодинамики. Сумма изменений внутренней кинетической и внутренней потенциальной энергии представляет полное изменение удельной внутренней энергии du. С увеличением объема на dv тело совершает внешнюю работу по преодолению внешних сил, которую обозначают δl 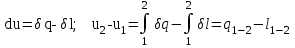 Математическое выражение первого закона термодинамики : 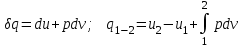 изменение удельной внутренней энергии термодинамической системы равно алгебраической сумме полученной системой энергии в форме удельной теплоты δq и совершенной ею внешней удельной работой δl, или подведенная к рабочему телу энергия в форме удельной теплоты расходуется на изменение удельной внутренней энергии тела и на совершение телом внешней работы 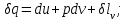 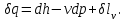 Уравнения (написанные выше) являются наиболее общим аналитическим выражением первого закона термодинамики для обратимых процессов изменения состояния термодинамической системы. Истинная и средняя теплоемкости. Отношение теплоемкостей ср и сv. Истинной теплоемкостью называется отношение элементарного количества теплоты, сообщаемой термодинамической системе в каком-либо процессе, к бесконечно малой разности температур. 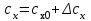 Первое слагаемое cx0представляет собой теплоемкость данного газа в разреженном (идеально газовом) состоянии (при p→0 или v→∞) и зависит только от температуры. 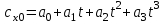 Второе слагаемое Δсх определяет зависимость теплоемкости от давления или удельного объема и связано с изменением потенциальной составляющей внутренней энергии реального газа. Средней теплоемкостью данного процесса в интервале температур от t1 до t2 называют отношение количества теплоты q1-2 к конечной разности температур t2 — t1: 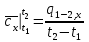 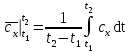 Отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме, обозначаемое обычно k: 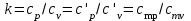 Величина k определяется числом степеней свободы молекулы. 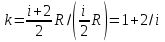 для одноатомного газа k = 1,66; для двухатомного газа k = 1,4; для трех- и многоатомных газов k = 1,33.  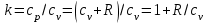 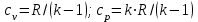 Общие вопросы исследования термодинамических процессов идеальных газов. К основным процессам относятся: изохорный, протекающий при постоянном объеме v = const; изобарный, протекающий при постоянном давлении p = const; изотермический, протекающий при постоянной температуре T = const; адиабатный, протекающий при отсутствии теплообмена с внешней средой S = const; политропные, характеризующиеся постоянством теплоемкости в процессе cx = const. Общий метод исследований процессов Выводится уравнение кривой процесса на pv- и Ts-диаграммах; Устанавливается зависимость между основными параметрами рабочего тела в начале и конце процесса; Определяется изменение удельной внутренней энергии по формуле, справедливой для всех процессов идеального газа: 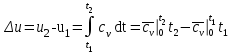 или при постоянной теплоемкости: 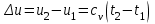 4. Вычисляется работа изменения объема газа по основной формуле: 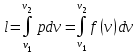 5. Определяется удельное количество теплоты, участвующее в процессе, по формуле: 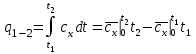 6. Определяется изменение удельной энтальпии в процессе по формуле, справедливой для всех процессов идеального газа: 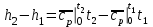 или для постоянной теплоемкости: 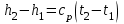 7. Определяется изменение удельной энтропии идеального газа по формулам: 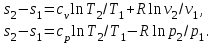 Рассматриваемые процессы считаются обратимыми. Прямой обратимый цикл Карно. Обратимый цикл, осуществленный между двумя источниками теплоты постоянной температуры, состоящий из двух обратимых изотермических и двух обратимых адиабатных процессов, называется циклом КАРНО 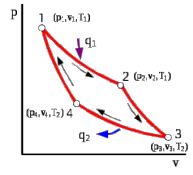   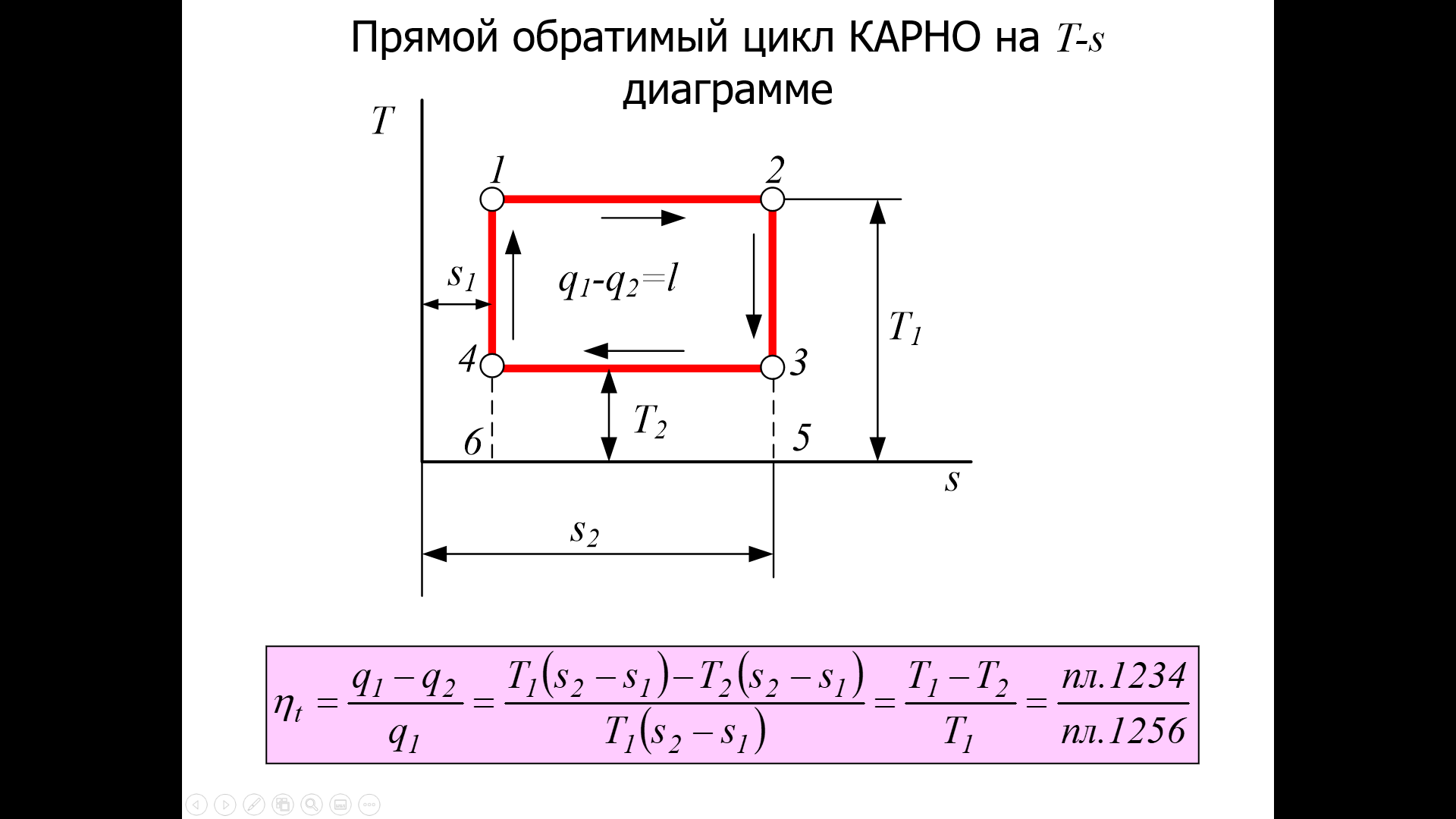 Обратный обратимый цикл Карно. 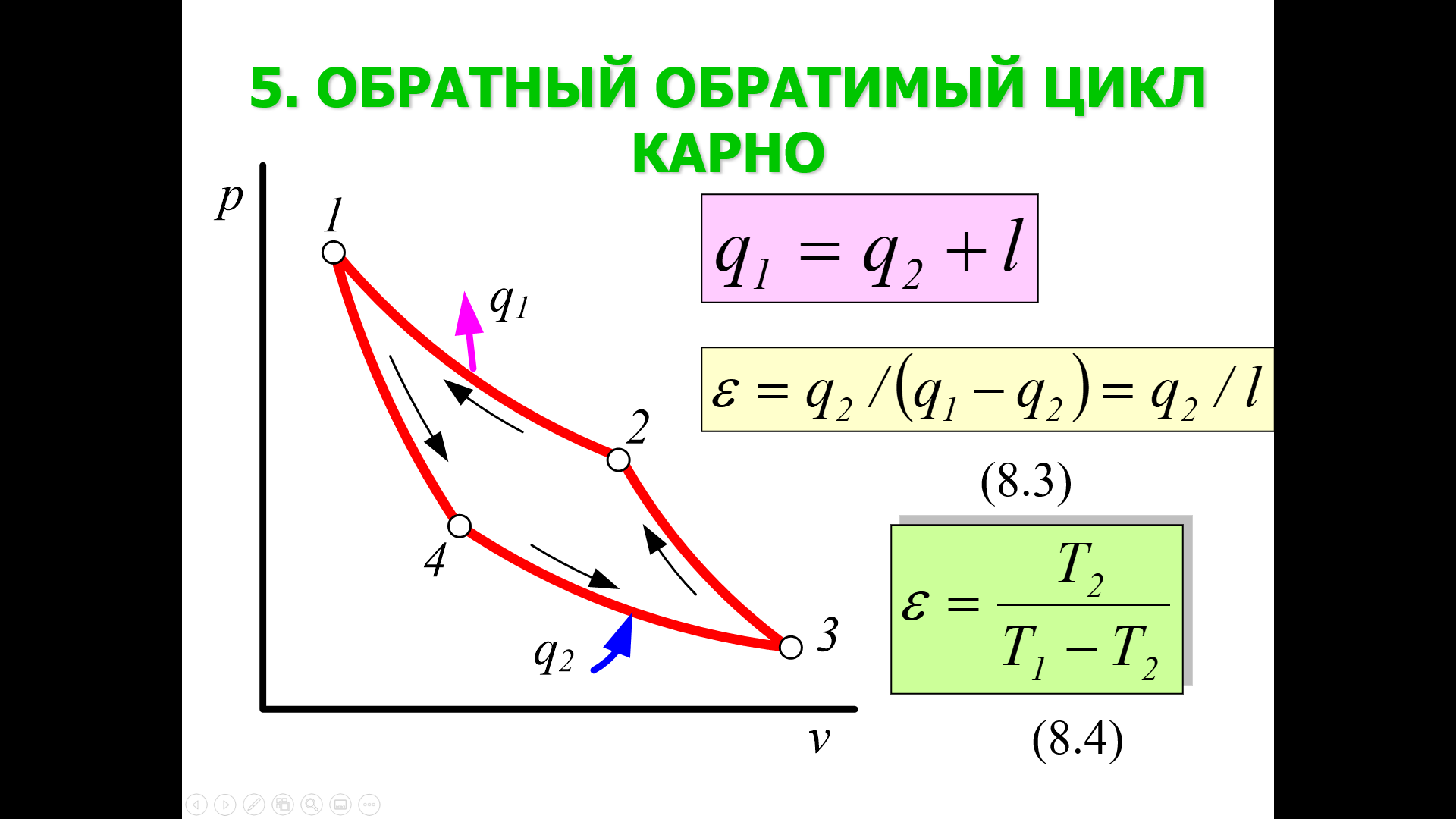 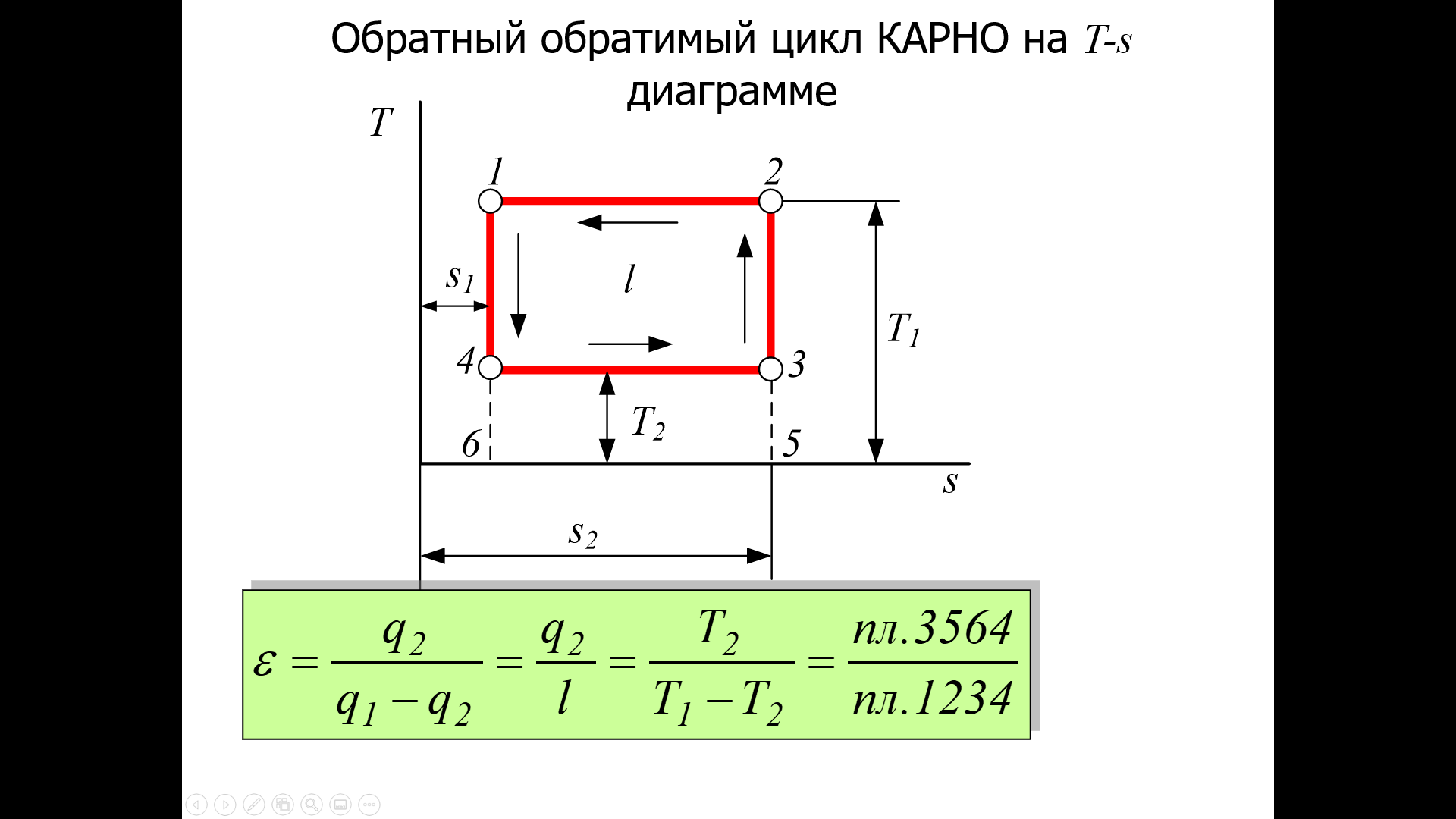 Машина, работающая по обратному циклу, называется холодильной машиной Машина, работающая по обратному циклу, называется холодильной машинойЗатрачиваемая внешняя работа сжатия больше работы расширения на величину пл. 1432 внутри замкнутой линии цикла. Эта работа превращается в теплоту и передается вместе с теплотой q2 источнику с температурой Т1. Таким образом, затратив на осуществление обратного цикла удельную работу l, можно перенести от теплоприемника к теплоотдатчику q2 единиц теплоты 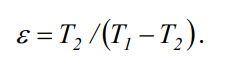 Из рассмотрения обратного цикла Карно можно сделать вывод, что передача теплоты от источника с низкой температурой к источнику с высокой температурой, как это следует из постулата Клаузиуса, обязательно требует затраты энергии. Обобщенный (регенеративный) цикл Карно.   Располагаемая работа при истечении газа. Скорость истечения и массовый расход идеального газа из суживающегося сопла. Величина dw2 /2, равная бесконечно малому приращению внешней кинетической энергии рабочего тела, называется элементарной располагаемой работой 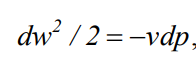 Массовый расход идеального газа зависит от площади выходного сечения канала, начального состояния газа и степени его расширения Массовый расход: m = a*w/v а – площадь поперечного сечения канала, w – скорость газа, V2 – удельный объём в выходном сечении сопла. Скорость истечения газа зависит от состояния газа при входе в сопло и от давления р2 на выходе 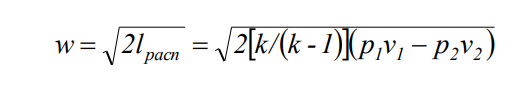 Случаи истечения идеального газа из сужающегося сопла Первый случай Давление внешней среды больше критического. При этих условиях используется весь перепад давления и происходит полное расширение газа. Скорость газа в выходном сечении сопла меньше скорости звука. Давление газа в выходном сечении сопла равно давлению внешней среды Второй случай Давление внешней среды меньше критического. При этих условиях используется не весь перепад давлений, а только часть от р1 до рк, происходит неполное расширение газа, и скорость газа в выходном сечении суживающегося сопла равна критической скорости или местной скорости звука). Давление в устье сопла равно критическому давлению: pк p1к |
