Экзамен по химии. Закон эквивалентов, моль эквиваленты и мольэквивалентные массы и объемы веществ различных классов химических соединений
 Скачать 1.24 Mb. Скачать 1.24 Mb.
|
1 2 Количественный анализ предшествует качественному. 45. Методы инструментального количественного анализа. Инструментальный метод- метод количественного определения исследуемого компонента в анализируемом веществе с помощью приборов Наиболее распространённые методы: -оптические, основанные на изучении оптических свойств веществ - электрохимические, основанные на изучении электрохимический свойств веществ - хроматографические, основаны на различной сорбционной способности выделяемых веществ Достоинства: - экспрессность (быстрота) - воспроизводимость результата -простота выполнения Недостатки: - стоимость оборудования и расходных материалов -высокая квалификация специалистов 46. Электрохимические методы анализа веществ. Электрохимические методы основаны на протекании электрического тока, среди них важны: 1. Потенциометрия- Е=ϝ(C) 2. Кондуктометрия- основан на измерении электропроводности растворов ϫ=ϝ(С) ϫ-каппа, электропроводность ( используется для определения солисодержания в воде) 3. Вольтамперометрия – Е=ϝ(I) 4. Кулонометрия – Q= ϝ(C) 47. Титриметрические и весовой методы количественного анализа. Гравиметрический (весовой) анализ основан на выделении определяемого элемента из исходного вещества, предполагающего взвешивание в начале и в конце опыта Гравиметрия выполняемся 3 способами: 1) способ осаждения 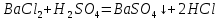 2) способ выделения- выделение твёрдого не разлагаемого остатка из исходного вещества 3) способ отгонки 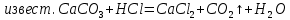 Титриметрический (объёмный) анализ основан на установлении количества определяемого вещества с помощью титрования. Метод основан на использовании закона эквивалентов: N1V1=N2V2 => N2=N1V1/V2 В титриметрии используют реакции нейтрализации, ОВР, комплекса образования. 48. Дисперсные системы. Классификация систем по разным признакам. Дисперсные системы- системы, состоящие из дисперсной фазы (растворённые вещества) и дисперсной среды. Классификация: 1. По степени дисперсности
 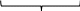 Жид.-газ тверд.-газ газ-жид. Жид.-жид. Тверд.-жид. туман дымы пены(зефир) эмульсии(молоко) суспензии(смекта-вода) Аэрозоли Газ-тверд. Жид.-тверд. Тверд.-тверд. пены(пенопласт) черный фосфор(Hg-P) цветные стекла 2. по агрегатному состоянию дисперсной фазы и дисперсионной среды 3. по интенсивности взаимодействия между дисперсной фазой и диспресионной средой 1) Лиофобные системы (не существует сродства между д.ф и д.с) Большинство коллоидов лиофобны 2) Лиофильные системы (присутствует сродство между д.ф и д.с) Присутствуют растворы высокомолекулярных соединений (ВМС) 49. Коллоидная химия и наносистемы в современной промышленности. Коллоидная химия изучает дисперсные системы – системы, состоящие из дисперсной фазы (растворенные вещества и дисперсионной среды). Впервые понятие коллоид было введено Томасом Грэмом (английский ученый) от латинского «колла» - клей. Изучение физико-химических свойств высокодисперсных микрогетерогенных систем и процессов, в них происходит сост. предмет коллоидной химии, также она изучает свойства растворов ВМС. Примерами природных дисперсных систем могут быть горные породы, почвы, пыль, дым, облака, туман; растительные и животные ткани, многие продукты производства, например, строительные материалы, металлические сплавы, бумага, ткани. 50. Строение частиц дисперсной фазы; мицеллы; агрегативная и кинетическая устойчивости дисперсных систем. Частица коллоидного раствора называется мицелла. Она состоит из ядра, адсорбционного слоя и диффузного слоя. Размер 10-7 – 10-9 м Ag+ NO3- - в избытке AgNO3 + KCl = AgCl↓ + KNO3 изб ядро {m[AgCl] n Ag+ ( n – х ) NO3-}+ хNO3 – положительный коллоидный раствор адсорбционный слой диффузный слой гранула Мицелла – электронейтральная частица Под кинетической устойчивостью понимается свойство частиц дисперсной фазы удерживаться, не оседая, во взвешенном состоянии. Кинетическая устойчивость обусловлена влиянием броуновского движения. Агрегативная устойчивость — это способность частиц дисперсной фазы оказывать сопротивление их слипанию и сохранять определенную степень дисперсности этой фазы в целом. 51. Коагуляция дисперсных систем электролитами разной природы. (Лаба 7 дисперсные системы) Нарушение устойчивости коллоида вызвано различными факторами, наиболее важные из них – электролиты Коагуляцией называется нарушение устойчивости коллоида. Она подчиняется правилам Шульце – Гарда 1. Правило знака – коагуляцию коллоида вызывает тот ион электролита, который противоположен ему по знаку 2. Правило валентности. Коагуляция двух валентных ионов в 50-70ираз выше действия одновалентных, а действие трехвалентных в 500-700 раз выше действия одновалентных Защитить коллоид от коагуляции с помощью растворов ВМС (высоко-молекулярный соединений) (белки, жиры) 52. Органические вещества и их классификация, высокомолекулярные соединения. Получение, свойства, применение. Органических веществ известно более двадцати пяти миллионов. Для того чтобы разобраться во всём их многообразии, используют классификацию. В основу современной классификации органических соединений положены два признака: строение углеродного скелета молекулы; наличие в молекуле функциональных групп. По строению углеродной цепи все соединения делят на алифатические (с незамкнутой цепью атомов углерода) и циклические (с замкнутым в цикл углеродным скелетом). Алифатические соединения могут иметь разное строение углеродной цепи. 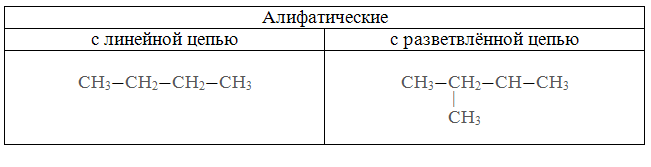 Среди циклических веществ выделяют карбоциклические (в цикле только атомы углерода) и гетероциклические (кроме углерода содержат в цикле атомы кислорода или азота). 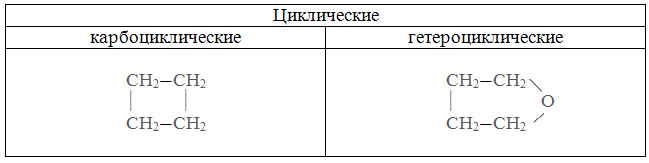 Атомы кислорода и азота в состав органических веществ входят в виде функциональных групп. Функциональная группа — это группа атомов, которая определяет свойства вещества. По наличию функциональной группы выделяют углеводороды (состоят из атомов углерода и водорода) и их производные. С учётом связей между атомами углерода органические вещества делятся на насыщенные (с одинарными связями между атомами углерода) и ненасыщенные (с двойными и тройными связями). 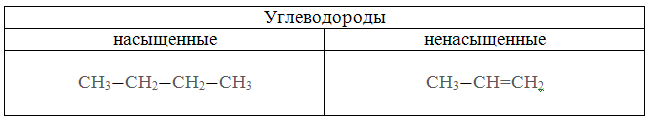 Среди производных углеводородов можно выделить кислородсодержащие и азотсодержащие (содержат в молекулах третий элемент).  В зависимости от состава функциональной группы среди производных выделяют спирты R—OH, карбоновые кислоты R—COOH, амины R—NH2и другие классы веществ. 1 2 |