Экзамен по химии. Закон эквивалентов, моль эквиваленты и мольэквивалентные массы и объемы веществ различных классов химических соединений
 Скачать 1.24 Mb. Скачать 1.24 Mb.
|
1 2 Основные законы химии. Закон эквивалентов, моль эквиваленты и моль-эквивалентные массы и объемы веществ различных классов химических соединений. Химическая термодинамика, стандартные условия.
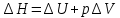 – это первое начало термодинамики: подводимая к системе теплота расходуется на изменение внутренней энергии и совершение работы. – это первое начало термодинамики: подводимая к системе теплота расходуется на изменение внутренней энергии и совершение работы.В термохимии тепловой эффект с выделением тепла считают отрицательным 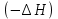 , а с поглощением тепла –положительным , а с поглощением тепла –положительным 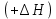 8. Химическая кинетика. Понятие фазы. Химическая кинетика — раздел физической химии, изучающий закономерности протекания химических реакций во времени. Предметом химической кинетики является изучение всех факторов, влияющих на скорость протекания реакции. Гомогенная реакция — реакция, в которой реагирующие вещества находятся в одной фазе. пример: O2(г) + 2H2(г) = 2H2O(г) Гетерогенная реакция — реакция, происходящая на границах раздела фаз – между газообразным веществом и раствором, между раствором и твёрдым веществом, между твёрдым и газообразным веществами. С (т) + О2(г) = СО2 (г) Фаза – часть системы, однородная по составу и строению и отделенная от других частей системы (других фаз) границей раздела (межфазной границей). 9. Скорость химической реакции и зависимость скорости от разных факторов. Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени скорость зависит от: 1) природы реагирующих в-в. Mg (сил) +HCl(сил) быстро Zn + HCl медленно 2) От концентрации Чем выше концентрация тем выше скорость 3)Температуры При увеличении Т на каждые 10 градусов, скорость увеличивается в 2-4 раза– правило Вант – Гоффа 4)Катализатор – ускоритель химической реакции Pt (платина) самый эффективный из всех неорганических, но самый дорогой С2Н4=С2Н6 Ингибиторы – вещества, замедляющие реакцию Ферменты – биокатализаторы 5) Давление (для газов) при увеличении давления уменьшается объем, увеличивается концентрация и увеличивается скорость 6) Площадь 10. Закон действия масс. Для гомогенных систем установили закон-Закон действия масс: При постоянной температуре скорость реакции прямопропорциональна произведению концентраций реагирующих в-в в системе, равных коэф. перед формулами веществ в уравнении реакции. 2NO(г)+ H2-> N2O(u)+H2O(г) V-> k [NO]^2 [H2] k-константа скорости зависит от природы в-в, температуры, катализатора, не зависит от концентрации в-в. 11. Обратимые и необратимые процессы, химическое равновесие и условие равновесия  (необратимая) (необратимая)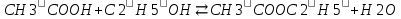 (обратимая) (обратимая)           Точка К- точка равновесия испарение воды конденсация испарение K t V Vпр=Vобр – условие равновесия Обратимые реакции – реакции, протекающие одновременно в двух противоположных направлениях. Необратимые реакции – реакции, при которых взятые вещества превращаются в продукты реакции, не реагирующие между собой при данных условиях. Химическое равновесие – состояние при которой скорость прямой реакции, равна скорости обратной. 12. Константа скорости и константа равновесия. Константа равновесия(Кр)-отношение произведения концентрации продуктов реакции к произведению конц исходных веществ и все конц в степенях равных коэффициенту. Кр-зависит от природы вещ-в и температуры, но не зависит от концентрации Для обратимой химической реакции константа равновесия может быть выражена через константы скорости прямых и обратных реакций, исходя из того факта, что в состоянии равновесия скорости прямой и обратной реакций равны. Например, для элементарной обратимой химической реакции первого порядка легко показать, что: где k1 — константа скорости прямой реакции, а k2 — обратной. Это важное соотношение даёт одну из «точек соприкосновения» химической кинетики и химической термодинамики. Константа скорости реакции k — коэффициент пропорциональности между скоростью химической реакции и произведением концентраций реагирующих веществ: 13. Зависимость константы равновесия от температуры. При уменьшении Т равновесие смещается в сторону экзотермической реакции, при увеличении Т в сторону эндотермической реакции. (по принципу Ле-Шателье) 14. Принцип Ля-Шателье. Влияние разных факторов на состояние равновесия. Сдвиги равновесия. Смещение положения равновесия положения определяется принципом Ле-Шателье: Если на систему, находящуюся в состоянии устойчивого равновесия, воздействовать извне, то в системе усилится то из направлений протекания процесса, которое ослабляет произведённое воздействие и положение равновесия смещается в том же направлении. (Влияние на положение равновесия) Применение: на положение равновесия влияет Т,р,С (температура, давление, концетрация) влияние Т 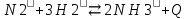 - в прямой реакции Q выделяется - в прямой реакции Q выделяется- в обратной реакции Q поглощается Таким образом, увеличение температуры в равновесной системе, смещает положение равновесия в сторону эндотермической реакции влияние р nисх= 4моль; nпродукт= 2моль Т.о, увеличение р в равновесной системе, смещает положение в сторону меньшего объёма влияние С увеличение С любого из реагирующих веществ в равновесной системе смещает положение равновесия в сторону его расходования Пример: 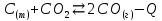 Смещение равновесия:  ↑Т ↑Т  ↑р ↑р  ↑ССО₂ ↑ССО₂15. Особенности химического равновесия для гомогенных и гетерогенных систем. Гомогенная. При равенстве энтальпийного и энтропийного факторов ΔН = ТΔS ΔG = 0, что является термодинамическим условием химического равновесия. Химическое равновесие имеет динамический характер. Скорость реакции (число частиц образующихся в единицу времени в единице объема) в прямом направлении равна скорости реакции в обратном направлении. В этот момент концентрации исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями. Химические реакции, протекающие на границе раздела фаз, называются гетерогенными химическими реакциями. При равенстве скоростей прямой и обратной реакции наступает химическое равновесие в гетерогенной системе. Примерами гетерогенных процессов является пароводяная конверсия углерода, или восстановление оксидов металлов водородом: С(к) + 2Н2О = СО2 + 2Н2 , МеО(к) + Н2 = Ме(к) + Н2 О. Как и для любого равновесия, условием гетерогенного химического равновесия является равенство энергии Гиббса нулю, ΔG = 0. 16. Водные растворы. Способы выражения концентрации растворов. Раствор – это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Водные растворы состоят из воды (растворителя) и растворенного вещества. Состояние веществ в водном растворе при необходимости обозначается нижним индексом (р), например, KNO3 в растворе – KNO3(p). Растворы, которые содержат малое количество растворенного вещества, часто называют разбавленными, а растворы с высоким содержанием растворенного вещества – концентрированными. Раствор, в котором возможно дальнейшее растворение вещества, называется ненасыщенным, а раствор, в котором вещество перестает растворяться при данных условиях, – насыщенным. Последний раствор всегда находится в контакте (в гетерогенном равновесии) с нерастворившимся веществом (один кристалл или более). Способы выражения концентрации растворов: 1 Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора и состоящего из растворённого вещества и растворителя: ω = 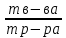 где: ω – массовая доля растворенного вещества; mв-ва – масса растворённого вещества; mр-ра – масса растворителя. Массовую долю выражают в долях от единицы или в процентах. 2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V: с = 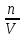 где: C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl); n – количество растворенного вещества, моль; V – объём раствора, л. Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества 0,1 М HCl, т.е. 0,1 моль HCl содержится в 1 л раствора 3 Моляльная концентрация сm = m (x) = 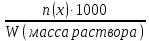 Моляльность показывает, какое количество вещества (N) растворенного вещества находится в 1000 г чистого растворителя. 4. Нормальная концентрация Сн = N (x) =  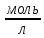 =н =н17. Растворы электролитов и не электролитов. Физические свойства растворов. Электролитами называются вещества, которые в растворе или в расплаве частично или полностью распадаются на ионы и за счет этого проводят электрический ток. То есть, это химические соединения преимущественно гетероядерного состава. Неэлектролиты не обладают этими свойствами, так как элементы в них связаны ковалентными неполярными или малополярными (с минимальной ионностью в гетеросоединениях) связями, представляя собой прежде всего молекулярные соединения. Это большинство органических соединений, например углеводороды. 18. Количественные характеристики растворов, информирующие об их свойствах.  19. Сильные и слабые электролиты, константы диссоциации электролитов и их информационные значения. К сильным электролитам относят вещества, у которых степень диссоциации α ˃ 30% . (HCl - соляная кислота α- 99%. NaOH, NaNO3) К слабым электролитам относят вещества, у которых α ˂ 5%. (CH3COOH уксусная кислота, HNO2 азотистая кислота, NH3*H2O гидроксид амония) Важнейшей характеристикой электролитов является константа диссоциации. CH3COOH ↔ CH3COO- +H+ Kд = 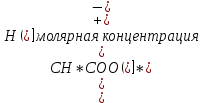 Kд(CH3COOH) = 1,8 * 10^(-5) уксусная кислота Kд(HCl) = 10^7 (много ионов, тем сильнее электролит) Константа диссоциации и степень диссоциации связаны законом разбавления Оствальда : Kд = 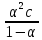 а(альфа) = корень(Kд/C) От концентрации зависит степень диссоциации 20. Ионное произведение воды, pH и информационные значения этой величины. Вода - слабый электролит. H2O= H(+) + OH(-) Kд =  Kд - константа диссоциации Кw = [H(+)] * [OH(-)] = 10^(-14). - ионное произведение воды при температуре 20° В чистой воде конц. [H]=[OH-]=10^-7 pH=-lg10^-7=7 pH=-lg[H(+)]-водородный показатель или pH среды pH=7-среда нейтральная pH<7-среда кислая pH>7-среда щелочная 21. Произведение растворимости и информационное значение этой величины В насыщенном рас-ре трудно рас-го электролита устанавливается равновесие между твердой фазой (осадком) и ионами в рас-ре 𝐴𝑔𝐶𝑙→←𝐴𝑔++𝐶𝑙− KдAgCl=[Ag+][Cl-]/[AgClтв] [AgCl] = conts Kд[AgCl]=[Ag+][Cl-]=ПР При постоянной t в насыщенном рас-ре трудно растворимого электролита произв. Концентраций (величина пост.) и называется произведением растворимости. Если произведение концентрация ионов больше ПР, осадок выпадает если меньше, нет Произведением растворимости называется константа равновесия. Произведение растворимости равно произведению молярных концентраций ионов, участвующих в равновесии, каждая из которых возведена в степень, равную стехиометрическому коэффициенту, при соответствующем ионе в уравнении равновесия. 22. Амфотерные электролиты и особенности их химического поведения. амфотерными называются электролиты, дающие при диссоциации в воде в зависимости от условий ионы водорода (H+) или гидроксида(OH-) Примерами амфотерных электролитов могут служить как растворимые в воде растворимые (аминокислоты), так и нерастворимые (гидраты окислов некоторых элементов) для аминокислот и некоторых других органических электролитов причиной амфотерности является наличие, по крайней мере, двух различных функциональных групп, одна из которых проявляет кислотные свойства , a другая-основные, Для гидратов оксидов причина амфотерности другая. В их составе всегда можно выделить группировку: Э-О-Н где: Э-элемент О- кислород, H-водород В зависимости от соотношений энергий связи О- H и О-Э, могут реализоваться три варианта: 1) энергия связи О - H прочнее, чем для связи Э-О 2)энергия Связи О-H примерно такая же как и для связи Э-О 3) энергия связи О- H слабее, чем для связи Э-О В 1 случае гидрат оксида является основанием, в 3-кисловой, а во 2- проявляет амфотерные св-ва. 23. Химическая реакция веществ с водой. Гидролиз солей. Гидролизом соли называется взаимодействие ионов соли с ионами воды с образование слабого электролита, в результате чего меняемся рН среды. Соли образованные сильным основанием и сильной кислотой (NaCL, KNO3, CaCL, Na2SO4) гидролизу не подвергаются, т.к. слабый электролит не образуется. 1)Соль, образованная сильным основанием, слабой кислотой (NaCo3, K3PO4, Na2S) гидролизируется по аниону, если кислота много основна гидролиз идет по стадии a)Na2Co3+H2O=NaOH+NaHCO3 2Na++Co32-+H2O=Na++OH-+Na++HCo3- Co32+H2O=OH-+HCo3- т.к. в результае гидролиза накапливается ионы ОН- среда щелочная pH>7 2) Соль образованная слабым основание, сильной кислотой (CuCL2, ZnSO4, Bi(NO3)3, NH3CL) гидролизируется по катиону, если основание много кислотно, гидролиз идет по стадии CuCL2+H2O=HCL+CuOHCL Cu2++2CL++H2O=H++CL-+CuOH++CL- Cu2++H20=H++CuOH+ Накапливаются ионы Н+ среда кислая рН<7 3)Соли образованны слабым основание, слабой кислотой(NH4CH3COO, CuCo3) гидролизуются нацело NH4CH3COО+Н2О=NH4OH+CH3COOH 24. Особенности химического поведения солей разной природы при взаимодействии с водой. Влияние реакции на значение рН. 1) Cоль, образованная сильным основанием и слабой кислотой(NaCO3;H2S;Na3PO4;K2SiO3);NaCH3COO;KCN и т.д.) гидролизуется по аниону , если кислота многоосновна гидролиз идет по стадиям Пример: 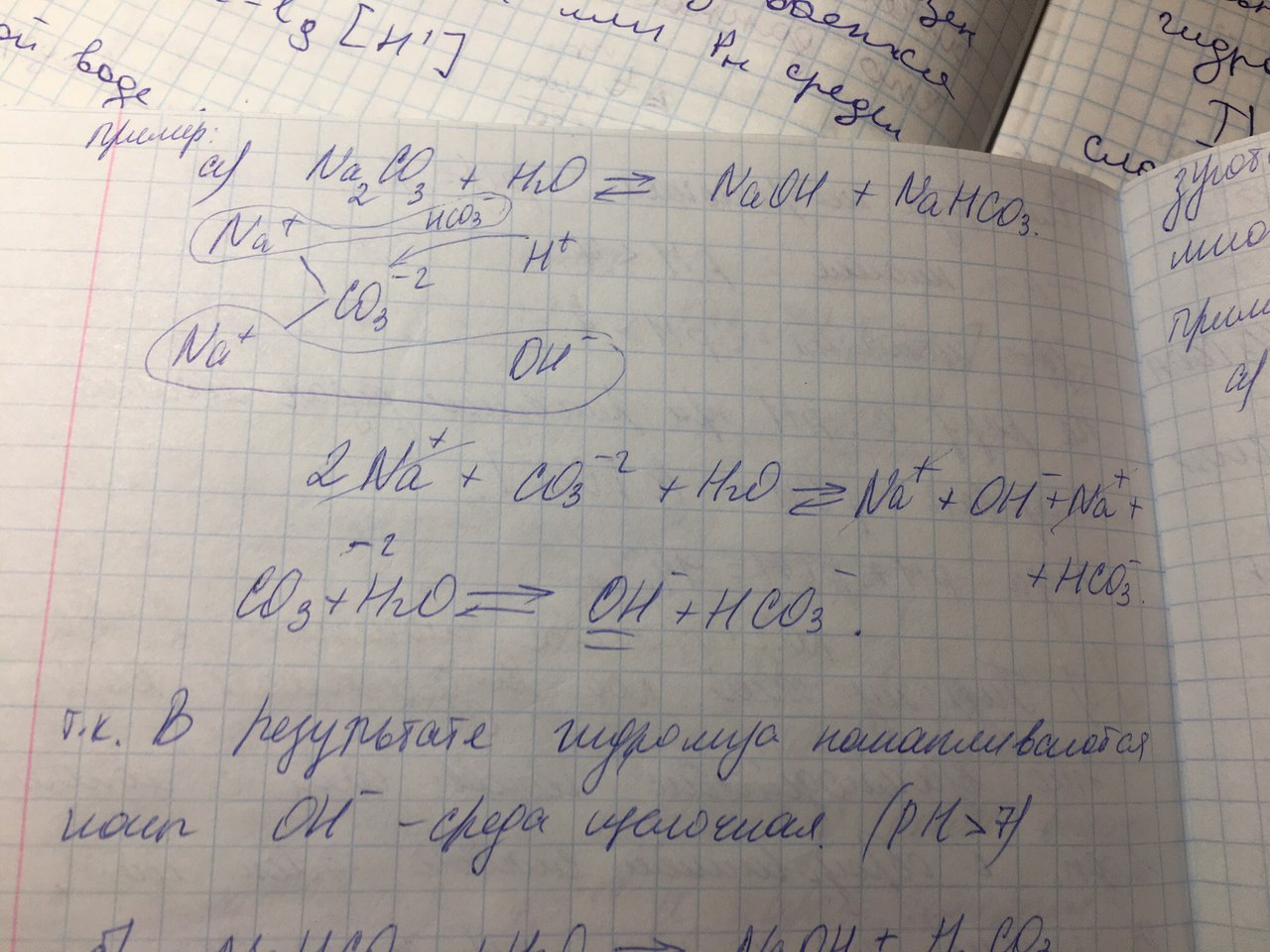 2)Соль, образованная слабым основанием и сильной кислотой (CuCl2;Al(SO4)3;Cr(NO3)3;Pb(NO3)2;ZnSO4;NH4Cl и т.д.) гидролизуется по катиону , если основания многокислотно - гидролиз идет по стадиям Пример:  3)Соли, образованные слабым основанием и слабой кислотой (NH4;CH3COO;NH4CN;(NH4)2S;Al2S3;CuCO3 и т.д.) гидролизуется по катиону и аниону 25. Современные представления о строении атома. Современная теория строения атома возникла как результат переосмысления и дополнения теории Бора. Существенным нововведением стало понятие о электронное облако (атомную орбиталь), которое пришло на смену понятию о электрон лишь как частицу. Орбиталью называется пространство вокруг ядра, в котором пребывания электрона скорее. Современная квантовая теория строения атома учитывает волновые свойства электрона и других элементарных частиц — протонов, нейтронов и т.д.. Основные положения современной теории строения атома 1. Электронe свойственна двойственная (корпускулярно — волновая) природа. Как частица электрон имеет определенную массу и заряд, а как волна — способность к дифракции (огибания препятствия). 2. Для электрона невозможно одновременно и точно измерить координату и энергию. В каждый момент времени можно определить только одну из этих свойств. 3. Электрон в атоме не вращается вокруг ядра по определенной траектории, а может двигаться в любой части навколоядерного пространства. Однако вероятность нахождения его в разных частях пространства неодинакова. 4. Ядра атомов состоят из протонов и нейтронов. Число протонов равно атомному номеру элемента (протонное число), а сумма чисел протонов и нейтронов (нуклонов) соответствует его массовому числу. 26. Квантовые числа и их физический смысл. 1) n-главное квантовое число, характеризует энергию электрона и его удаленность от ядра атома. Если n=1, то электрон находится на 1 энерг уровне. ФС n: главное квантовое число определяет запас энергии электрона на данном эн уровне и размеры эл облака. Большим размером соответствует большая энергия и большее значение n. 2) l-орбитальное квантовое число, характеризует энергию движения электрона, форму его движения. l= 0,1,2,3 s,p,d,f 3) м -магнитное квантовое число, характеризует ориентацию орбиталей в пространстве 4) s-спиновое квантовое число, характеризует вращение электрона относительно собственной оси 27. Электронные семейства и электронные аналоги. В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся на четыре типа – электронные семейства: s – элементы; заполняется электронами s – подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. Валентными являются электроны внешнего уровня. p – элементы; заполняется электронами р – подуровень внешнего уровня. Это последние шесть элементов каждого периода (кроме I и VII). Валентными являются s- и p- электроны внешнего уровня. d – элементы; заполняется электронами d – подуровень второго снаружи уровня, а на внешнем уровне – один или два электрона. К ним относятся элементы вставных декад больших периодов, расположенных между s – и p – элементами (их также называют переходными элементами). Валентными являются s – электроны внешнего уровня и d – электроны предвнешнего уровня (второго снаружи). f – элементы; заполняется электронами f – подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Они расположены в 6 – м (4f – элементы) и 7 – м (5f – элементы) периодах периодической системы. 4f – элементы объединяют в семейство лантаноидов, а 5f – элементы – семейство актиноидов.В периодической системе s – элементов 14, p – элементов 30, d – элементов 38, f – элементов 28. Атомы элементов с одинаковым заполнением внешнего энергетического уровня носят название электронных аналогов. Например: 28. Принципы заполнения электронами энергетических уровней и подуровней. 1)Принцип минимума энергии. Электроны стремятся занять энергетически наиболее низкое состояние отвечающее максимальной уствойчивости. 2) Принцип Паули. В атоме не может быть двух одинаковых электронов с одинаковыми значениями 4-х кВ чисел. 3) Правила Кличковского. 1)заполнение электронами уровней и подуровней в атоме происходит в порядке увеличения суммы (n+l) 2)При одинаковых значениях (n+l), первым заполняется подуровень с максимальным l 4) Правило Гунда - электроны в данном подуровне стремятся занять max число свободных орбиталей, так чтобы суммарный спин был максимальным. 29. Взаимосвязь химических свойств с энергетическими характеристиками электронов наружного уровня. Периодическое направление электронов вокруг ядра атомов приводит к периодическому изменению св-в элементов. Периодически меняется валентность, атомные и ионные радиусы ,энергия ионизации ,энергия сродства к электрону , электроотрицательность(ЭО) и др. св-ва. А) Энергия ионизации(ЭИ) – это энергия, которую надо затратить ,чтобы оторвать электрон от атома. При этом атом переходит в положительный ион. В периодах слева направо заряд ядра возрастает ,число энерг. ур-ней остаётся одним и тем же. Притяжение электронов к ядру усиливается ,радиус уменьшается . Оторвать электр. Становится сложнее, энергия ионизации возрастает. В группах сверху вниз число энерг. ур-ней увелич.. Радиус увеличивается., оторвать электр. становится легче ЭИ уменьшается. С этой величиной связаны восстановительные св-ва атома. Б)Энергия сродства к электрону (ЭСКЭ) – энергия, которая выделяется при присоединении электрона к нейтральному атому. При этом атом переходит в отрицательный ион. По периодам слева направо притяжение электронов усиливается и ЭСКЭ увеличивается . В группах снизу вверх радиус уменьшается , притяжение усиливается и ЭСКЭ увеличивается. В) Электроотрицательность (ЭО) - способность атомов в молекулах или кристаллах притягивать к себе электроны . Чем больше ЭО , тем сильнее атом притягивает электроны. ЭО=1/2*(y+E) ЭО увеличивается в периодах слева направо .В группах снизу вверх За единицу ЭО(Li)= 1 (Литий) Самый ЭО элемент ЭО(F)=4 (фтор) 30. Характеристики s-, p-, d-, f- элементов. В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся на четыре типа – электронные семейства: s – элементы; заполняется электронами s – подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. Валентными являются электроны внешнего уровня. p – элементы; заполняется электронами р – подуровень внешнего уровня. Это последние шесть элементов каждого периода (кроме I и VII). Валентными являются s- и p- электроны внешнего уровня. d – элементы; заполняется электронами d – подуровень второго снаружи уровня, а на внешнем уровне – один или два электрона. К ним относятся элементы вставных декад больших периодов, расположенных между s – и p – элементами (их также называют переходными элементами). Валентными являются s – электроны внешнего уровня и d – электроны предвнешнего уровня (второго снаружи). f – элементы; заполняется электронами f – подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Они расположены в 6 – м (4f – элементы) и 7 – м (5f – элементы) периодах периодической системы. 4f – элементы объединяют в семейство лантаноидов, а 5f – элементы – семейство актиноидов.В периодической системе s – элементов 14, p – элементов 30, d – элементов 38, f – элементов 28. Атомы элементов с одинаковым заполнением внешнего энергетического уровня носят название электронных аналогов. Например: 31. Периодическая система и таблица элементов Д.И. Менделеева. Взаимосвязи со значениями квантовых чисел. Периодический закон открыт в 1869 году. Современная формулировка: Периодическое изменение свойств элементов и их соединений зависит от периодически повтор. Сходной структуры электронных оболочек атомов. Периодическая система Современная периодическая система имеет 7 периодов(по горизонтали) и 18 групп ( по вертикали) Период – это ряд элементов, в котором свойства меняются последовательно. Каждый период начинается S-элементом и заканчивается p-элементом В 1-ом периоде два элемента Во 2,3 – по 8 элементов В 4,5- по 18 элементов В 6,7- по 32 элемента Номер периода указывает на число энергетических уровней, заполняемых электронами. В группу входят элементы ,имеющие сходные строение внешнего электронного слоя . У каждого элемента группу определяет последний электро, заполняющий АО имеет одинаковые значения l, ml, ms, но разное значение n 32. Протоны, нейтроны, электроны, порядковый номер в таблице Д.И. Менделеева и заряды ядер, число электронов, периодичность свойств. Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда. Масса электронов очень мала, а масса протонов и нейтронов практически одинакова. Заряд ядра атома химического элемента равен порядковому номеру. Он последовательно возрастает от одного элемента к другому. Число электронных слоёв равно номеру периода, к которому относится химический элемент. Другие свойства изменяются периодически. Число внешних электронов одинаково у элементов одной A группы и совпадает с её номером. В периоде увеличивается от 1 до 8.  33. Химическая связь и современные модели химической связи. Химические связи - связи непосредственно между атомами. Различают ионную, ковалентную и металлическую связь. Ионная связь – связь, возникающая между противоположно -заряженными ионами за счет электростатического напряжения Ковалентная связь – связь, образующаяся между атомами неметаллов за счет образования общей электронной пары Неполярная ковалентная связь- образуется между атомами неметаллов с одинаковой электроотрицательностью. Полярная ковалентная связь- образуется между атомами неметаллов с различной электроотрицательностью. Металлическая связь- образуется в металлах за счёт взаимодействия положительно заряженных ионов металлов и обобщенных электронов Водородная связь- образуется между атомами водорода и атомами более электроотрицательных элементов 34. Модели ковалентной, ионной и металлической химических связей.   1) Ковалентная полярная и неполярная связь 1) Ковалентная полярная и неполярная связь- Образуется между атомами НеМе с различной -Образуется между атомами НеМе с Электроотрицательностью HCL, H2O, NH3 одинаковой электроотриц. H2, CL2, N2, O2…  Ионная связь Металлическая связь – образуется в металлах за счёт взаимодействия положительно заряженных ионнов Ме и обобществлённых Ме. 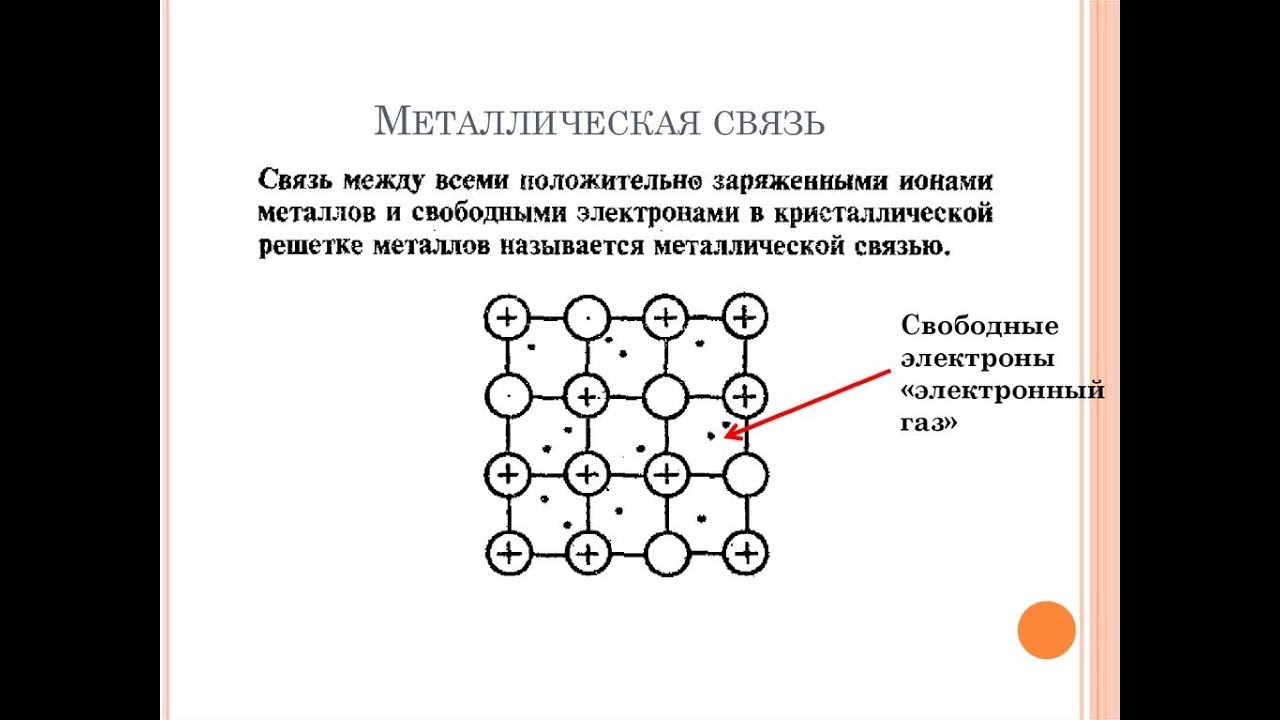 35. Обменный и донорно-акцепторный механизмы образования ковалентной химической связи. Обменный механизм образования ковалентной связи заключается в том, что каждый из соединяющихся атомов предоставляет на образование общей электронной пары (связи) по одному неспаренному электрону. Электроны взаимодействующих атомов должны при этом иметь противоположные спины. Донорно-акцепторный механизм образования ковалентной связи заключается в том, что одна частица – донор – представляет на образование связи электронную пару, а вторая – акцептор – свободную орбиталь 36. Электрохимические системы. Взаимосвязь энергии химических процессов и электрической. Электрохимическая система - система: состоящая из двух электродов и находящегося с ними в контакте проводника второго рода (электролита); в которой могут протекать как минимум одна электрохимическая реакция окисления и одна электрохимическая реакция восстановления вещества. 37. Информационное значение ряда напряжений (ряда активности) металлов. Ряд напряжений характеризует окислительно-восстановительную способность системы «металл – ион металла». Чем меньшее значение имеет стандартный электродный потенциал металла, тем более сильным восстановителем он является. Чем больше потенциал металлического электрода, тем более высокой окислительной способностью обладают его ионы.  Электродный потенциал восстановления ионов водорода из воды по реакции 2H2O + 2ē = H2 + 2OH‾ равен φ = -0,41В. Активные металлы начала ряда, имеющие потенциалы значительно отрицательнее, чем -0,41В, вытесняют водород из воды. Магний вытесняет водород только из горячей воды. Металлы, расположенные между Mg и Cd, обычно не вытесняют H2 из воды, так как их поверхность покрыта защитными оксидными пленками. Каждый металл способен вытеснять из растворов солей металлы, которые стоят в ряду напряжений правее его. Металлы, стоящие в ряду напряжений левее водорода, способны вытеснять его из растворов кислот (HCl, разб. H2SO4). Все металлы, стоящие в ряду напряжений до водорода, распространены в природе исключительно в виде соединений, а за водородом – и в самородном виде. 38. Формула Нернста и ее применение φ = φ0 +  · ln aх · ln aхφ0 – табличное значение – стандартный электродный потенциал; в вольтах (В) R – универсальная газовая постоянная 8,31 n – заряд потенциал определяющего иона (Cl-1 n = -1) F – постоянная Фарадея (96500 Кл/моль) aх – активный концентрирующий потенциал определяющих ионов (моль / л) Формула нужна для расчета электродвижущей силы. 39. Принцип работы химического источника тока в виде гальванического элемента. Анодные и катодные процессы. Электродвижущая сила гальванического элемента. К химическим источникам тока, в которых происходит прямое преобразование химической энергии В электрическую, относят гальванические элементы, топливные элементы, аккумуляторы, а также комбинированные источники тока типа топливный элемент — аккумулятор. Эти источники тока, как правило, имеют высокий к.п.д., работают бесшумно, практически не загрязняют окружающую среду. Гальванические элементы — это первичные химические источники тока, в которых химические реакции необратимы. В простейшем виде элемент представляет собой два электрода из разных металлов, погруженных в раствор электролита. При этом на одном из электродов (катоде) идет реакция растворения материала электрода - или окисления, при которой электрод теряет электроны, отдавая их во внешнюю электрическую цепь. На другом электроде (аноде) идет реакция восстановления— нейтрализации ионов материала, окружающего электрод, за счет электронов, поступающих с катода по внешней цепи. Разность потенциалов (электродвижущая сила) для различных элементов находится в пределах от 0,85 до 6 В. 40. Процессы электролиза и законы Фарадея, электроды растворимые и инертные; число Фарадея. При электролизе процессы осуществляются за счёт энергииэлектрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нём химической реакции превращается в электрическую энергию. Для процеcсов электролиза DG>0, т.е. при стандартных условиях они самопроизвольно не идут. закон Фарадея. Количество вещества, образовавшегося на электроде при электролизе, прямо пропорционально количеству электричества, прошедшему через раствор (расплав) электролита закон Фарадея. При прохождении через разные электролиты одного и того же количества электричества массы веществ, выделившихся на электродах, пропорциональны их эквивалентным массам нерастворимые (инертные) электроды – в процессе электролиза химически не изменяются, а служат лишь для передачи электронов во внешнюю цепь (инертные электроды изготавливаются обычно из графита, угля, платины); растворимые (активные) электроды (из меди, цинка, серебра, никеля и других металлов) – во внешнюю цепь электроны посылает сам анод за счет окисления атомов металла, из которого сделан анод.  41. Первичные источники (батарейки) и топливные элементы как примеры превращения химической энергии в электрическую. Любая батарейка или аккумулятор дает ток за счет протекающих внутри них химических реакций Химические источники тока (сокращенно ХИТ) – это источники электродвижущей силы (ЭДС), в которых в электрическую энергию превращается энергия протекающих внутри химических реакций. Используют их сегодня повсеместно – это и современные электромобили и портативная радиоэлектроника, и медицинское оборудование, и портативные компьютеры. 42. Окислительно-восстановительные процессы при реакции металлов с водой, водными растворами кислот и щелочей. Реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. Изменение степеней окисления происходит из-за перехода электронов от восстановителя к окислителю.Степень окисления– это формальный заряд атома, если считать, что все связи в соединении являются ионными. Окислитель – это вещество, молекулы или ионы которого принимает электроны. Если элемент является окислителем, его степень окисления понижается. О02 +4е-→ 2О-2 (Окислитель, процесс восстановления) Процесс приема веществами электронов называется восстановлением. Окислитель в ходе процесса восстанавливается. Восстановитель – это вещество, молекулы или ионы которого отдают электроны. У восстановителя степень окисления повышается. S0 -4е- →S+4 (Восстановитель, процесс окисления) Процесс отдачи электронов называетсяокислением. Восстановитель в ходе процесса окисляется. 43. Электрохимическая коррозия. Анодный и катодные процессы и защита от коррозии. Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. Электролиз- процесс, протекающий в растворах или расплавах электролитов под действием электрического тока. Коррозия- процесс разрушения металла под действием неблагоприятных факторов окружающей среды. - Анодный процесс – окисление металла, проходит на участках изделий с меньшим потенциалом в данной среде. Анодные участки разрушаются. - Катодный процесс – восстановление окислителя, находящегося в растворе или расплаве электролита, происходит на участках изделий с бóльшим потенциалом в данной среде. Для защиты металлов от коррозии используют: 1) защитные покрытия -лаки -полимеры -краски - металлы 2)протекторная защита (выбирается более активный металл, который разрушается первым) 3)создание антикоррозионных металлов 44. Химическая идентификация веществ. Качественный и количественный анализы. Химическая идентификация –это установление вида и состояния фаз, молекул, атомов, ионов и других составных частей вещества на основе сопоставления экспериментальных и соответствующих справочных данных для известных веществ. 1 2 |




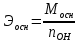 ;
;  ;
; 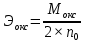
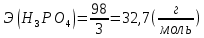
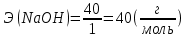 ;
; 
 нтропия- термодинамическая функция отражает движения частиц и является мерой неупорядоченности( S=
нтропия- термодинамическая функция отражает движения частиц и является мерой неупорядоченности( S= )
) 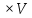
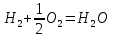 ,
, 




 Q
Q