Лекция. Закон Гесса. Уравнение Кирхгофа. Примеры решения задач. Закон Гесса. Уравнение Кирхгофа. Примеры решения задач Закон Гесса. Уравнение Кирхгофа Закон Гесса. Уравнение Кирхгофа Применение первого закона термодинамики к химическим процессам относится к самостоятельному разделу науки
 Скачать 97.63 Kb. Скачать 97.63 Kb.
|
|
Лекция. Закон Гесса. Уравнение Кирхгофа. Примеры решения задач Закон Гесса. Уравнение Кирхгофа Закон Гесса. Уравнение Кирхгофа Применение первого закона термодинамики к химическим процессам относится к самостоятельному разделу науки – термохимии, с помощью которой оказалось возможным решение таких практически важных вопросов, как определение тепловых эффектов реакций и их зависимости от параметров, при которых реакции протекают. Любой химический процесс может быть при необходимых условиях доведен до некоторого, внешне стабильного состояния равновесия. Для одной и той же реакции состояние равновесия зависит от ряда условий и прежде всего от температуры [1, 2]. Химические реакции можно разделить на экзотермические, протекают с выделением тепла, и эндотермические – с поглощением тепла. Под тепловым эффектом реакции понимается количество тепла, выделяющееся (экзотермические реакции) или поглощающегося (эндотермические реакции) при неизменных параметрах v и Т или при неизменных р и Т, и при условии, что системой может производиться только работа расширения (dA=pdv) Применим первый закон термодинамики для анализа химических реакций, проходящих при v=constили p=const: 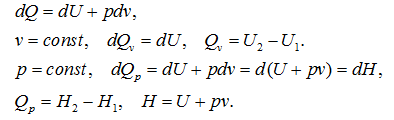 Из приведенных уравнений можно видеть, что тепловой эффект изохорно-изотермической реакции определяется изменением внутренней энергии системы, а тепловой эффект изобарно-изотермической реакции – изменением энтальпии системы. В основе термохимии лежит закон Гесса. Закон Гесса: тепловой эффект реакции, состоящей из нескольких промежуточных стадий не зависит от этих промежуточных стадий или их последовательности, а определяется начальным и конечным состоянием системы. Важной характеристикой любого сложного вещества является его стандартная теплота образования из простых веществ: Эти теплоты приводятся в справочной литературе (например, Справочник по химии Л.И. Блинов и др., [3]). Все вещества находятся в стандартном состоянии при р=1 атм и Т=298К. Теплота образования вещества при стандартных условиях обозначается так: Следствия из закона Гесса. 1 Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции. 2. Тепловой эффект химической реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ с учетом их стехиометрических коэффициентов (νi): 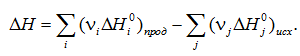 3. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (νi): 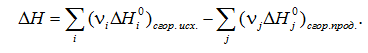 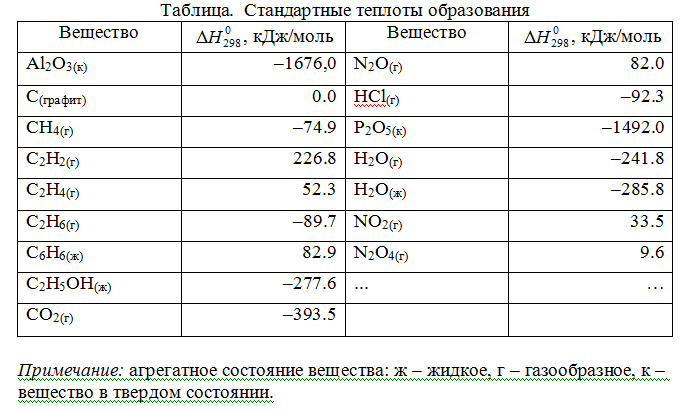 Связь между тепловыми эффектами реакцииQp и Qv Если газообразные реагирующие вещества можно считать идеальными газами, то между изохорическим и изобарическим тепловым эффектами существует связь: 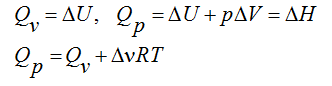 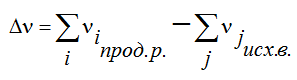 Пример 1. Определить тепловой эффект реакции CO(г)+0.5O2 (г)=CO2 (г) при постоянном давлении Qpи температуре Т=293 К, если тепловой эффект этой реакции при постоянном объеме и той же температуре Qv= –284 кДж. Решение: Изменение числа молей газообразных продуктов в ходе реакции: 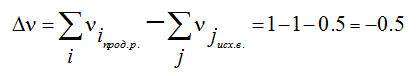 Тогда Реакция сопровождается уменьшение газообразных участников реакции ∆ν= – 0,5. При этом δA<0, Qp>Qv.. Пример 2. Определить разность тепловых эффектов Qp и Qv реакции 2C(т)+O2 (г)=2CO (г), если она протекает при 0˚С. Газы считать идеальными. Решение: Qp–Qv=∆ν∙RT, ∆ν=2 – 1=1, Qp–Qv=8,31∙273,15≈2,27 кДж. Следует отметить, что ∆ν = + 1, происходит увеличение объема газообразных веществ в ходе реакции. При этом δA>0, Qp<Qv.. Уравнение Кирхгофа При решении практических задач бывает необходимо знать тепловые эффекты реакций при высоких температурах, в то время как таблицы термохимических величин содержат стандартные тепловые эффекты, относящиеся к температуре 25 ºС (298 К). Согласно первому началу термодинамики можно определять зависимость тепловых эффектов от температуры и произвести соответствующие пересчеты. Изменение теплового эффекта химической реакции в зависимости от температуры выражается уравнением Кирхгофа 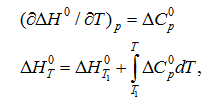 где продуктов реакции и исходных веществ, взятых с учетом стехиометрических коэффициентов 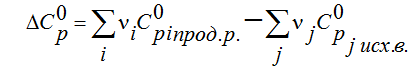 Пример 3. Определить H2 (г)+0.5 O2 (г)=H20(г) при Т=2273 К, если известны тепловой эффект реакции при Т1=273 К кДж/моль и средние теплоемкости веществ (кДж/(моль К) при Т=2273 К: 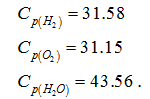 Решение: Согласно уравнению Кирхгофа 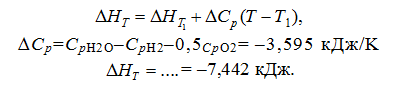 Пример 4. Исходя из теплоты образования CO2 (г) и термохимического уравнения Cгр+2N2O (г) =CO2 (г)+2N2 (г), ∆H= –557.3 кДж Вычислить теплоту образования N2O (г . 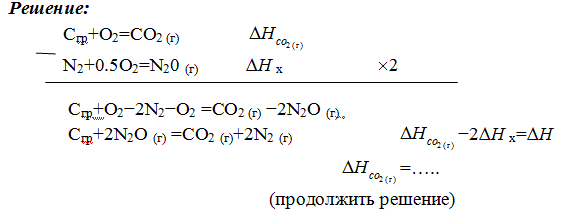 |
