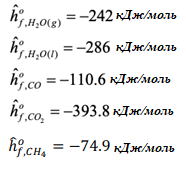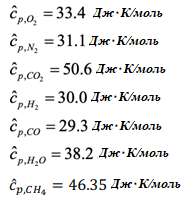Пгу с предварительным отделением CO2. Закона к реформатору в расчетах Использовались следующие термодинамические
 Скачать 344.35 Kb. Скачать 344.35 Kb.
|
|
Газотурбинная электростанция работает на улавливании CO2 перед сжиганием, как показано на представленном рисунке. Определите термический КПД цикла и температуру отходящих газов турбины на выходе: Во-первых,мыначнемсреакции,происходящейвреформере: Применениепервогозаконакреформатору: 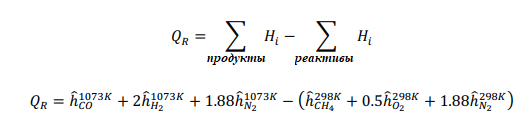 ВрасчетахИспользовалисьследующиетермодинамическиесвойства:
Принимая условия окружающей среды в качестве опорной температуры, тепло, подводимоек реформеру,рассчитываетсякак: QR = 78,820 кДж на кМоль CH4 На каждый кмоль метана, подаваемого в реформер, необходимо подвести 78820 кДж тепла, чтобы произошел реформинг метана с воздухом. Далее мы проанализируем воздушный компрессор, используя соотношения из главы 5. Температура на выходе компрессора рассчитывается как: 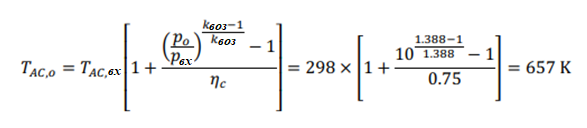 Аналогично,первыйзаконприменяетсянаодномконцетеплообменника: Обратите внимание, что смесь реформата должна выходить из HX при температуре 673 К (а не 573 К, как ошибочно указано в постановке задачи). QHEx= 59,107 кДж на кМоль CH4 Применениепервогозаконанадругомконцетеплообменникадаетуравнение1: Анализируяреакторсдвига,мыотмечаемпроисходящуюреакцию: Попервому закону: Qs= -105,127 кДж на кМоль CH4 Потребность в тепле реактора сдвига составляет -105,127 кДж на каждый кМоль метана. Дляанализакомпрессорасепараторасначаланужноопределитьудельнуютеплотугазовой смеси: 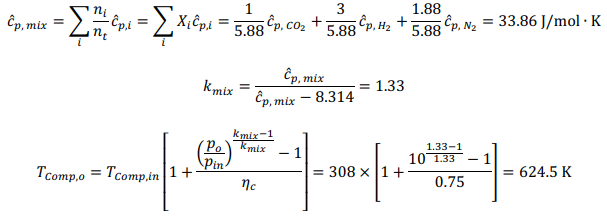 Рассчитываетсяработа,необходимаядлявыполненияпроцесса: 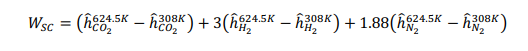 WSC= 63,005 кДж на кмоль CH4 Следующийшаг-анализгорения.Начнемстого,чтоотметимпроисходящуюреакцию: Попервому законуполучаемуравнение2: 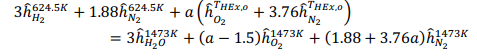 Объединивуравнения1и 2, можно решитьнеизвестныеa и : a= 5.238 = 732.1 K Анализгазовойтурбины: 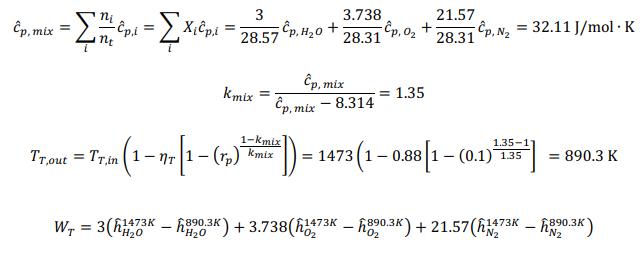 WT= 530,521 кДж на кмоль CH4 Чистаяработа,произведеннаяцикломмощности,можетбытьрассчитанасогласно: = 282,707 кДж на кмоль CH4 Поэтому: = 530,521 - 282,707 - 63,005 = 184,809 кДж на кмоль CH4 На каждый кмоль метана, используемого в системе, вырабатывается 184,809 кДж чистой энергии. Такимобразом,термическийКПДэнергетическогоцикла получаетсяследующимобразом: 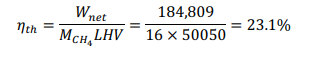 Чтобыопределитьтемпературу выхлопатурбины,запишемследующееуравнение: 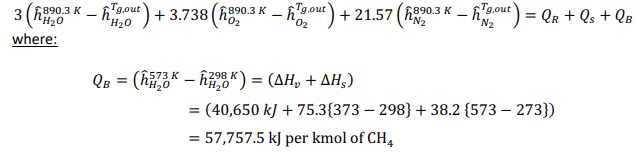 Поэтому: Тепловая эффективность довольно низкая; это простой цикл. Низкая эффективность объясняется низким коэффициентом давления и более низкой максимальной температурой в газотурбинном цикле, разделением CO2 и несколькими необратимостями теплообмена в компонентах теплообмена. Добавление парового цикла в качестве нижнего цикла может повысить эффективность. Проблема 2 (60%)
Начнемстого,чтохимическаяреакцияпроисходитввосстановительномреакторе: Обратите внимание, что поток отработанного топлива представляет собой СO2 + 5H2O.Обозначимкакколичествомолей,поступающихвреакторокисления: 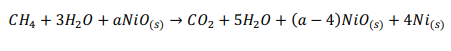 Используяопределениестепениреакции: 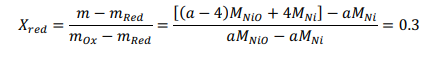 Учитывая, что MNiO= 74,7 кг/кмоль и MNi= 58,7 кг/кмоль, и решая для a , получаем: a = 5.714 Другими словами, 70% NiO, поступающего в восстановительный реактор, вступает в реакцию с одним молем метана. Таким образом, 5,714 моль NiO поступает в восстановительный реактор, а 1,714 моль NiO остается непрореагировавшим. Отметим,чтомассовоесоотношениеNiOиYSZсоставляет3:2,когда=1: 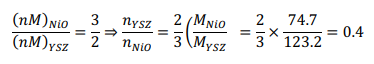 С Определите состав химического цикла и воздушного потока на выходе из реактора окисления: Состав химического контура в восстановительный реактор включает только NiO, поскольку XOx= 1. Весь Ni окисляется до NiO в окислительном реакторе, и состав задается: 5.714 NiO(S) + 2.3ZrO2(S) Для воздушного потока: 4NiO(S) + 2O2 → 4NiO(S). Таким образом, на окисление Ni(s) расходуется 2 моль O2 (из 6 поступивших) Состав выходящего воздушного потока таков: 4O2 + 22.56N2 Определите температуру воздуха на входе в реактор окисления:Применениепервогозаконакреакторуокисления: 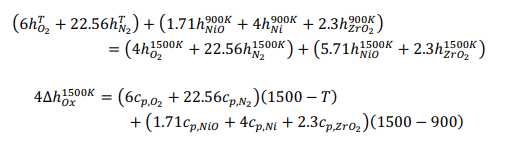 Экзотермическая энтальпия реакции используется для нагрева реактивов до температуры реактора окисления, 1500K. Решение вышеприведенной задачи дает: T = 759.5 K Определите температуру химического цикла на входе в восстановительный реактор:Применениепервогозаконаквосстановительномуреактору: 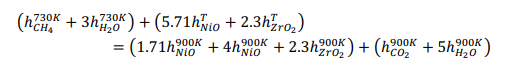 Входящий поток охлаждается до 900 К за счет эндотермической реакции восстановления и нагревания потока топлива до 900 К. Решая вышеприведенное уравнение, получаем: T = 1246 K Определите температуру на выходе из теплообменника 2:Применениепервогозаконактеплообменнику2дает: Решив для температуры выхода, получаем: T = 1392 K
ТепловойКПДустановкирассчитываетсякак: 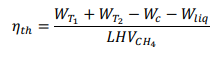 Вэтомрасчетемыотмечаем(удельныетеплотырассчитаныкаквзадаче 1 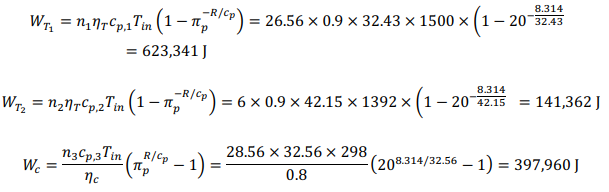 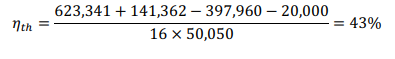  |