Занятие 5.Протолитические равновесия и процессы. Буферные систем. Занятие Протолитические равновесия и процессы. Буферные системы крови
 Скачать 69.87 Kb. Скачать 69.87 Kb.
|
|
Практическое занятие №:5. «Протолитические равновесия и процессы. Буферные системы крови». Общая цель: сформировать базовые знания о механизме действия буферных систем организма, их важной роли в поддержании кислотно-основного баланса как компонента гомеостаза, ценностное отношение к полученным знаниям для последующего медицинского образования. Сделайте записи в рабочей тетради по плану: Дата Номер занятия Тема занятия Основные вопросы темы - учебные вопросы занятия Учебные вопросы занятия: 1.Типы протолитических реакций. 1.1.Количественная оценка силы кислот и оснований (Ka, Kb, pKa, pKb). 1.2.Диссоциация воды. Ионное произведение воды. Водородный показатель. Шкала pH. 1.3.Роль ионов водорода в биологических процессах. Виды кислотности. Интервал значений pH важнейших биологических жидкостей. 2. Буферное действие - основной механизм протолитического гомеостаза организма. 2.1.Буферные растворы: определение, классификация по составу и действию. 2.2.Механизм действия буферных систем. 3.Характеристика буферных систем: 3.1.Расчет pH буферных систем. Уравнение Гендерсона-Гессельбаха. 3.2.Буферная емкость: определение и формула расчета. 3.3.Зона буферного действия: определение, формула расчета. 4.Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая, их состав, механизм действия, буферная емкость. 5.Понятие о кислотно-основном состоянии организма. 5.1. Щелочной резерв крови: определение и количественная оценка. 5.2. Ацидоз, его виды. 5.3. Алкалоз, его виды. 5.4.Применение реакции нейтрализации в фармакотерапии: лекарственные средства с кислотными и основными свойствами (гидрокарбонат натрия, оксид и пероксид магния, трисамин и др.) 6.Решение задач При отработке 1-го учебного вопроса обратите внимание: типы протолитических реакций (нейтрализации, ионизации, гидролиза, автопротолиза) на применимость закона действующих масс для количественного описания силы кислот и оснований Бренстеда. на то, что чистая вода ведет себя как амфолит; на выражение константы автоионизации воды и взаимосвязь между концентрацией ионов водорода и значением pH; жизнедеятельность организма в норме при определенной кислотности биологических жидкостей. При отработке 2 вопроса следует ответить: что такое протолитический гомеостаз объяснить, что такое буферное действие что такое буферные растворы? привести примеры буферных растворов в виде сопряженных кислотно основных пар указать какие буферные растворы поддерживают pHпостоянным в кислой и щелочной части шкалы pH. объяснить механизм действия буферных растворов при добавлении кислоты или щелочи, с помощью химических реакций объяснить почему не происходит смещения pH при разведении буферных растворов? При отработке 3 вопроса следует ответить: написать уравнение Гендерсона-Гассельбаха, сделать его анализ: от чего зависит pH буферного раствора? дать определение буферной емкости, как количественно она оценивается, привести формулу по которой она рассчитывается. от каких факторов зависит буферная емкость? объяснить, что такое зона буферного действия, написать формулу, указать от чего зависит зона буферного действия. При отработке 4 вопроса следует ответить: перечислить буферные системы крови. написать состав всех буферных систем крови в виде сопряженных кислотно-основных пар. на примере одной из буферных систем (по выбору) покажите механизм действия. укажите буферную емкость этих систем в плазме и эритроците. При отработке 5 вопроса, следует ответить: что такое щелочной резерв крови? чем он обеспечивается? факторы, влияющие на изменение щелочного резерва крови, приводящие к смещению pH крови. охарактеризовать ацидоз и алкалоз, их виды. возможная коррекция кислотно-основного равновесия: охарактеризовать химические свойства лекарственные средства с кислотными и основными свойствами (гидрокарбонат натрия, оксид и пероксид магния, трисамин и др.) привести реакции нейтрализации с указанными соединениями. 7.Вопросы и задания для самоконтроля Уравнение ионного произведения воды, его анализ. Водородный и гидроксильный показатели среды. Характеристика кислотности сред по величине pH. Биологическое значение водородного показателя. 5.Буферные системы, их состав, свойства, классификация. Механизм буферного действия. Буферные растворы 6.Уравнение кислых буферных систем Гендерсона- Гассельбаха, его вывод и анализ. Зона буферного действия. 7.Буферная емкость. Факторы, влияющие на величину буферной емкости. 8.Биологическая роль буферных систем. Буферные системы крови: гемоглобиновая, оксигемоглобиновая, белковая, водородкарбонатная, фосфатная, эфиры глюкозы и фосфорной кислоты различной степени замещенности. 9.Роль водородкарбонатной буферной системы в поддержании постоянства рН крови. Ацидоз. Алкалоз. Щелочной резерв крови. Типовые задачи Эталоны решения задач Задача 1. Рассчитать рН раствора соляной кислоты с молярной концентрацией вещества в растворе С(НСl) = 0,001 моль·л-1. Дано: Решение: С  (HCl) = 0,001 моль·дм-3 HCl →H+ + Cl-, т.к. ɑ = 1, то (HCl) = 0,001 моль·дм-3 HCl →H+ + Cl-, т.к. ɑ = 1, то  [H+] = [HCl] = 10-3 моль·л-1 [H+] = [HCl] = 10-3 моль·л-1 рН - ? pH = -lg [H+] pH = -lg10-3 = 3 Ответ: pH = 3. Задача 2. Рассчитать pH раствора гидроксида калия с молярной концентрацией вещества в растворе C(KOH) = 1,5·10-2 моль·л-1. Дано: Решение: С  (KOH) = 1,5·10-2 моль·дм-3 KOH→K+ + OH-, т.к. ɑ = 1, то (KOH) = 1,5·10-2 моль·дм-3 KOH→K+ + OH-, т.к. ɑ = 1, то  [OH-] = [KOH] = 1,5·10-2 моль·л-1. [OH-] = [KOH] = 1,5·10-2 моль·л-1.рН -? pOH = –lg[OH-] pOH = –lg1,5·10-2 = 1,82 pH + pOH = 14 pH = 14 – pOH pH = 14 – 1,82 = 12,18. Ответ: pH = 12,18. Задача 3. pH желудочного сока равен 1,65. Определить концентрации ионов [H+] и [OH-] в желудочном соке. Дано: Решение: p  H = 1,65 pH = –lg [H+] H = 1,65 pH = –lg [H+]  lg [H+] = 10–pH lg [H+] = 10–pH[ 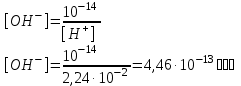 H+] - ? [H+] = 10–1,65 = 0,0224 моль·л-1 = 2,24·10–2 моль·л-1 [OH-] - ? [H+] · [OH-] = 10–14 Ответ: [H+] = 2,24·10–2 моль·л-1 ; [OH–] = 4,46·10–13 моль·л-1. Задача 4. Рассчитайте рН ацетатного буферного раствора, приготовленного из 80 мл 0,1 М раствора СН3СООН и 20 мл 0,1 М раствора СН3СООNa. Ка (СН3СООН) = 1,74 · 10– 5.
Задача 5. Рассчитайте буферную емкость по кислоте, если при добавлении к 100 мл гидрокарбонатного буфера с рН = 6,5 10 мл раствора НСl с молярной концентрацией эквивалента С(НСl) = 0,1 моль/л изменился до 6,3.
Тестовые задания для самоконтроля Выбрать один правильный ответ 1. Сопряженным основанием для C2H5OH2+ является: C2H5O- 2.C2H5OH 3.H2O 4.CH3OH 2. Cогласно протолитической теории вода является: 1. только кислотой; 2. только основанием; 3. как кислотой, так и основанием; 4. ни тем ни другим. 3. Значение pH раствора при pOH = 11 равно 1). 14; 2). 7; 3). 3; 4). 1 4. Протолитическая реакция HS- +H2O ↔ H2S + OH- осн-е к- та с. к-та с. осн-е является реакцией: 1.ионизации 2.нейтрализации 3.гидролиз по аниону 4.гидролиз по катиону 5. Фактор эквивалентности серной кислоты в реакции H2SO4 + 2KOH→ … Составляет: 1)1/2 2) 4 3) 1 2) 2 6. По теории Льюиса кислотой является: 1) любая частица – акцептор протона 2) любая частица – донор протона 3) любая частица – акцептор электронной пары 4) вещество, при диссоциации которого образуется катион водорода и анион кислотного остатка. 7. Ионная сила растворов электролитов определяется согласно теории 1) Бренстеда-Лоури 2) Аррениуса 3) Дебая-Хюккеля 4) Льюиса 8. При гидролизе соли по катиону 1) pH увеличивается 2) pH уменьшается 3) pH не изменяется 4) не влияет на значение pH. 9. Согласно протолитической теории кислотно-основное равновесие устанавливается 1) в результате конкуренции за протон Н+ 2) в результате конкуренции за анион ОН- 3) в результате конкуренции за электронную пару 4) вследствие образования осадка. 10. [H+] = 10-2. Среда раствора 1) нейтральная 2) кислая 3) щелочная 4) водная
Выберать правильный вариант ответа Буферными свойствами обладают сопряженные кислотно- основные пары: а) HCOO-/HCOOH; б)CH3COO-/CH3COOH; в) Cl-/HCl; г)HCO-3/CO2; д)HPO42-/H2PO-4; 1)все; 2)а,б,г,д; 3)б,г,д; 4)б,г. При добавлении HCl в буферной системе NH+4/NH3 ∙H2O: 1)активная концентрация NH+4 уменьшается, NH3 ∙ H2O – увеличивается. 2) активная концентрация NH+4 увеличивается, NH3 ∙H2O - уменьшается. 3)активность компонентов не изменяются. Фосфатная буферная система содержит в организме кислотно-основные сопряженные пары: 1) H3PO4 – кислота,H2PO4- - сопряженное основание; 2) H2PO4- – кислота,HPO2-4 - сопряженное основание; 3) HPO2-4 – кислота, PO3-4 - сопряженное основание; 4) H3PO4 – кислота, PO3-4 - сопряженное основание; При физиологическом значении pH соотношение концентраций компонентов в гидрокарбонатной буферной системе крови [HCO3-]/[CO2] =18:1. Следовательно, буферная емкость этой системы по кислоте в сравнении с буферной емкостью по основанию: 1)больше; 2)меньше; 3)их значения равны. Увеличение щелочных продуктов метаболизма концентрацию CO2 в плазме крови: 1)увеличивает; 2)уменьшает; 3)не изменяет. Концентрации ионов водорода в плазме крови можно рассчитать по уравнению 1) pH = pKa ± 1; 2) pH = pKa + lgсопр. основ/кислота; 3) pH = pKa + lg HCO3- / p ∙ S CO2 4) pH = 14 – pOH Респираторный ацидоз связан 1) с гипервентиляцией легких; 2) с гиповентиляцией легких; 3) с возбуждением дыхательного центра; 4) с повышением концентрации HCO3-. Приготовить буферный раствор с pH = 7,4 можно на основании системы: 1) H3PO4/KH2PO4; 2) HCl/KCl; 3) KH2PO4/K2HPO4; 4) NH4OH/NH4Cl. Роль кислот в составе буферных систем могут выполнять частицы 1) H2PO4-, NH4+; 2) PO43-, CaOH+; 3) H3PO4, Al3+; 4) CH3COOH, Al(OH)2+. Самые мощные буферные системы в составе эритроцитов: 1) ацетатная и белковая; 2) гемоглобиновая и аммиачная; 3) гидрокарбонатная и гемоглобиновая; 4) фосфатная и ацетатная. Дополните высказывание 11. Способность буферных систем сохранять постоянство водородного показателя среды называется ___________________. 12. Водородный показатель среды буферного раствора зависит от природы компонентов буфера, температуры и величины____________. Ключ к тестовому заданию
Задачи для самостоятельного решения 13 .Рассчитать рН для пяти буферных систем, состоящих из уксусной кислоты и ацетата натрия, учитывая, что С(СН3СООН) = С (СН3СООNa) = 0,1 моль/л, а соотношение объемов буферных компонентов [соль]/[кислота] составляет: 1/9; 3/7; 5/5; 7/3; 9/1. Ка (СН3СООН) = 1,74 · 10– 5. Ответ: 3,81; 4,39; 4,76; 5,13; 5,71 14. Рассчитать рН буферного раствора, состоящего из 80 мл раствора NaH2PO4 с концентрацией равной 0,12 моль/л и 30 мл раствора Na2HPO4 с концентрацией 0,14 моль/л. Ка (Н2РО4–) = 6,2 · 10– 8. Ответ: . 6,84 15. К 10 мл сыворотки крови с рН = 7,34 прибавили 1 мл раствора хлороводородной кислоты с С(НСl) = 0,05 моль/л, что привело к снижению рН до 7,29. Определить буферную емкость крови по кислоте. Ответ: 0,1 моль/л Лабораторное занятие Определение водородного показателя биологических жидкостей. Расчёт количественных характеристик буферных Цель: овладеть практическими навыками определения рН растворов с помощью универсального индикатора и экспериментально доказать изменение окраски индикаторов в зависимости от рН среды; освоить принцип потенциометрического определения рН, научиться пользоваться рН-метром; экспериментально сопоставить буферную емкость сыворотки крови по кислоте и по основанию. Учебные вопросы занятия: 1. Инструктаж по выполнению лабораторной работы 2. Выполнение лабораторной работы 2.1. «Определение активной кислотности биологических жидкостей» 2.2.«Определение буферной емкости сыворотки крови» 3.Защита лабораторной работы Материально-техническое обеспечение занятия: учебная аудитория снабжена: справочным материалом, таблицами, мультимедийной установкой; химическое Оборудование и реактивы: рН-индикаторная бумага, иономер, .индикаторный электрод – стеклянный водородный электрод., электрод сравнения – хлорсеребряный электрод,стеклянные стаканы емкостью 50 см3, штативы, бюретки; колбы для титрования; реактивы: исследуемые биологические жидкости, CH3COOH, CH3COONa 0,1M растворы; раствор HCl 0,0001M с pH = 5; H2O дистиллированная; раствор NaOH 0,1 М; сыворотка крови; индикаторы: фенолфталеин, метиловый красный раствор HCl 0,1 M Лабораторная работа 1.Определение активной кислотности биологических жидкостей. Ход работы Задание 1. Определение pH растворов 1 и 2 с помощью универсального индикатора. Чистую палочку опускают в исследуемый раствор и касаются ею полоски индикатора. Сравнивают окраску влажного участка индикаторной бумаги с колориметрической шкалой pH. Определяют pH исследуемого раствора и записывают его значение в таблицу результатов опыта. После определения pH раствора 1 стеклянную палочку моют, протирают куском фильтровальной бумаги и определяют pH раствора 2. Записывают полученные результаты определения в таблицу. Задание 2. Определение pH растворов 1 и 2 с помощью иономера. Перед началом работы знакомятся с инструкцией к прибору.исследуемый раствор наливают в чистый стаканчик, в раствор на 1,5 см опускают электроды. дальнейший порядок выполнения работы описан в «Инструкции по эксплуатации иономера». Перед определением pH электроды осторожно промывают дистиллированной водой и капли воды с электродов убирают фильтровальной бумагой. Полученные результаты записывают в таблицу и рассчитывают активную кислотность растворов по формуле [H+] = 10-pH.
Делают вывод о характере среды в исследуемых растворах. Сравнивают [H+] в обоих растворах. Сравнивают точность обоих методов. Лабораторная работа № 2. «Определение буферной емкости сыворотки крови». Ход работы: В I колбу 5 мл сыворотки крови (pH = 7,4) + 2 капли индикатора фенолфталеина Во II колбу 5 мл сыворотки крови (pH = 7,4) + 2 капли индикатора метилоранжевого. I колбу титруют раствором NaOH до появления малиновой окраски (pH = 8,4) II колбу титруют раствором HCl до появления оранжево-розового окрашивания (pH = 6,4). Записываем объемы (в мл) затраченных растворов NaOH и HCl: I колба – V (NaOH) - мл II колба – V (HCl) - мл Вычисляют буферную емкость сыворотки крови по кислоте и по щелочи: Bв = CfHCl • VHCl/(pH0-pH1) •Vсыв. крови = моль/л Вв = CfNaOH• VNaOH/(pH0-pH1) •Vсыв. крови = моль/л В выводе сравнивают вычисленные значения буферной емкости сыворотки крови по кислоте и по щелочи. Объясняют, почему они различные? Вывод: Вопросы для защиты лабораторной работы 1. Напишите кислотно-основную пару, образующую в организме гидрокарбонатный буфер. 2. Напишите реакции, характеризующие механизм действия фосфатного буфера? 3. Что такое щелочной резерв крови? 4. Какие сопряженные основания обеспечивают щелочной резерв крови? 5. Напишите формулу Гендерсона-Гассельбаха для расчетаpH крови 6. Изменяется ли pH буферного раствора при разбавлении? Дайте пояснение. 7. Каким показателем количественно оценивается щелочной резерв 8. Какое значение имеет pH крови в состоянии кислотно-основного равновесия. 9. Какие буферные системы поддерживают буферную емкость в плазме крови? Как распределяются эти буферные системы по буферной емкости? 10.Какие буферные системы поддерживают буферную емкость во внутренней среде эритроцитов? 11. На титрование 5 мл ацетатного буфера затрачено 3 мл раствора NaOH(Cf) =0,1 моль/л. Рассчитайте буферную емкость системы, если рНо = 3, а после титрования рН = 7,5. 12. Какие факторы влияют на величину буферной емкости? Напишите формулу расчета буферной емкости? 15.Дайте определение буферной емкости. Напишите формулу, по которой рассчитывается буферная емкость. От каких факторов зависит буферная емкость? 16. Почему в крови определяется буферная емкость и по кислоте и по щелочи? 17. Как устроен гальванический элемент для измерения рН биологических жидкостей? 18. Какие ионоселективные электроды применяют в медико-биологичес-ких исследованиях? 19. Как устроен стеклянный водородный электрод? 20. Объясните постоянство потенциала электрода сравнения на примере хлорсеребряного электрода. 21. В чем сущность прямой потенциометрии? 22. В чем сущность потенциометрического титрования? 7.Вопросы и задания для самоконтроля 1.Запишите состав следующих кислотных буферных систем: гемоглобиновой, гидрокарбонатной, фосфатной. Выделите сопряженную кислотно-основную пару для каждого раствора. 2.Выведите уравнения Гендерсона-Хассельбаха для расчета рН кислотного буферного раствора на примере гидрокарбонатного буфера. От чего зависит рН раствора? 3.Запишите состав основного буферного раствора на примере аммиачного. Выделите сопряженную кислотно-основную пару. 4.Выведите уравнения Гендерсона-Хассельбаха для расчета рН основного буферного раствора на примере аммиачного. От чего зависит рОН раствора? 5.Рассмотрите механизм буферного действия при добавлении небольших количеств сильной кислоты или щелочи в буферный раствор. Приведите уравнения реакций. 6.Как влияет разбавление на рН буферных растворов? Дайте объяснение. 7.Что называют буферной емкостью? Запишите формулу расчета меры буферной емкости. 8.От каких факторов буферная емкость? 9.Что такое титрование? Как экспериментально фиксируется точка эквивалентности? 10.Уравнение ионного произведения воды, его анализ. 11.Водородный и гидроксильный показатели среды. 12.Характеристика кислотности сред по величине pH. 13.Биологическое значение водородного показателя. СИТУАЦИОННАЯ ЗАДАЧА В лаборатории имеются 0,2 моль/л и 0,02 моль/л растворы NaH2PO4 и Na2HPO4.Требуется определить буферную емкость этих растворов по кислоте и щелочи. а) Что называется буферной емкостью по кислоте? б) Что называется буферной емкостью по щелочи? в) Что используется в качестве титранта и индикатора при определении буферной емкости по кислоте? г) Что используется в качестве титранта и индикатора при определении буферной емкости по кислоте? д) По какой формуле рассчитывается буферная емкость по кислоте и по щелочи? Эталон решения Буферной емкостью по кислоте называется (Вк) называется количество ммолей эквивалента кислоты, которые нужно добавить к 1 л буферного раствора, чтобы изменить pHна единицу. Буферной емкостью по щелочи называется (Вщ) называется количество ммолей эквивалента щелочи, которые нужно добавить к 1 л буферного раствора, чтобы изменить pHна единицу. При определении Вк в качестве титранта используют кислоту, а в качестве индикатора – метилрот. При определении Вщв качестве титранта используют щелочь, а в качестве индикатора– фенолфталеин. Ва и Вв рассчитывают по формулам: Bк = CfHCl • VHCl/(pH0-pH1) •Vбуф. р-ра (моль/л) Вщ = CfNaOH• VNaOH/(pH0-pH1) •Vбуф. р-ра ( моль/л) Задачи для самостоятельного решения Задача. В лаборатории имеются гидрокарбонатная, фосфатная, аммонийная, ацетатная и карбонатная буферные системы. Требуется выбрать буферную систему для проведения биологического эксперимента при значенииpH= 7,4. pKa(HCO3-) = 10,3; pKa(H2CO3) = 6,35; pKa(NH4+) = 9,25; pKa(CH3COOH) = 4,75; pKa(H2PO4-) = 7,2 а)Каков интервал буферного действия гидрокарбонатной буферной системы? б)Каков интервал буферного действия фосфатной буферной системы? в)Каков интервал буферного действия аммонийной буферной системы? г)Каков интервал буферного действия ацетатной буферной системы? д)Каков интервал буферного действия карбонатной буферной системы? Рекомендуемая литература: Список рекомендуемой литературы Основная литература 1. Попков В.А. Общая химия [Электронный ресурс]: учеб. / В.А. Попков, С.А. Пузаков. - М.: ГЭОТАР-Медиа, 2010. - 976 с. – Режим доступа:http://www.studentlibrary.ru/book/ISBN9785970415702.html 2. Попков В.А. Общая химия [Текст]: учеб. / В.А. Попков, С.А. Пузаков. - М.: ГЭОТАР-Медиа, 2009. - 976 с. Дополнительная литература 3. Жолнин, А.В. Общая химия [Текст] :учеб. / А. В.Жолнин ; под ред. В. А. Попкова, А.В. Жолнина. - М. : ГЭОТАР-Медиа,2012. - 400 с. 4. Жолнин, А.В. Общая химия [Электронный ресурс] :учеб. / А. В. Жолнин ; под ред. В. А. Попкова, А. В. Жолнина. - М. : ГЭОТАР-Медиа, 2014. – 400 с. – Режим доступа: http://www.studentlibrary.ru/book/ISBN9785970429563.html | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
