Занятие Тема Основные понятия химической
 Скачать 93.86 Kb. Скачать 93.86 Kb.
|
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯЭкспериментально определено, что скорость химической реакции CO + Cl2 = COCl2 в любой момент времени протекания реакции равна: v= k(c )0 (c )1,5 . CO Cl2 Укажите общий порядок данной реакции. Можно ли считать, что данная реакция является элементарной? Зависит ли скорость протекания этой реакции от концентрации СО? Реакция 2N2O5 = 2N2O4 + O2 протекает в газовой фазе. Скорость данной реакции равна: v= kp2 N O 2 5 . Укажите порядок реакции. Запишите уравнение, связывающее общую скорость реакции со скоростями по отдельным веществам. Реакция 2CO + O2 = 2CO2 является формально простой. Найдите порядок данной реакции по каждому веществу и общий порядок этой реакции. На основе метода формальной кинетики запишите уравнение, связывающее общую скорость реакции со скоростями по отдельным веществам. Укажите порядок простой реакции по каждому веществу и общий порядок реакции 2А = 4В + С На основе метода формальной кинетики запишите уравнение, свя- зывающее общую скорость реакции со скоростями по отдельным веще- ствам. Укажите порядок реакции по каждому веществу и общий порядок реакции, если она протекает в одну стадию 2А + В = 2С + D + E На основе метода формальной кинетики запишите уравнение, свя- зывающее общую скорость реакции со скоростями по отдельным веще- ствам. Укажите порядок реакции по каждому веществу и общий порядок реакции, если она протекает в одну стадию А + В = 2С + D На основе метода формальной кинетики запишите уравнение, свя- зывающее общую скорость реакции со скоростями по отдельным веще- ствам. Реакция изомеризации CH3NC = CH3CN которая протекает в газовой фазе, имеет первый порядок по компоненту при высоких давлениях и второй — при низких. Как будут выглядеть выражения для скорости реакции по исходному веществу в первом и во втором случаях? Скорость газ фазной реакции 2N2O5 = 2N2O4 + O2 может быть выражена через парциальное давление pi, концентрацию ciи изменение количества молей одного из веществ. Получите соотношения, связывающие эти выражения. Химическая реакция H O + Cr O2- = 2CrO2- + 2H+ 2 2 7 4 которая протекает в жидкой фазе, характеризуется кинетическим урав- нением, идентичным стехиометрическому. Запишите уравнение, связы- вающее общую скорость реакции со скоростями по отдельным вещест- вам. Установите связь между pH и концентрацией Cr O2 , если в перво- 2 7 начальный момент времени продукты реакции отсутствовали и вода взята в большом избытке. Как соотносятся величины константы скорости для реакции третьего порядка, если концентрации выражены в 1/см3 и моль. Практическое занятие 2 Тема: Влияние температуры на скорость химических реакций Цель: С повышением температуры скорость большинства реакций увеличивается. Зависимость скорости реакции от температуры, выраженная графически, дает круто поднимающуюся кривую. Так как концентрации компонентов, участвующих в реакции, при повышении температуры не изменяются, то изменение скорости реакции с температурой обусловлено изменением константы скорости. Для количественного описания зависимости константы скорости от температуры в химической кинетике используют два основных соотношения: правило Вант-Гоффа и уравнение Аррениуса. Правило Вант-Гоффа говорит о том, что при повышении температуры на 10 градусов константа скорости химической реакции увеличивается в 2–4 раза: 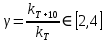 где — температурный коэффициент скорости химической реакции. В общем случае для повышения температуры от T1 до T2 отношение констант скоростей равно: 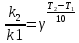 Правило Вант-Гоффа приближенное и применимо только в очень ограниченном интервале температур, так как температурный коэффициент изменяется с температурой. Для большинства реакций зависимость константы скорости от температуры описывается уравнением Аррениуса 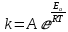 Это уравнение содержит два параметра, которые не зависят от температуры: А — предэкспоненциальный множитель, который определяется только типом реакции; Еa — энергия активации химической реакции, которая характеризует высоту энергетического барьера на пути реакции. Экспоненциальный множитель в уравнении Аррениуса можно интерпретировать, как долю молекул, энергия которых превышает Еa при температуре Т. Предэкспоненциальный множитель А имеет ту же размерность, что и константа скорости, и для реакций первого порядка может быть выражена в обратных секундах. Поскольку в таких единицах выражается частота, величину А иногда называют фактором частоты. Уравнение Аррениуса (5.3) в дифференциальной форме можно записать как: 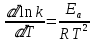 Разделив переменные k и T и считая Ea постоянной величиной, после интегрирования (5.4) получим: 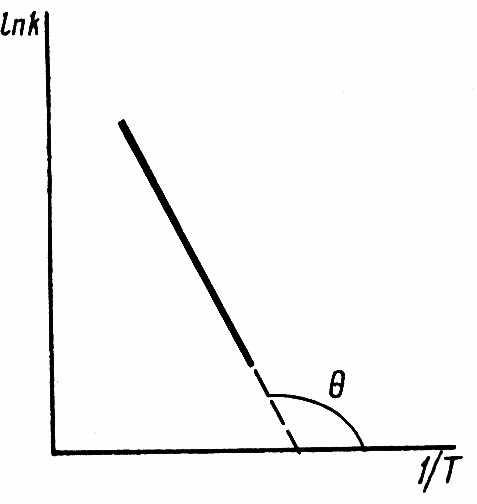 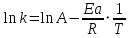 Если уравнение (5.5) справедливо, то на графике в координатах lnk–1/T (рис. 5.1) опытные точки располагаются на прямой линии под углом к оси абсцисс и угловым коэффициентом (тангенсом угла наклона), равным –Еa/R, что позволяет рассчитать энергию активации химической реакции по зависимости константы скорости от температуры: 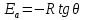 Энергию активации химической реакции можно вычислить по значениям констант скоростей при двух разных температурах. Запишем уравнение (5.5) для температур Т1 и Т2 и вычтем первое уравнение из второго: 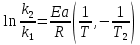 Уравнение для расчета энергии активации химической реакции имеет вид: 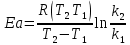 Если данные о величине константы скорости неизвестны, то вместо константы скорости в уравнении Аррениуса можно подставить другие, связанные с ней величины. Например, начальные скорости реакции при разных температурах или время, за которое выход продукта реакции составит заданную величину при разных температурах. В качестве таких данных можно использовать время полупревращения при разных температурах. Уравнение Аррениуса содержит всего два параметра. Для более точного описания экспериментальных данных было предложено трехпараметрическое уравнение: 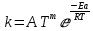 в котором учитывается зависимость предэкспоненциального множителя от температуры. Для реакций, у которых предэкспоненциальный множитель зависит от температуры, определяют эффективную или опытную энергию активации по уравнению 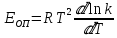 Подставляя уравнение (5.9) в (5.10), находим, что 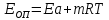 Данные соотношения справедливы не для всех реакций. Например, аномальная зависимость константы скорости от температуры наблюдается иногда для реакций третьего порядка, когда константа скорости с ростом температуры убывает; для некоторых ферментативных реакций константа скорости сначала возрастает, а потом убывает. Всякий раз такие явления требуют особого объяснения исходя из механизмов этих реакций. Энергии активации в уравнениях Аррениуса для прямой и обратной реакции связаны друг с другом через изменение внутренней энергии для суммарной реакции. Если кинетическое уравнение для реакции идеальных газов написать через концентрации, то константы скорости для прямой и обратной реакций (k1 и k2) связаны с константой равновесия Kс соотношением 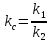 Логарифмируя обе части уравнения (5.11) и дифференцируя их по абсолютной температуре, получим 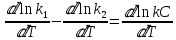 Учитывая уравнение изохоры химической реакции: 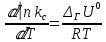 находим, что 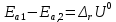 Таким образом, разность энергий активации для прямой и обратной реакций равна изменению внутренней энергии для суммарной реакции. |
