химия 2022. Значение адсорбционных процессов для жизнедеятельности. Физикохимические основы адсорбционной терапии. Гемосорбция
 Скачать 0.66 Mb. Скачать 0.66 Mb.
|
|
Федеральное бюджетное образовательное учреждение высшего образования «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации кафедра медицинской химии Реферат на тему Значение адсорбционных процессов для жизнедеятельности. Физикохимические основы адсорбционной терапии. Гемосорбция. Выполнила: студентка группы Л105 института клинической медицины Зубова Александра Андреевна Проверила: Гаранина Резеда Мухаррамовна, Доцент кафедры медицинской химии Самара, 2022 СОДЕРЖАНИЕ ВВЕДЕНИЕ...................................................................................................3 Определение адсорбционных процессов. Мономолекулярная теория адсорбции........................................................4 Адсорбция на границе раздела твердое тело – газ . Действие активированного угля...................................................................6 Адсорбция на границе раздела твердое тело – раствор..............................8 Влияние адсорбции на жизнедеятельность...............................................9 Адсорбционная терапия..............................................................................11 Гемосорбция.................................................................................................12 Структура биологических мембран...........................................................13 ЗАКЛЮЧЕНИЕ ВЫВОД.........................................................................................................15 СПИСОК ЛИТЕРАТУРЫ............................................................................16 ПРИЛОЖЕНИЕ............................................................................................17 ВВЕДЕНИЕ Актуальность темы: В любом живом организме содержится огромное количество гетерогенных систем, на поверхности раздела которых происходят важнейшие биохимические процессы. Многие из них происходят на поверхности раздела двух фаз. Например, биосинтез, ферментативные реакции и т. д. , поэтому поверхностные явления представляют большой интерес для практической медицины. Адсорбционные процессы используют для удаления токсических веществ из организма. В настоящее время широко ведутся работы по улучшению свойств энтеросорбентов для извлечения из организма радионуклидов (в основном стронция и цезия), а также токсичных тяжелых металлов. Знание адсорбционных процессов позволяет судить о поверхностном натяжении раствора, что дает возможность определить содержание в нем поверхностно-активных веществ (ПАВ). Например, наличие в моче солей желчных кислот заметно понижает ее поверхностное натяжение. Изменение поверхностного натяжения биологических жидкостей используется в диагностических целях. Например, поверхностное натяжение плазмы крови значительно изменяется при различных заболеваниях (анафилактический шок, рак и др.). Измерение величины поверхностного натяжения имеет практическое значение и для аналитических целей: для определения количества ферментов, алкалоидов при оценке физиологических жидкостей и др. Из многочисленных методов измерения поверхностного натяжения при биохимических, физиологических и клинических исследованиях чаще всего используют метод продавливания пузырьков воздуха. Значение адсорбционных процессов велико и с точки зрения физиологии нашего организма. Вода – наиболее часто применяющийся растворитель, она содержится в нашем организме в больших количествах. Вода обладает большим поверхностным натяжением, поэтому по отношению к ней многие вещества являются поверхностно-активными. Поверхностное натяжение биологических жидкостей меньше воды вследствие наличия в них ПАВ различной природы. В результате эти вещества самопроизвольно адсорбируются у стенок сосудов, клеточных мембран, что облегчает их проникновение сквозь эти мембраны. Широкое применение в современной медицине получила адсорбционная терапия как мощный способ детоксификации организма при отравлениях, а также для лечения целого ряда заболеваний: туберкулеза, СПИДа, бронхиальной астмы, острой почечной и печеночной недостаточности и др. Цель работы: Изучить все аспекты темы : " Значение адсорбционных процессов для жизнедеятельности. Физико-химические основы адсорбционной терапии. Гемосорбция. " Сделать реферирование по данной теме, выделив основной материал. Задачи: Изучить основные теоретические вопросы, связанные с поверхностными явлениями и их значение в биологии и медицине; Выделить влияние процесса адсорбции на жизнедеятельность организмов; Изучить химические основы адсорбционной терапии и ее применение в медицине; Изучить процесс гемосорбции и его применение в медицине; Сделать соответствующие выводы по теме. Определение адсорбционных процессов. Мономолекулярная теория адсорбции.Любая система в соответствии со вторым началом термодинамики стремится самопроизвольно перейти в такое состояние, при котором она обладает минимальным запасом энергии Гиббса. Следовательно, она стремится к минимуму поверхностной энергии Гиббса. Поэтому система, образованная одним компонентом, к примеру чистым растворителем (σ = const при Т = const), может понизить запас своей поверхностной энергии Гиббса в данных условиях только одним путем – принять форму, при которой поверхность раздела фаз минимальна. Процесс самопроизвольного перераспределения растворенного вещества на границе раздела фаз относительно объема раствора называется адсорбцией. Иначе-адсорбцией называют явление накопления одного вещества на поверхности другого. Вещество, которое адсорбируется, называется адсорбтивом, твердое вещество, на поверхности которого происходит адсорбция - адсорбентом или адсорбатом. В энергетическом отношении участки поверхности твердого тела неравноценны. Участки поверхности с наибольшим локальным запасом поверхностной энергии Гиббса называются активными центрами, на которых в первую очередь и происходит адсорбция. Адсорбция вещества – обратимый процесс, заканчивающийся установлением адсорбционного равновесия, при котором скорость адсорбции равна скорости обратного процесса – десорбции (адсорбция десорбция). Зависимость адсорбции от равновесной концентрации растворенного вещества при постоянной температуре называют изотермой адсорбции. ( рис. 1 ) Адсорбция поверхностно-активных веществ одного и того же гомологического ряда изменяется в соответствии с правилом Дюкло–Траубе: с ростом длины углеводородного радикала молекул ПАВ адсорбции вещества увеличивается. ( рис. 2 ) Неполярные адсорбенты, например, графитированная сажа или активированный уголь, лучше адсорбируют неполярные органические соединения. Полярные адсорбаты лучше адсорбируются на поверхности полярных адсорбентов, таких, к примеру, как силикагель, оксид алюминия, целлюлоза и др. При одной и той же массе адсорбента адсорбция возрастает с увеличением удельной поверхности (т.е. измельчении) адсорбента. Уравнение Гиббса универсально для расчета величины адсорбции, т.е. применимо как для подвижных границ раздела, так и для неподвижных. Но на практике невозможно измерить величину поверхностного натяжения на поверхности твердого вещества. Для описания экспериментально полученных данных по адсорбции на поверхности как твердого вещества, так и жидкости, предложено большое число уравнений, но чаще используются уравнения Лэнгмюра и Фрейндлиха. ( рис. 3 ) Адсорбция зависит от химической и физической природы адсорбента и адсорбтива. Например, на активированном угле ароматические вещества адсорбируются лучше, чем алифатические. Адсорбция веществ, относящихся к одному и тому же гомологическому ряду, часто возрастает с увеличением длины углеродной цепи. Помимо природы и концентрации растворенного вещества, его адсорбция на поверхности жидкости также зависит от температуры: с ростом температуры адсорбция уменьшается. Мономолекулярная теория адсорбции. Мономолекулярная теория адсорбции была предложена в 1915 году американским физико-химиком И.Лэнгмюром. Мономолекулярная теория адсорбции включает в себя следующие положения: Частицы адсорбируемого вещества располагаются только на активных центрах, представляющих собой отдельные атомы или группы атомов, выступающие над поверхностью адсорбента, и характеризующиеся наибольшей ненасыщенностью химических связей. Каждая частица адсорбируемого вещества занимает один активный центр адсорбента. Адсорбция заканчивается как только образуется мономолекулярный слой. В этот момент все активные центры заняты и поверхность адсорбента покрыта слоем адсорбата толщиной в одну молекулу. Адсорбированные молекулы удерживаются активными центрами только в течение определенного промежутка времени, после чего покидают поверхность и их место занимают другие молекулы, т.е. адсорбция носит динамический характер. При равновесии скорости адсорбции и десорбции равны. Взаимодействие между адсорбированными молекулами отсутствует. Это означает, что пребывание молекул на активных центрах не влияет на процесс адсорбции на соседних активных центрах. Адсорбция на границе раздела твердое тело – газ. Действие активированного угля.Твердыми телами могут адсорбироваться газы и пары, а также молекулы и ионы растворенных веществ. Явление концентрирования газов на границе твердое тело – газ (адсорбция газов твердыми телами) открыли в конце ХVIII в. независимо друг от друга шведский химик и фармацевт К. Шееле и итальянский профессор Ф.Фонтана. Он обнаружил, что свежепрокаленный древесный уголь способен поглощать различные газы в объемах, значительно превосходящих его собственный объем. К. Шееле установил, что в ряде случаев указанный выше процесс обратим: при изменении условий поглощенный газ может выделяться. Адсорбция газа на твердом теле является простейшим случаем адсорбции, так как система состоит всего из двух компонентов. Адсорбция на твердых телах может быть объяснена наличием силовых полей притяжения, возникающих за счет неуравновешенных связей в кристаллической решетке. Адсорбционные силы могут быть достаточно велики, например, для полного удаления со стекла адсорбированных молекул воды его необходимо сильно нагревать в вакууме. Адсорбенты, обладающие мощными силовыми полями, оказываются сплошь покрытыми адсорбированными частицами. При незначительных же адсорбционных силах только более активные центры покрываются адсорбируемыми частицами. В самом начале адсорбции , когда давление газов мало, наблюдается химическая адсорбция, а с увеличением давления она уступает место физической, которая в основном определяет адсорбцию газов. Адсорбция газа, как уже отмечалось, будет зависеть от температуры, давления, природы адсорбата, от природы и удельной поверхности адсорбента. С повышением давления газа или пара адсорбция их твердым телом увеличивается. На поверхности твердого тела при прочих равных условиях лучше адсорбируются те газы, которые легче конденсируются в жидкость. Например, активированный уголь хорошо адсорбирует хлор (Т кип = 239,7 К), аммиак (Т кип. = 240,0 К), но не адсорбирует СО2 (Т кип. = 83,0 К), азот (Т кип = 77,0 К), водород (Т кип = 20,0 К). Адсорбционные действия активированного угля Уже около 1550 г. до н.э., в старом египетском папирусе упоминалось о применении древесного угля в медицине. Активированный уголь - это идеальный сорбент, обладающий способностью поглощать, удерживать на своей твёрдой поверхности ядовитые вещества, не давая им проникнуть в клетки организма. Обладая высокой адсорбирующей способностью за счёт пористой структуры, активированный уголь увеличивает контактную поверхность. Благодаря этому препарат активированного угля поглощает токсические вещества, а так же вещества синтетического и растительного происхождения, удерживает и выводит их. Активированный уголь адсорбирует много токсичных веществ. Считается, что его следует применять на протяжении двух часов с момента отравления. За это время уголь в состоянии связать большую часть токсинов в желудочно-кишечном тракте. Уголь адсорбирует много разных токсинов, но действует он не на все токсины. Поэтому уголь не следует применять в случае отравления сильными кислотами, непищевыми спиртами, растворителями и тяжелыми металлами. Уголь также не адсорбирует пестициды. Адсорбция на границе раздела твердое тело – растворЯвление адсорбции из растворов твердыми телами было открыто и изучено в 1785 г. русским химиком и фармацевтом Т.Е.Ловицем. При адсорбции из раствора вместе с растворенным веществом адсорбируются молекулы растворителя. Количества адсорбированных частиц растворенного вещества и растворителя зависят от их собственной адсорбционной способности и концентрации раствора. Чем хуже растворитель смачивает поверхность адсорбента, чем хуже растворяет вещество, тем лучше происходит адсорбция растворенного вещества. За активные центры принимаются молекулы растворителя. Различают: молекулярную адсорбцию; ионную адсорбцию; ионообменную адсорбцию. Неэлектролиты и слабые электролиты на поверхности адсорбента адсорбируются из растворов в виде молекул. Такой процесс называется молекулярной адсорбцией. В результате адсорбции концентрация растворенного вещества в растворе уменьшается. В данном случае адсорбция зависит от природы адсорбента и растворителя, от природы и концентрации адсорбата, от температуры, а также от удельной поверхности адсорбента. Молекулярная адсорбция – адсорбция на поверхности адсорбента молекул неэлектролитов. В случае молярной адсорбции адсорбат должен занимать промежуточное значение по полярности между полярностью адсорбента и полярностью растворителя. Влияние природы растворителя на адсорбцию (правило Шилова): чем лучше растворяется адсорбтив в растворителе, тем он хуже адсорбируется поверхностью твердого адсорбента. Малополярные адсорбенты (уголь) лучше адсорбируют неполярные органические соединения. Полярные адсорбтивы лучше адсорбируются на поверхности ионных кристаллов, оксидов. Ионная адсорбция – адсорбция сильных электролитов из водных растворов, обусловленная химическими и электростатическими силами. Ионы избирательно адсорбируются на поверхностях, состоящих из ионов или полярных молекул. Правило избирательной адсорбции Пескова – Фаянса: на твердой поверхности адсорбента в первую очередь адсорбируются ионы, которые: входят в состав кристаллической решетки адсорбента; способны достраивать кристаллическую решетку адсорбента; изоморфны с ионами адсорбента. Влияние природы ионов на их адсорбционную способность: ионы адсорбируются тем лучше, чем больше заряд иона, чем больше радиус иона и чем больше поляризуемость иона. Ионообменная адсорбция - процесс обмена ионов между раствором и ионообменником (сорбентом). Ионообменники (иониты) – высокомолекулярные полиэлектролиты, состоящие из синтетического нерастворимого каркаса с привитыми функциональными группами кислотного (-SO3Н, -COOН, и др.) и основного ( =NH, -NH2 и др.) характера. Особенности ионообменная адсорбции специфична, каждый адсорбент (ионит) обменивается определенными типами ионов; не всегда обратима; протекает более медленно, чем молекулярная адсорбция; часто меняется рН среды. При адсорбции из растворов, содержащих смесь многих веществ, в одних случаях вещества адсорбируются в количествах, пропорциональных адсорбционной способности каждого из них, в других случаях одни вещества препятствуют адсорбции других (антагонизм); наконец, возможны случаи, когда вещества взаимно усиливают адсорбцию (синергизм). Влияние адсорбции на жизнедеятельность.Явления адсорбции имеют большое биологическое значение. В организме имеется огромное количество поверхностей, на которых идут адсорбционные процессы. Это, во-первых, поверхности раздела между организмом и средой, затем поверхности стенок сосудов, разнообразнейшие мембраны, поверхности клеток, поверхности ядер, поверхности вакуолей и, наконец, поверхности коллоидных частиц протоплазмы. На всех этих поверхностях в процессе обмена веществ могут адсорбироваться различные вещества. Явления адсорбции широко распространены в жидкостях и тканях организма. Такие важные жизненные процессы как, питание, дыхание, выделение и другие процессы жизнедеятельности организма сопровождаются многообразными явлениями адсорбции. Адсорбенты находят широкое применение в очистке газов и жидкостей от примесей. Они бывают жидкими и твердыми (чаще твердыми). Способность удерживать на поверхности молекулы газов и жидкостей ( т. е. адсорбировать ) зависит от свойств твердого тела, размеров его частиц, а также наличия на поверхности мельчайших пор и капилляров. По этим признакам и подбирают адсорбенты. Обычно их используют в виде порошков, и это понятно – суммарная поверхность у порошка намного больше. У классических адсорбентов – активированного угля, силикагеля (пористая белая масса, по составу диоксид кремния SiO2), цеолитов (минералов, близких к полевым шпатам)- поверхность порошка массой 1 г. (удельная поверхность) составляет 500-1000 м2. Именно благодаря адсорбции осуществляется первая стадия поглощения различных веществ из окружающей среды клетками и тканями биологических систем, функционирование биологических мембран, первые этапы взаимодействия ферментов с субстратом, защитные реакции против токсичных веществ. Многие адсорбенты (активный уголь, каолин, иониты) служат противоядиями, поглощая и удаляя из организма вредные вещества. Адсорбция играет большую роль в процессе капиллярной конденсации т.е. конденсации пара в капиллярах и микротрещинах пористых тел или в промежутках между тесно сближенными твёрдыми частицами. Необходимым условием капиллярной конденсации является смачивание жидкостью поверхности тела (частиц). Капиллярная конденсация начинается с адсорбции молекул пара поверхностью конденсации и образования менисков жидкости. При вогнутой форме менисков давление насыщенного пара над ними ниже, чем давление насыщенного пара над плоской поверхностью. В результате капиллярная конденсация происходит при более низких давлениях пара, чем давление насыщения. Объём сконденсировавшейся в порах жидкости достигает предельной величины при внешнем давлении пара р = ро. В этом случае поверхность раздела жидкость - газ имеет нулевую кривизну. Сложная капиллярная структура пористого тела может служить причиной капиллярного гистерезиса - зависимости количества сконденсировавшейся в порах жидкости не только от давления пара, но и от предыстории процесса, т. е. от того, как было достигнуто данное состояние: в процессе конденсации или же в ходе испарения жидкости, капиллярная конденсация увеличивает сорбцию паров пористыми телами, в особенности вблизи точки насыщения паров. Капиллярная конденсация используется в промышленности для улавливания жидкостей тонкопористыми телами (сорбентами). Большую роль капиллярная конденсация играет также в процессах сушки, удержания влаги почвами, строительными и др. пористыми материалами. По исследованиям Траубе поверхностно-активные вещества легко проникают в клетку, а пищевые вещества, как правило, поверхностно-активны. Поэтому, первым этапом усвоения пищи после ее переваривания и расщепления на доступные молекулы в желудочно-кишечном тракте, является адсорбция питательных веществ, после чего уже начинается процесс химического превращения. Процессы метаболизма ( обмена веществ ) так же основаны на механизме адсорбции. Обмена веществ в организме осуществляются посредством разнообразных специфических катализаторов-ферментов, являющихся коллоидами. Первые стадии действия фермента сводятся к адсорбции субстрата на поверхности ферментного комплекса, и только после этого фермент проявляет свое специфическое каталитическое действие. Легочная ткань подобна адсорбенту - носителю, на котором удерживается гемоглобин крови, обеспечивающий перенос кислорода в организм. Многие функции биологических мембран живой клетки связаны со свойствами их поверхности, например, общая площадь биологических мембран в организме человека достигает десятков тысяч квадратных метров. Даже такие наши чувства, как обоняние и вкус, зависят от адсорбции молекул соответствующих веществ в носовой полости и на языке. Сегодня адсорбция составляет основу многих промышленных операций и научных исследований. Наиболее важные из них - очистка, выделение и разделение различных веществ, адсорбционная газовая и жидкостная хроматография. Адсорбция является важной стадией гетерогенного катализа и коррозии. Исследования поверхности тесно связаны с развитием полупроводниковой техники, медицины, строительства и военного дела. Адсорбционные процессы играют ключевую роль при выборе стратегии защиты окружающей среды. Адсорбционные методы исследования свойств поверхности позволяют количественно охарактеризовать происходящие при адсорбции межмолекулярные взаимодействия адсорбат-адсорбент и адсорбатадсорбат, определить термодинамические характеристики адсорбционного равновесия (например, теплоту и энтропию адсорбции), а также исследовать геометрические параметры адсорбента (величину удельной поверхности, объем пор и распределение пор по размерам, характерные для данного материала). Такие исследования необходимы для понимания факторов, управляющих адсорбционными процессами и обеспечивающих возможность выбора и разработки эффективных адсорбентов с необходимыми для решения конкретных задач свойствами. Адсорбционная терапияАдсорбционная терапия широко применяется в современной медицине как мощный способ детоксификации организма при отравлениях, а также для лечения целого ряда заболеваний: туберкулеза, СПИДа, бронхиальной астмы, острой почечной и печеночной недостаточности и других видов патологии. Кроме того, использование сорбентов рассматривается как эффективный метод очистки организма от радионуклидов, что особенно актуально для жителей регионов, подвергшихся радиоактивному загрязнению в результате аварии на ЧАЭС. В последние годы появились многочисленные публикации о применении сорбентов для регулирования обмена холестерина и предупреждения развития атеросклероза и ишемической болезни сердца. Связывая холестерин, сорбенты уменьшают риск развития сердечно-сосудистой патологии. Адсорбционная терапия – это клинический способ очистки организма от токсинов и других вредных веществ. В современной медицине твердые сорбенты применяются для проведения: гемо - , лимфо - и плазмо - сорбции, а также энтеросорбции. Адсорбция лежит в основе клинического анализа крови на СОЭ (скорость осаждения эритроцитов). Так, при инфекционных заболеваниях в крови происходит обменная адсорбция: вместо ионов электролитов поверхность эритроцитов занимают молекулы белков. При этом заряд эритроцитов понижается и они быстрее объединяются и оседают. Адсорбционная терапия применяется для удаления токсинов и вредных веществ из пищеварительного тракта. Такие адсорбенты, как гидроксид алюминия, оксид магния, фосфат алюминия, входят в состав препаратов альмагель , фосфалюгель. Активированный уголь давно применяется как адсорбент газов (при метеоризме), токсинов (при пищевых токсикоинфекциях), алкалоидов и тяжелых металлов (при травлениях). Хорошей адсорбирующей способностью обладает клетчатка. Содержание клетчатки у больных сахарным диабетом должно быть не меньше 25 г/1000 ккал: клетчатка замедляет всасывание сахаров, компенсируя повышение концентрации глюкозы в плазме после приема пищи. На основе оксида кремния создан препарат полисорб – неселективный полифункциональный энтеросорбент. Его применяют для выведения из организма патогенных бактерий и их токсинов, пищевых аллергенов, солей тяжелых металлов, радионуклидов, этанола, а также ядов различного происхождения. ГемосорбцияГемосорбция - метод лечения, направленный на удаление из крови различных токсичных продуктов и регуляцию гомеостаза путем контакта крови с сорбентом вне организма. При контакте крови с гемосорбентом наблюдается конкуренция за активные центры между веществами, подлежащими удалению, и веществами, наличие которых обеспечивает жизненно необходимые функции. Использование неспецифических сорбентов делает процедуру гемосорбции практически неуправляемой, так как при этом удаляются и токсиканты, и вещества, находящиеся в плазме в норме. Эффективность этого метода лечения в настоящее время связана с созданием высокоспецифичных сорбентов конкретных метаболитов, ионов, токсинов. Важной проблемой гемосорбции является создание сорбентов, совместимых с кровью (гемосовместимых сорбентов). Разработана методика гемосорбции с наложенным электрическим потенциалом, что обеспечивает ускорение процесса. Структура биологических мембран.Существование минимального значения поверхностного натяжения у растворов ПАВ и предельного значения адсорбции позволили И.Лэнгмюру (1881-1957) высказать предложение об ориентации адсорбированных молекул в поверхностном слое. Молекулы ПАВ состоят из двух частей: полярной (гидрофильной) и неполярной (гидрофобной). При адсорбции полярная группа, обладающая большим сродством с полярной фазой (например, с водой) втягивается в нее. В то же время неполярная группа выталкивается в неполярную фазу. Как видно из рисунков (рис. 4 и 5 ) при малых концентрациях ПАВ углеводородные радикалы лежат на поверхности полярной жидкости, а полярные группы погружены в нее. С увеличением концентрации ПАВ в растворе число молекул, находящихся в поверхностном слое, возрастает. Это приводит к образованию на границе поверхности насыщенного мономолекулярного адсорбционного слоя , в котором молекулы ПАВ предельно ориентированы. Данный слой образно называется молекулярным частоколом Лэнгмюра. Эти представления об ориентации молекул ПАВ в насыщенном адсорбционном слое сыграли большую роль в развитии учения о структуре биологических мембран. Клеточные мембраны образованы главным образом молекулами двух типов: липидами и белками. Липиды нерастворимы в воде, но растворимы в органических растворителях. Особенностью мембранных липидов является то, что на одном конце их молекулы есть полярные группы (например, –СООН), обладающие гидрофильными свойствами, тогда как другой ее конец представляет собой длинную углеводородную цепь с гидрофобными свойствами. Липиды образуют бимолекулярные пленки, в которых полярные группы располагаются на обеих поверхностях мембраны, а неполярные погружены внутрь ее. Молекулы белка могут располагаться вблизи внешней и внутренней поверхностей мембраны, а также проникать, частично или полностью, через всю ее толщину. ЗАКЛЮЧЕНИЕ А  дсорбционные процессы играют значительную роль в жизнедеятельности организмов. Благодаря абсорбции осуществляются такие процессы как : питание, дыхание, выделение и другие. Адсорбционные явления чрезвычайно широко распространены в живой и неживой природе. дсорбционные процессы играют значительную роль в жизнедеятельности организмов. Благодаря абсорбции осуществляются такие процессы как : питание, дыхание, выделение и другие. Адсорбционные явления чрезвычайно широко распространены в живой и неживой природе. Адсорбцией называют процесс поглощения вещества из смеси газов, паров или растворов поверхностью или объемом пор твердого тела адсорбента. Методы адсорбции сейчас широко используются в медицинской практике. Адсорбционные процессы используют для удаления токсических веществ из организма. В настоящее время эти методы широко применяют для извлечения из организма радионуклидов и токсичных тяжелых металлов. Знание адсорбционных процессов позволяет судить о поверхностном натяжении раствора, что дает возможность определить содержание в нем поверхностноактивных веществ. Изменение поверхностного натяжения биологических жидкостей используется в диагностических целях. Измерение величины поверхностного натяжения имеет практическое значение и для аналитических целей. Широкое применение в современной медицине получила адсорбционная терапия как мощный способ детоксификации организма при отравлениях, а также для лечения целого ряда заболеваний: туберкулеза, СПИДа, бронхиальной астмы, острой почечной и печеночной недостаточности и др. Гемосорбция является методом лечения, направленным на удаление из крови различных токсичных продуктов и регуляцию гомеостаза путем контакта крови с сорбентом вне организма. Также широко применяется в медицине. Эффективность этого метода лечения в настоящее время связана с созданием высокоспецифичных сорбентов конкретных метаболитов, ионов, токсинов. Важной проблемой гемосорбции является создание сорбентов, совместимых с кровью (гемосовместимых сорбентов). Разработана методика гемосорбции с наложенным электрическим потенциалом, что обеспечивает ускорение процесса. Явления адсорбции имеют большое биологическое значение. В организме имеется огромное количество поверхностей, на которых идут адсорбционные процессы СПИСОК ЛИТЕРАТУРЫПроцессы и аппараты: учебник для студ. учреждений сред. проф. образования/ Д. А. Баранов, А. М. Кутепов. — 2-е изд., — М.: Издательский центр «Академия», 2005; П  роцессы и аппараты химической технологии: Учебник для вузов./ Дытнерский Ю. И. Изд. 2-е. В 2-х кН. Часть 2. Массообменные процессы и аппараты. М.: Химия, 1995; роцессы и аппараты химической технологии: Учебник для вузов./ Дытнерский Ю. И. Изд. 2-е. В 2-х кН. Часть 2. Массообменные процессы и аппараты. М.: Химия, 1995;Киселев А.В. Межмолекулярные взаимодействия в адсорбции и хроматографии . М.: Высш.шк. , 1986 ;
ПРИЛОЖЕНИЯ Рис 1. Изотерма адсорбции 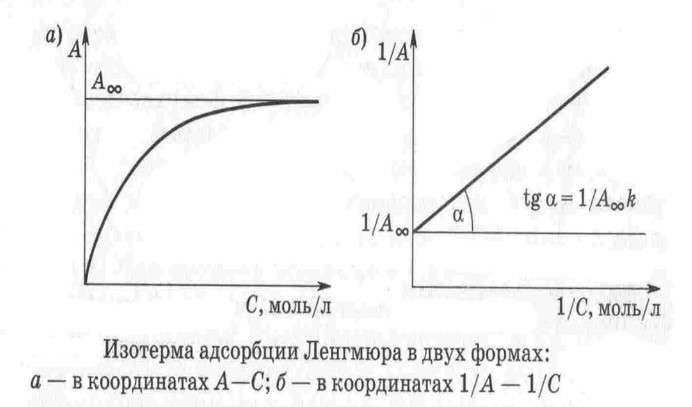 Рис. 2 Правило Дюкло-Траубе 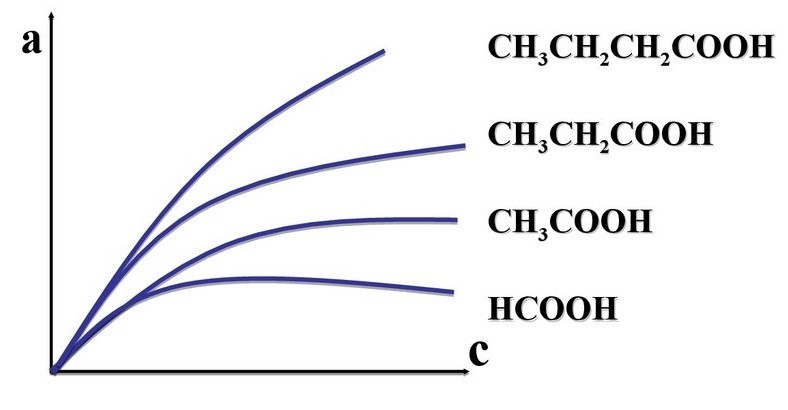  Рис.3 Уравнение Лэнгмюра Рис. 4 и 5 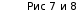  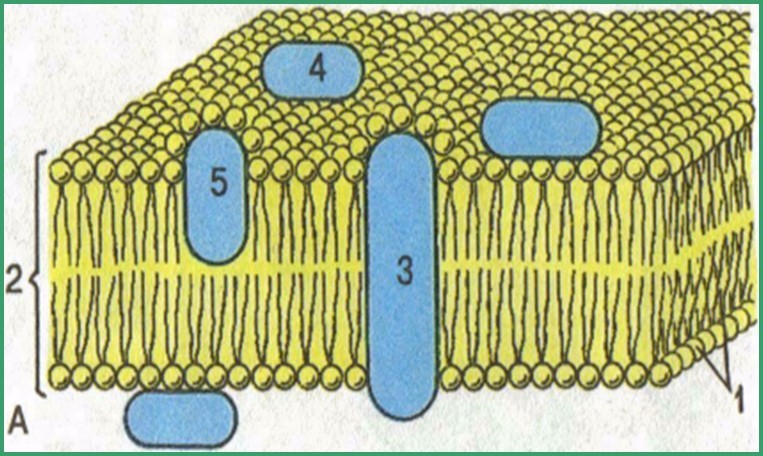 |
