Шпоры по вопросам для физики. Шпоры по физике (1) (1). 1. 1 Осн положения молеккинет теории 1 Все вещества состоят из частиц, между которыми есть промежутки
 Скачать 158.01 Kb. Скачать 158.01 Kb.
|
|
1.1 Осн положения молек-кинет теории 1) Все вещества состоят из частиц, между которыми есть промежутки. Все вещества состоят из отдельных частиц - молекул и атомов. Между частицами есть промежутки. Мельчайшая частица – молекула. Подтверждение: Косвенные – Кратное отношение масс, Тепловое расширение, Диффузия, Испарение веществ Прямое – Ионный микроскоп 2) Частицы движутся хаотично и беспорядочно. С ростом температуры скорость частиц вещества увеличивается, поэтому беспорядочное движение частиц принято называть тепловым. Это движение не зависит от внешних воздействий. Движение происходит в непредсказуемом направлении из-за столкновения молекул. Подтверждение - броуновское движение и диффузия 3) Частицы взаимодействуют друг с другом силами притяжения и отталкивания. Молекулы и атомы взаимодействуют друг с другом с силами, имеющими электрическую природу. Частицы вещества одновременно и притягиваются, и отталкиваются друг от друга, и по этой причине располагаются на определенных расстояниях друг от друга. Подтверждение - существование макроскопических тел 1.2 Термодинам система. В термодинамике физические тела и их модели называют термодинамическими системами. Для их описания используют параметры системы: давление, объём, температура (макропараметры), а не физич хар-ки молекул (микропараметры). Макропараметры можно непосредственно измерить, используя приборы, или выразить через другие величины, которые можно измерить на опыте. Мы рассмотрим простейшие термодинамические системы, состояние которых определяют, используя только давление, объём и температуру. Тела, образующие термодинамическую систему, могут обмениваться с окружающей средой энергией, а также веществом. Если этого не происходит, то термодинамическую систему называют замкнутой или изолированной. 2.1 Броуновское движение – это тепловое движение взвешенных в жидкости или газе частиц, и оно не может прекратиться. С увеличением температуры интенсивность его растёт. Причина броуновского движения частицы: удары молекул жидкости или газа о частицу не компенсируют друг друга. При беспорядочном движении молекул передаваемые ими броуновской частице импульсы (слева и справа) неодинаковы. Поэтому отлична от нуля результирующая сила давления молекул жидкости на броуновскую частицу, она и вызывает изменение движения частицы. 2.2 При теплообмене происходит изменение внутренней энергии тела. Мерой изменения внутренней энергии при теплообмене является количество теплоты и работа. Количество теплоты — это мера изменения внутренней энергии, которую тело получает (или отдает) в процессе теплообмена. Таким образом, и работа, и количество теплоты характеризуют изменение энергии, но не тождественны энергии. Они не характеризуют само состояние системы, а определяют процесс перехода энергии из одного вида в другой (от одного тела к другому) при изменении состояния и существенно зависят от характера процесса. Основное различие между работой и количеством теплоты состоит в том, что работа характеризует процесс изменения внутренней энергии системы, сопровождающийся превращением энергии из одного вида в другой (из механической во внутреннюю). Количество теплоты характеризует процесс передачи внутренней энергии от одних тел к другим (от более нагретых к менее), не сопровождающийся превращениями энергии. 3.1 Характер движ молекул в газах, жидкостях и твердых телах. В газах – прямолинейно и равномерно между столкновениями В жидкостях – колебания с частыми перескоками В твердых – колебания с очень редкими перескоками В газах молекулы непрерывно и беспорядочно движутся с довольно большой скоростью, изменяя направление движения при столкновении друг с другом или с преградой, например, со стенками сосуда. В жидкостях молекулы ограничены в движении, но могут колебаться, вращаться и перемещаться относительно друг друга. В твердых телах молекулы и атомы колеблются около некоторого среднего положения (положения равновесия). 3.2. Теплоемкость тела – количество теплоты, необходимое для увеличения температуры на один градус у тела произвольной массы Удельная теплоемкость вещества – постоянная c численно равна количеству теплоты, которое нужно сообщить единице массы вещества, чтобы изменить его температуру на 1 градус. Молярная теплоемкость – теплоемкость одного моля вещества Для изменения преданного количества теплоты была введена специальная единица – калория. Калория – количество теплоты, которое нужно сообщить 1г воды, чтобы увеличить его температуру на один градус. 4.1 Масса и размер молекул. Молекула – минимальная единица вещества, обладающая химическими свойствами данного вещества. Масса молекулы определяется суммой масс всех атомов, входящих в ее состав. Массы атомов измеряются в атомных единицах массы, а масса молекулы - в молях. Существует несколько методов для определения размера молекул. Метод диффузии: этот метод основан на измерении скорости диффузии молекул в жидкостях и газах. Он основан на том, что скорость диффузии зависит от размера молекулы. Более крупные молекулы имеют меньшую скорость диффузии, чем более мелкие. Этот метод широко используется для измерения размеров молекул в газообразных средах. Метод светорассеяния: этот метод основан на изменении направления света, вызванном рассеянием света на молекулах. Изменение направления света связано с изменением размера молекулы, поскольку большие молекулы рассеивают свет в больших углах, чем маленькие молекулы. Этот метод используется для измерения размеров молекул в жидкостях и газах. 4.2 Адиабатический процесс – процесс изменения термодинамических параметров системы (давления, объема, температуры). Во время адиабатического процесса нет теплообмена между системой и окружающей средой, а изменение внутренней энергии системы происходит только за счет работы, выполненной на систему или совершенной системой. Во время адиабатического процесса энергия сохраняется, то есть работа, совершаемая на систему, превращается только в изменение ее внутренней энергии, а не в тепло. Поэтому, при адиабатическом процессе температура системы может изменяться, но внутренняя энергия системы остается постоянной.  5.1 Моль вещества. Постоянная Авогадро Количество вещества – физическая величина, характеризующая количество молекул, входящих в некую порцию вещества Моль вещества - это единица измерения количества вещества, определенная как количество вещества, содержащее столько элементарных частиц (атомов, молекул, ионов и т.д.), сколько атомов содержится в 12 граммах углерода-12. Значение моли в химии заключается в том, что она позволяет связать массу и количество вещества, что необходимо для выполнения различных расчетов. Постоянная Авогадро - фундаментальная физическая константа, которая определяет число элементарных частиц (атомов, молекул, ионов и т.д.) в одной моли вещества Число Авогадро – колво атомов в 12г углерода. NA = 6⋅1023 моль−1 Значение постоянной Авогадро играет важную роль в химии и физике, тк позволяет проводить расчеты кол-ва вещ-ва на молекулярном уровне, определять концентрации растворов, производить другие расчеты, связанные с количеством элементарных частиц вещества. 5.2 Первый закон термодинамики. Вечный двигатель первого рода невозможен (газ не может бесконечно совершать работу) или количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами. В изопроцессах, происход. в идеальном газе, используется уравнение состояния идеального газа, которое связывает давление, объем, температуру и количество вещества. Из этого уравнения можно вывести формулу для работы, совершенной идеальным газом в изопроцессе – A=pΔV. Также существует формула A=VRΔT. Работа газа на замкнутом цикле численно равна площадью внутри фигуры. При T = Const - Q=Aг, при V = const – Q=ΔU, при p=const – Q=ΔU+Aг, при Q=0 – Aг= -ΔU 6.1 Тепловое равновесие – состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными. Не изменяется объем и давление, не происходит теплообмен, отсутствуют взаимные превращения газов, жидкостей и твердых тел. Температура системы остается постоянной. Но макроскопические процессы внутри тела не прекращаются: молекулы меняют положение, и меняется скорость при столкновениях Температура – это физическая величина, характеризующая степень нагретости тела или системы. Температура является мерой средней кинетической энергии хаотического движения молекул в макроскопич. телах. Физич. смысл температуры заключается в том, что она определяет направление потока тепла между системами. Тепло всегда течет от объекта с более высокой температурой к объекту с более низкой температурой, пока не установится тепловое равновесие. 6.2 Работа в термодинамике. Одним из способов изменения внутренней энергии термодинамической системы является совершение работы. Этот способ характеризуется передачей энергии в процессе механического взаимодействия тел. При этом механическая энергия одного тела переходит во внутреннюю энергию другого тела или, наоборот, убыль внутренней энергии одного тела сказывается на увеличении механической энергии другого тела. Таким образом, при совершении работы происходит превращение энергии из одной формы в другую. (A газа = pΔV) (A над газом= - pΔV) Геометрический смысл А в термодинамике - численное равенство площади фигуры под графиком в осях pV 7.1 Шкала температур Цельсия – метрическая шкала, которая используется для измерения температуры. 0°C соответствует температуре замерзания воды, а 100°C - температуре кипения воды при нормальных атмосферных условиях. Жидкостный термометр состоит из тонкой стеклянной трубки, заполненной жидкостью, обычно ртутью или спиртом. Термометр помещается в исследуемую среду, и при изменении температуры жидкость в термометре расширяется или сжимается, двигаясь в трубке вверх или вниз. Метки на трубке показывают температуру, соответствующую позиции жидкости внутри термометра. Жидкостные термометры обычно калибруются на шкале Цельсия, поэтому они показывают температуру в градусах Цельсия. 7.2 Расчет работы газа с помощью PV-диаграмм. Работа газа на замкнутом цикле численно равна площади фигуры внутри цикла. Рассчитать работу газа можно по формуле A = P∆V. Если давление газа изменяется в процессе, то необходимо разбить процесс на маленькие участки, при которых давление можно считать постоянным. Затем необходимо рассчитать работу газа на каждом участке и сложить их вместе, чтобы получить полную работу (При V = const – A = 0) 8.1 Идеальный газ – это модель газа, в которой считается, что между его молекулами нет взаимодействия, и они движутся со случайными скоростями внутри замкнутого пространства. Энергия потенциальная намного меньше кинетической энергии газовых частиц. В идеальном газе считается, что молекулы имеют массу, но не имеют размеров, то есть они являются точечными. Также в этой модели считается, что молекулы движутся беспрепятственно и столкновения между ними являются абсолютно упругими, то есть энергия при столкновении сохраняется. 8.2 Теплоемкость одноатомного идеального газа зависит от того, какой процесс происходит: изохорный (при постоянном объеме) или изобарный (при постоянном давлении) Для изохорного процесса (также называемого процессом при постоянном объеме) теплоемкость одноатомного идеального газа составляет Cv = (3/2)R, где Cv - молярная теплоемкость при постоянном объеме. Для изобарного процесса (при постоянном давлении) теплоемкость одноатомного идеального газа составляет Cp = (5/2)R, где Cp - молярная теплоемкость при постоянном давлении 9.1 Основное уравнение МКТ идеального газа: В природе существуют процессы, которые могут происходить в обратном направлении, если изменить условия, в которых они происходят. Такие процессы называются обратимыми. Однако большинство процессов в природе являются необратимыми (происходят только в одном направлении). Например - теплопередача. Передача тепла от тела с более высокой температурой к телу с более низкой температурой является необратимым процессом. 9.2 Второй закон термодинамики - невозможно перевести тело от более холодной системы к более горячей при отсутствии одновременных изменений в обеих системах или окружающих телах. Вечный двигатель второго рода невозможен 10.1 Средняя кинетическая энергия молекул и температура Согласно кинетической теории газов, температура определяется как мера средней кинетической энергии молекул, движущихся в газе. Таким образом, при повышении температуры газа, средняя кинетическая энергия молекул в этом газе также увеличивается. Это происходит потому, что при повышении температуры молекулы газа начинают двигаться быстрее и соответственно имеют большую кинетическую энергию. Формула: Ek = (3/2) КT 10.2 Физические основы работы тепловых двигателей Тепловой двигатель работает за счет преобразования тепловой энергии в механ. работу. Его работа основана на циклическом процессе, в котором рабочее тело (обычно газ) проходит через ряд термодинамических процессов (нагрев, расширение, охлаждение, сжатие) Поршневой двигатель внутреннего сгорания - один из наиболее распространенных тепловых двигателей, он используется в автомобилях. В нем сжатый воздух и топливо сгорают в цилиндре, нагревая и расширяя газы, которые выталкивают поршень и приводят в движение коленчатый вал. Вторым наиболее распространенным тепловым двигателем является паровой двигатель. Паровой двигатель использует пар, который нагревается до высокой температуры и давления, а затем проходит через турбину, которая приводит в действие генератор электроэнергии или другое оборудование. Тепл. двигатели основаны на законах термодинамики, которые определяют, как тепловая энергия может быть преобразована в работу, какие ограничения существуют на данный процесс. Осн. параметры, влияющие на работу тепловых двигателей: температура, давление, объем, скорость движения газов. 11.1 Постоянная Больцмана (k) –физическая константа, которая связывает энергию молекул с их температурой. Она равна отношению энергии к температуре и выражается в джоулях на кельвин k=E/T. Абсолютная температурная шкала – это термодинамическая шкала, в которой ноль абсолютной температуры (0 K) соответствует абсолютному нулю энергии, когда все молекулы находятся в стационарном состоянии. Она также известна как шкала Кельвина. Связь между абсолютной температурой и постоянной Больцмана задается уравнением E = kT 11.2 КПД теплового двигателя и его максимальное значение Коэффициент полезного действия теплового двигателя определяется как отношение механической работы, которую он выдает, к количеству теплоты, полученной от нагревателя – 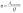 ; ;  (для идеального цикла Карно, максимальный КПД) Максимальное значение КПД теплового двигателя определяется термодинамическими циклами, которые используются в его работе. (для идеального цикла Карно, максимальный КПД) Максимальное значение КПД теплового двигателя определяется термодинамическими циклами, которые используются в его работе. Максимальный для идеальной тепловой машины 62%, а для реальной 35-40% 12.1 Уравнение Менделеева-Клапейрона описывает поведение идеального газа и определяет связь между давлением, объемом, температурой и кол-вом вещ-ва газа. PV = nRT. Универсальная газовая постоянная R - постоянная, определяющая связь между молярными данными и физическими характеристиками газа (≈8,31 Дж/моль∙К) 12.2 Парообразование - фазовый переход вещества из жидкого состояния в газообразное. Осн. способы парообр. - испарение и кипение. Испарение - парообразование, происходящее на поверхности жидкости при любой t. Происходит благодаря тому, что некоторые молекулы жидкости обладают достаточной энергией, чтобы преодолеть притяжение других молекул и выйти на поверхность жидкости в виде пара. Кипение - парообразование, происходящее при t кипения. t кипения зависит от давления, тк давление влияет на силу притяжения между молекулами жидкости. При достижении t кипения, давление насыщенного пара становится равным атмосферному давлению и жидкость начинает кипеть. Удельная теплота парообразования - количество теплоты, необходимое для превращения единицы массы вещества из жидкого состояния в газообразное, при пост. t и давлении. Удельная теплота парообр. различных веществ различна и измеряется в Дж/г или кДж/кг 13.1 Изотермический процесс – процесс перехода идеального газа из одного состояния в другое без изменения температуры. Закон Бойля-Мариотта - описывает связь между параметрами газа при таком процессе (pv=const)  Из закона следует обратно пропорцион. связь давления и объёма: при увеличении объёма наблюдается уменьшение давления, и наоборот. Выше изображен график зависимости меняющихся величин в уравнении. Из закона следует обратно пропорцион. связь давления и объёма: при увеличении объёма наблюдается уменьшение давления, и наоборот. Выше изображен график зависимости меняющихся величин в уравнении.13.2 Насыщенный пар – пар, находящийся в динамическом равновесии со своей жидкостью. Динамическое равновесие – состояние, при котором число молекул, покидающих поверхность жидкости за некоторый промежуток времени, будет равно среднему числу молекул пара, возвратившихся за то же время в жидкость При неизменном объеме плотность насыщенного пара растет с повышением t, уменьшается с понижением t. При увеличении t возрастает скорость испарения жидкости. Динамическое равновесие в первый момент будет нарушено, т.е. произойдет дополнительное испарение некоторой части жидкости. Плотность пара будет возрастать, пока динамическое равновесие не восстановится. При охлаждении произойдет обратный процесс: часть пара сконденсируется, уменьшая его плотность. Давление насыщенного пара растет с t быстрее, чем по линейному закону. С ростом температуры возрастает плотность насыщенного пара, согласно уравнению Мендел – Клапейрона давление пропорционально произведению плотности на t. Изотерма реального газа - зависимость молярного объема газа от давления при постоянной t. При высокой t изотерма реального газа отличается от изотермы идеального газа некоторым искажением формы. При температуре Тк (критической температуре) на изотерме появляется точка перегиба К (критическая), Объем Vк и давление Рк - критические. Критическая изотерма - изотерма при Тк  14.1 Изобарный процесс – процесс изменения состояния термодинамической системы при постоянном давлении Закон Гей-Люссака – относительное изменение объема газа данной массы про постоянно давлении прямо пропорционально изменению температуры.    Из закона следует прямо пропорциональная связь между температурой и объёмом: при увеличении t наблюдается увеличение объёма, и наоборот. 14.2 Кипение происходит при температуре, когда давление насыщенных паров сравнивается с давлением внутри жидкости. Чем больше внешнее давление, тем выше t кипения Критическая температура - t, при которой исчезают различия в физических свойствах между жидкостью и паром, находящимся с ней в динамическом равновесии (при ней видимое различие между жидкостью и ее паром исчезает) 15.1 Изохорный процесс – процесс изменения давления газа, вызванный изменением температуры при постоянном объеме Закон Шарля – Давление данной массы газа при постоянном объеме прямо пропорционально абсолютной t. Из этого закона следует прямо пропорц. связь между t и давлением: при увеличении t наблюдается увеличение давления, и наоборот. Чем ниже изохора, тем больше объем  15.2 Парциальное давление – давление, которое производил бы водяной пар, если бы все остальные газы отсутствовали (Па) Абсолютная влажность ρп воздуха — физич величина, равная плотности водяного пара, находящегося в воздухе при данных условиях. – масса вод. пара в 1 кубическом метре воздуха  (абсолютная); (абсолютная);  (относительная) (относительная)Относительная влажность – отношение парциального давления паров воды в газе к равновесному давлению насыщенных паров при данной температуре. Она показывает, насколько водяной пар при данной t близок к насыщению. Чем ниже относит. влажность, тем интенсивнее испарение воды. При относительной влажности 100% водяной пар становится насыщенным и оказывается в динамическом равновесии со своей жидкостью. В этом случае процессы испарения и конденсации идут с одинаковой скоростью 16.1 Объединенный газовый закон - закон, который связывает давление, объем и t газа. Является комбинацией закона Бойля-Мариотта, Шарля и Гей-Люссака  (формально) (формально)Закон утверждает, что произведение давления и объема газа, деленное на его t, остается постоянным при условии, что количество вещества и масса газа неизменны. Этот закон является важным инструментом для расчета параметров газов в различных условиях (изменение t и давления). 16.2 Кристаллическое и аморфное состояние вещества отличаются структурой и свойствами. Кристаллическое состояние характеризуется упорядоченной решеткой атомов или молекул, которая обладает определенной симметрией. Аморфное состояние, не имеет долгосрочного порядка, и атомы или молекулы расположены в случайном порядке. Плавление - переход вещества из твердого в жидкое состояние, под воздействием повышения t. Во время плавления твердое вещество поглощает теплоту, которая приводит к разрыву межмолекулярных связей в решетке кристалла, и превращению его в жидкость. В этом процессе t остается постоянной, пока весь материал не расплавится. Удельная теплота плавления - количество теплоты, которое нужно передать единице массы вещества, чтобы превратить его из твердого состояния в жидкое при постоянной t. Это значение является физической величиной, зависящей от вещества. Определяется экспериментально измеряется в Дж/кг |
