бх экз. 1. Клеточный метаболизм, его биологическая роль. Вторичный метаболизм
 Скачать 1.85 Mb. Скачать 1.85 Mb.
|
|
1. Клеточный метаболизм, его биологическая роль. Вторичный метаболизм. В живых клетках протекает множество ферментативных реакций. Всю совокупность этих реакций объединяют общим понятием метаболизм (обмен веществ). Он выполняет четыре специфические функции: снабжение химической энергией, которая добывается путем расщепления богатых энергией пищевых веществ, поступающих из среды, или путем преобразования улавливаемой энергии солнечного света; превращение молекул пищевых веществ в строительные блоки, которые в дальнейшем используются клеткой для построения макромолекул; сборка белков, нуклеиновых кислот, липидов, полисахаридов и прочих клеточных компонентов из этих строительных блоков; синтез и разрушение тех биомолекул, которые необходимы для выполнения каких-либо специфических функций. Выделяют внешний и промежуточный обмен веществ. Внешний обмен веществ - внеклеточное переваривание веществ на путях их поступления и выделения из организма. Промежуточный обмен веществ - превращение веществ внутри клеток с момента их поступления до образования конечных продуктов. Попав внутрь клетки, питательное вещество метаболизируется, т.е. претерпевает ряд химических изменений, катализируемых ферментами. Определённая последовательность таких химических изменений называется метаболическим путём, а образующиеся промежуточные продукты - метаболитами. Большей частью метаболические пути линейны в результате четырех последовательных ферментативных реакций предшественник А превращается в продукт Е, а продукт одной ферментативной реакции служит субстратом следующей. A El > B Д2 > C ЕЪ > D Д4 > E Кроме линейных выделяют циклические метаболические пути. Обычно они имеют разветвления, в которых какие-нибудь продукты реакций выходят из цепи реакций данного метаболического пути или, наоборот, вливаются в нее. Именно таким путем происходит окисление ацетильных групп до СО2 и Н2О в цикле лимонной кислоты. Все метаболические пути делят на: центральные и специальные (вторичные). Центральные метаболические пути - пути превращения основных пищевых веществ в клетке (углеводов, жиров, белков и нуклеиновых кислот). На этих путях потоки метаболитов довольно внушительны. Например, в организме взрослого человека ежесуточно окисляется несколько сотен граммов глюкозы до СО2 и воды. Последовательности химических превращений на каждом из центральных метаболических путей, в принципе, у всех живых форм едины. Кроме центральных путей есть и другие метаболические пути со значительно меньшим потоком метаболитов (ежесуточный синтез или распад при этом измеряется миллиграммами). Эти специальные метаболические пути составляют так называемый вторичный метаболизм, роль которого - в образовании различных специализированных веществ, требующихся клеткам в малых количествах. К вторичным метаболическим путям принадлежит, например, биосинтез коферментов и гормонов, потому что эти соединения вырабатываются и используются только в следовых количествах. Функции метаболизма: снабжение энергией, которая выделяется при распаде веществ корма; превращение молекул пищевых веществ в строительные блоки, которые используются клеткой для синтеза макромолекул; сборку собственных макромолекул из этих строительных блоков; синтез и разрушение биомолекул, необходимых для выполнения специфических функций клетки (гормонов). 2. Катаболизм и анаболизм. Пути передачи энергии от катаболических процессов к анаболическим. Промежуточный метаболизм складывается из двух фаз: катаболизма, анаболизма. Катаболизм - это фаза, на которой происходит расщепление сложных органических молекул до более простых конечных продуктов. Катаболические процессы сопровождаются высвобождением свободной энергии, заключенной в сложной структуре больших органических молекул. На определенных этапах соответствующих катаболических путей значительная часть свободной энергии запасается в форме высокоэнергетического соединения - АТФ (благодаря сопряженным ферментативным реакциям). В катаболизме различают три стадии: 1. Полимеры превращаются в мономеры (белки – в аминокислоты, углеводы в моносахариды, липиды – в глицерол и жирные кислоты). Химическая энергия при этом рассеивается в виде тепла. 2. Мономеры превращаются в общие продукты, в подавляющем большинстве в ацетил-КоА. Химическая энергия частично рассеивается в виде тепла, частично накапливается в виде восстановленных коферментных форм (НАДН, ФАДН2), частично запасается в макроэргических связях АТФ (субстратное фосфорилирование). 1-ая и 2-ая стадии катаболизма относятся к специфическим путям, которые уникальны для метаболизма белков, липидов и углеводов. 3. Заключительный этап катаболизма, сводится к окислению ацетил-КоА до СО2 и Н2О в реакциях цикла трикарбоновых кислот (цикла Кребса) – общий путь катаболизма. Окислительные реакции общего пути катаболизма сопряжены с цепью тканевого дыхания. При этом энергия (40–45%) запасается в виде АТФ (окислительное фосфорилирование). В результате специфических и общих путей катаболизма биополимеры (белки, углеводы, липиды) распадаются до СО2, Н2О и NH3, которые являются основными конечными продуктами катаболизма. Анаболизм — совокупность метаболических процессов биосинтеза сложных молекул с затратой энергии. Сложные молекулы, входящие в состав клеточных структур, синтезируются последовательно из более простых предшественников. Анаболизм включает три основных этапа, каждый из которых катализируется специализированным ферментом. На первом этапе синтезируются молекулы-предшественники, к примеру, аминокислоты, моносахариды, терпеноиды и нуклеотиды. На втором этапе предшественники с затратой энергии АТР преобразуются в активированные формы. На третьем этапе активированные мономеры объединяются в более сложные молекулы, к примеру, белки, полисахариды, липиды и нуклеиновые кислоты. Процессы катаболизма и анаболизма протекают одновременно, но не совпадают. Причинами является непригодность по Е-соображениям, катализирование разными ферментативными системами, различие процессов по локализации. Тесная связь между анаболизмом и катаболизмом протекает на уровнях: источников атома углерода - продукты катаболизма являются исходными субстратами для анаболических реакций; на энергетическом уровне - в процессах катаболизма образуется АТФ и другие макроэргические соединения, энергия которых затрачивается в анаболических процессах; на уровне восстановленных эквивалентов - реакции катаболизма в основном окислительные, а анаболические реакции потребляют восстановленные эквиваленты. 3. Регуляция метаболических путей. В регуляции метаболических путей участвуют механизмы трех типов. Первый из них, наиболее быстро реагирующий на любое изменение ситуации, связан с действием аллостерических ферментов (рис. 13-15), каталитическая активность которых может меняться под влиянием особых веществ, оказывающих стимулирующее или тормозящее действие (их называют эффекторами или модуляторами; разд. 9.18). Как правило, аллостерические ферменты занимают место в начале или поблизости от начала данной мультиферментной последовательности и катализируют ту ее стадию, которая лимитирует скорость всего процесса в целом В катаболических процессах, сопровождающихся синтезом АТР из ADP, в роли аллостерического ингибитора одной из ранних стадий катаболизма часто выступает именно этот конечный продукт-АТР. Второй тип механизмов, регулирующих метаболизм у высших организмов, - это гормональная регуляция (рис. 13-16). Гормонами называют особые химические вещества (химические «посредники»), вырабатываемые различными эндокринными железами и выделяемые непосредственно в кровь; они переносятся кровью к другим тканям или органам и здесь стимулируют или тормозят определенные виды метаболической активности. Гормон адреналин, например, секретируется мозговым веществом надпочечника и переносится кровью в печень, где он стимулирует распад гликогена до глюкозы, что вызывает повышение уровня сахара в крови. Кроме того, адреналин стимулирует распад гликогена в скелетных мышцах; этот процесс приводит к образованию лактата и к запасанию энергии в форме АТР. Адреналин вызывает эти эффекты, присоединяясь к особым рецепторным участкам на поверхности мышечных клеток или клеток печени. Связывание адреналина служит сигналом; этот сигнал передается во внутренние отделы клетки и вызывает здесь ковалентную модификацию, под влиянием которой гликогенфосфорилаза (первый фермент в системе, катализирующей превращение гликогена в глюкозу и другие продукты; разд. 9.22) переходит из менее активной формы в более активную (рис. 13-16). Третий тип механизмов, регулирующих метаболизм, связан с изменением концентрации данного фермента в клетке. Концентрация всякого фермента в любой данный момент определяется соотношением скоростей его синтеза и распада. Скорость синтеза некоторых ферментов при определенных условиях резко возрастает; соответственно увеличивается и концентрация данного фермента в клетке. Если, например, животное получает рацион, богатый углеводами, но бедный белком, то в печени у него оказывается крайне низким содержание ферментов, катализирующих в обычных условиях распад аминокислот до ацетил-СоА. Поскольку при таком рационе эти ферменты практически не нужны, они и не вырабатываются в больших количествах. Клетки печени, следовательно, обладают способностью включать или выключать биосинтез специфичных ферментов в зависимости от природы поступающих в них питательных веществ. Это явление носит название индукции ферментов. 5. АТФ – аккумулятор энергии. Строение и химические свойства АТФ. 7. Строение и свойства АТФ. Ее особенности. Цикл АТФ в клетке Аденозинтрифосфа́т или Аденозинтрифосфорная кислота (сокр. АТФ, англ. АТР) — нуклеозидтрифосфат, имеющий большое значение в обмене энергии и веществ в организмах. Практически все процессы жизнедеятельности, требующие энергетической подпитки, протекают с использованием энергии, заключенной в молекулах АТФ. К таким процессам относятся: биосинтез различных органических соединений (в том числе белков, жиров и нуклеиновых кислот), активный транспорт веществ через биологические мембраны, деление клеток, движение ресничек и жгутиков, сокращение мышц и многие другие. В состав молекулы АТФ входит аденин, рибоза и три остатка фосфорной кислоты. Ковалентные связи между остатками фосфорной кислоты примечательны тем, что при их разрыве выделяется большое количество энергии — около 40 кДж/моль. Такие высокоэнергетические связи называются макроэргическими. Поскольку остатки фосфорной кислоты в водной среде диссоциируют, приобретая отрицательный заряд, между ними наблюдается взаимное отталкивание. Поэтому АТФ легко подвергается гидролизу с разрывом макроэргических связей. На первом этапе гидролиза от АТФ отщепляется остаток фосфорной кислоты. При этом выделяется 40 кДж/моль энергии и АТФ превращается в АДФ — аденозиндифосфорную кислоту: АТФ + Н2О → АДФ + Н3РО4 + 40 кДж. Второй этап гидролитического расщепления наблюдается сравнительно редко. При этом происходит отщепление еще одной фосфатной группы, высвобождение второй «порции» энергии и превращение АДФ в АМФ — аденозинмонофосфорную кислоту: АДФ + Н2О → АМФ + Н3РО4 + 40 кДж. Энергия, выделившаяся при гидролизе АТФ, используется для осуществления разнообразных клеточных процессов. Таким образом, АТФ интенсивно расщепляется, и ее запас в клетках невелик. Поэтому наряду с гидролизом АТФ необходим ее непрерывный синтез. Для того чтобы присоединить остаток фосфорной кислоты к АДФ, нужно затратить не менее 40 кДж энергии: АДФ + Н3РО4 + 40 кДж → АТФ + Н2О. Поставщиком энергии для синтеза АТФ в клетках служат процессы расщепления и окисления органических веществ (глюкозы, жирных кислот и др.). Фотосинтезирующие организмы для образования молекул АТФ также используют поглощенную ими световую энергию. Работа АТФ в клетке: АТР поставляет энергию для процессов биосинтеза. 2. АТР служит источником энергии для процессов движения и сокращения. 3. За счет энергии АТР присходит перенос питательных веществ через мембраны против градиента концентрации. 4. Энергия АТР используется в очень тонких механизмах, обеспечивающих передачу генетической информации при биосинтезе ДНК, РНК и белков. В клетках постоянно происходит круговорот энергии. АТФ участвует в нем в форме переносчика энергии и служит связующим звеном между ката- и анаболизмом.  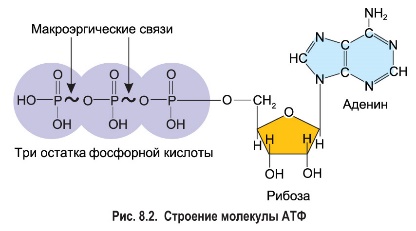 8. Обмен Нуклеиновых кислот, его значение. Нуклеиновые кислоты (ДНК и РНК) представляют собой высокомолекулярные линейные полимеры, построенные из нуклеотидов. Каждый нуклеотид состоит из трехкомпонентов: азотистого основания, пентозы и остатка фосфорной кислоты. В клетках тканей нуклеиновые кислоты распадаются под влиянием ферментов. Изучение обмена НК важно, так как он выходит далеко за рамки биохимии НК и позволяет объяснить проблемы наследственности и изменчивости, систематики и эволюции. Изучение обмена НК позволило открыть важнейшие закономерности общего омена веществ. 9. Пути распада НК. Ферменты, катализирующие эти процессы. Ферменты, расщепляющие полинуклеотидные цепи, называют нуклеазами, или фосфодиэстеразами, так как они ускоряют реакции разрыва межнуклеотидных фосфодиэфирных связей в молекулах нуклеиновых кислот. Различают эндонуклеазы и экзонуклеазы. Эндонуклеазы действуют на внутренние межнуклеотидные связи в молекулах ДНК и РНК. Таким образом, при их участии осуществляется деполимеризация нуклеиновых кислот, в основном до олигонуклеотидов. Экзонуклеазы отщепляют нуклеотиды с 3′- или 5'-конца полинуклеотидной цепи и обеспечивают распад нуклеиновых кислот до свободных нуклеотидов. По специфичности действия различают дезоксирибонуклеазы (ДНКазы, расщепляющие ДНК) и рибонуклеазы (РНКазы, гидролизующие РНК). В результате их действия образуются олигонуклеотиды и лишь небольшое количества мононуклеотидов. Рибо- и дезоксирибонуклеозидфосфаты расщепляются до нуклеозидов и фосфорной кислоты под действием фосфатаз (нуклеотидаз). Нуклеозиды могут расщепляться гидролитическим путем с участием фермента нуклеозидазы: Аденозин + Н2О → Аденин + рибоза Пентозы окисляются до CO2 и H2O; фосфорная кислота используется для фосфорилирования органических соединений или выводится из организма. Азотистые основания превращаются в конечные продукты обмена и выделяются с мочой. Продукты гидролиза нуклеиновых кислот поступают в клетки организма, где используются для синтеза нуклеотидов, нуклеиновых кислот, или же для удовлетворения энергетических потребностей клетки и организма. Полимерные молекулы нуклеиновых кислот расщепляются в тканях преимущественно гидролитическим путем при участии специфических ферментов, относящихся к нуклеазам. В зависимости от характера действия на фосфодиэфирные связи и локализации остатка фосфата различают 3'-нуклеазы, расщепляющие сложноэфирные связи межнуклеозидного фосфата с С5', и 5'-нуклеазы, гидролизующие связи c С3'. Кроме того, различают эндонуклеазы, разрывающие внутренние межнуклеотидные связи в молекуле ДНК и РНК, вызывающие деполимеризацию нуклеиновых кислот и образование олигонуклеотидов, и экзонуклеазы, катализирующие гидролитическое отщепление концевых мононуклеотидов от ДНК и РНК или от олигонуклеотидов. Дезоксирибонуклеазы I катализируют разрыв внутренних фосфодиэфирных связей в одной из двух цепей молекулы ДНК между 3'-м углеродным остатком дезоксирибозы и остатком фосфата с образованием низкомолекулярных олигодезоксирибонуклеотидов. Дезоксирибонуклеазы II вызывают деполимеризацию молекулы ДНК в результате парных разрывов фосфодиэфирных связей обеих цепей ДНК с образованием более крупных олигодезоксирибонуклеотидов. 10. Превращения мононуклеотидов. Мононуклеотиды теряют фосфатный остаток гидролитически под действием фосфатаз или нуклеотидаз с образованием нуклеозидов. Дальнейшие превращения в мочевую кислоту сопровождаются гидролитическим дезаминированием с участием аденозиндезаминазы или гуаназы и отщеплением рибозы, которое ускоряется пуриннуклеозидфосфорилазой. 18.Молекулярный механизм биосинтеза ДНК. Репликация происходит в направлении от 3’ к 5’ концу материнской цепи. Процесс репликации протекает в три стадии. Стадия I — инициация. Репликация молекулы ДНК начинается с разъединения двойной спирали с одного конца, причем процесс идет не на всем участке молекулы, а частями, фрагментарно. Эта реакция проводится в присутствии нескольких белковых факторов. Две цепи в молекуле ДНК связаны достаточно прочно, поэтому для их разъединения необходимы специальные белки. Белки первого типа, перемещаясь по молекуле ДНК, раскручивают спираль и разрушают водородные связи между комплементарными основаниями, расплетая двойную спираль. Белки второго типа предотвращают повторное соединение двух цепей и обеспечивают эффективность действия белков первого типа. Кроме того, они выпрямляют одиночные цепи ДНК и обеспечивают продвижение фермента ДНК-полимеразы, который катализирует синтез новых цепей. В результате действия всех белковых факторов образуется репликационная вилка Стадия II — элонгация. На этой стадии происходит собственно синтез ДНК. По принципу комплементарности на каждой из цепей ДНК выстраиваются нуклеотиды. Самокопирующий фермент ДНК-полимераза, передвигаясь по репликационной вилке, соединяет между собой нуклеотиды в направлении от 5'- к 3'-концу. Движение фермента идет только в одном направлении. Так как цепи ДНК антипараллельны, то по другой цепи ДНК-полимераза движется в обратном направлении и синтезирует фрагмент от начала репликационной вилки к концу цепи. На первой цепи фермент, дойдя до начала репликационной вилки, как бы стимулирует движение связывающего белка. Он передвигается выше, расплетая молекулу ДНК дальше. Фермент вновь передвигается по первой цепи, продолжая прерванный синтез с последнего нуклеотида. На другой же цепи фермент синтезирует второй фрагмент ДНК в обратном направлении. Репликационная вилка оказывается несимметричной. Одна из дочерних цепей ДНК (ведущая) строится непрерывно, а другая (отстающая) — синтезируется прерывисто, в виде отдельных фрагментов. Фрагменты соединяются друг с другом позже, только после синтеза следующих фрагментов. Последняя III стадия называется терминацией. С вновь синтезированных молекул ДНК снимаются все белковые факторы, ферменты. Две дочерние молекулы ДНК расходятся, спирализуются и приобретают соответствующую структуру. Процесс синтеза ДНК заканчивается. Весь процесс репликации происходит за счет энергии АТФ. 19. Молекулярный механизм биосинтеза РНК на ДНК-матрице. Синтез РНК – это один из процессов матричного синтеза – процесса синтеза молекул биополимеров (нуклеиновых кислот и белков) в живых организмах, строение которых определяется матрицей. В организме на принципе матричного синтеза построены несколько процессов. Процесс, которые интересует нас – биосинтез РНК, идет на матрице ДНК и называется транскрипцией. Транскрипция осуществляется в три стадии: инициация, элонгация и терминация. Синтез РНК в живой клетке проводится ферментом — РНК-полимеразой. Химически РНК-полимеразы являются нуклеотидил-трансферазами, полимеризующими рибонуклеотиды на 3'-конце цепи РНК. Фермент начинает синтез с определенной последовательности ДНК. Эта последовательность стоит перед началом каждого гена и называется промотор (на рисунке обозначена прямоугольником). Она не симметрична, поэтому синтез на ней идет только в одном направлении. На одной нити, идущей в направлении от 3'-конца к 5'-концу, происходит присоединение комплементарных нуклеотидов, содержащих рибозу в направлении от 5'-конца к 3'-концу. При этом против аденина в ДНК-матрице ставится урацил. Заполнив весь расплетенный участок, фермент начинает двигаться по матрице в сторону 5'-конца, расплетая соседние пары нуклеотидов матрицы. На каждом этапе из поступающих рибонуклеозидтрифосфатов отбирается один, способный к комплементарному спариванию с открытой матричной цепью ДНК, в результате к растущему 3'-ОН-концу цепи РНК добавляется рибонуклеозидмонофосфат (цветная стрелка), а пирофосфат (выделен цветом) высвобождается. Во время элонгационной фазы транскрипции происходит добавление рибонуклеотидов к цепи и переход от структуры РНК-полимеразного комплекса от открытой к транскрипционной. По мере сборки молекулы РНК участок ДНК перед РНК-полимеразой раскручивается далее, и 13-парный открытый комплекс превращается в 17-парный транскрипционный комплекс. Во время продвижения фермента вдоль матричной цепи в его активном центре образуется двойная спираль РНК-ДНК. Она очень коротка, так как позади молекулы полимеразы немедленно восстанавливается спираль ДНК-ДНК, а РНК вытесняется. Так продолжается до тех пор, пока РНК-полимераза не достигнет специальной последовательности в ДНК, стоящей в конце гена. Это служит сигналом к транскрипции. Достигнув этой точки, фермент сам, либо при помощи вспомогательных белков отделяется от матрицы ДНК и освобождает из комплекса новую синтезированную РНК. В результате образовавшаяся РНК содержит информацию, соответствующую одному гену. У бактерий часто бывает, что считывается информация не с одного гена, а с группы расположенных рядом и обычно функционально связанных генов. Размеры молекул РНК в большинстве случаев не превосходят нескольких тысяч нуклеотидов. РНК, так же, как и белки, сворачивается определенным образом, зависящим от ее нуклеотидной последовательности. При этом образуются короткие двуспиральные участки за счет комплементарности небольших последовательностей внутри одной молекулы РНК. После завершения транскрипции РНК часто подвергается модификациям, которые зависят от функции, выполняемой данной молекулой. В клетках всех организмов существует 3 основных класса РНК: 1) Информационные (матричные) РНК передают закодированную в ДНК информацию о структуре белка от ядра клетки к рибосомам, где и осуществляется синтез белка; 2) Транспортные РНК собирают аминокислоты в цитоплазме клетки и переносят их в рибосому; молекулы РНК этого типа "узнают" по 17 соответствующим участкам цепи информационной РНК, какие аминокислоты должны участвовать в синтезе белка; 3) Рибосомные РНК обеспечивают синтез белка определенного строения, считывая информацию с информационной (матричной) РНК. Таким образом, стадии синтеза РНК таковы: I — обнаружение промоторной области в молекуле ДНК и раскручивание спирали ДНК; II — инициация синтеза цепи РНК путем связывания двух первых рибонуклеозидгрифосфатов; III — наращивание цепи РНК в направлении 5' → 3' путем присоединения рибонуклеозидгрифосфатов; IV — высвобождение 5'-конца синтезируемой РНК и восстановление двойной спирали ДНК;V — окончание синтеза РНК в области терминатора, отделение полимеразы от завершенной цепи РНК. 20. Пути распаде белков в живых организмах. Главный, но возможно не единственный путь распада белков в организме – гидролиз. Гидролитический распад белков протекает в любой клетке организма в основном в специальных субклеточных элементах – лизосомах, где сосредоточены гидролитические ферменты и где осуществляется деструкция высокомолекулярных веществ до низкомолекулярных метаболитов. Вместе с тем, определенная часть ферментов, ускоряющих распад белков, есть в цитоплазме клетки, а некоторые из них секретируются в желудочно-кишеч- ном тракте, обеспечивая внеклеточное переваривание белков. Гидролиз белков может быть частичным (до пептидов) и полным (до аминокислот). При частичном (неполном) гидролизе в белковой молекуле распадаются лишь некоторые пептидные связи, как правило, по соседству со строго определенными амнокислотными радикалами. Этот процесс ускоряется специфическими протеолитическими ферментами (протеиназы). В свою очередь пептиды гидролизуются до аминокислот при участии ряда пептидаз. Следовательно, ферментный аппарат пищеварительного тракта осуществляет поэтапное, строго избирательное расщепление пептидных связей белковой молекулы вплоть до конечных продуктов гидролиза белков – свободных амнокислот. Свободные аминокислоты могут подвергаться дальнейшему распаду, включаясь в гликолиз или сразу же в цикл Кребса. 28. Строение транспортной РНК, ее роль в активации аминокислот. Транспортная РНК занимает центральное место в биосинтезе белка, выполняя функцию адапторной молекулы, ответственной за перевод последовательности нуклеотидных триплетов в последовательность аминокислот. Это небольшая РНК длинной всего около 80 нуклеотидов. Ее вторичная структура напоминает клеверный лист, что связанно с тем, что в ряде мест цепочки т-РНК имеются 4-7 последовательных нуклеотидных звеньев, комплементарных друг другу. На этих участках между комплементарными нуклеотидами образуются водородные связи, в результате чего и возникает сложная петлистая структура, похожая по форме на клеверный лист. Имеются три больших петли и одна малая (у некоторых т-РНК отсутствует). Одна из больших петель (передняя) называется антикодоновой, так как несет антикодон – триплет нуклеотидов, комплиментарный какому либо кодону (кроме терминальных) на т-РНК. С противоположной стороны от данной петли располагается акцепторная ветвь. На 3'-конце акцепторной ветви у всех т-РНК располагается нуклеотидная последовательность: Ц-Ц-А. К концевому адениновому нуклеотиду ковалентно присоединяется аминокислота, соответствующая антикодону в антикодоновой петле данной т-РНК. В соответствии со специализацией тРНК – переносом аминокислот на рибосомы в процессе биосинтеза белка, различают две ее основные функции: акцепторную – способность ковалентно связываться с аминокислотой с помощью ферментативной реакции, осуществляемой аминоацил‐тРНК‐синтетазой, и адапторную – способность узнавать триплет на мРНК и обеспечивать поступление аминокислоты на законное место в растущей цепи белка. Некоторые тРНК выполняют также другие функции в метаболизме клетки, в частности, принимая участие в биосинтезе клеточной стенки, хлорофилла и гема и выступая в роли затравки при синтезе ДНК по матрице РНК у ретровирусов (в том числе вируса иммунодефицита человека). Каждая тРНК может переносить только одну из 20 аминокислот. Значит, для каждой аминокислоты имеется по меньшей мере одна тРНК. Так как аминокислота может иметь несколько триплетов, то и количество видов тРНК равно числу триплетов аминокислоты. Таким образом, общее число видов тРНК соответствует числу кодонов и равно 61. Трем стоп-кодам не соответствует ни одна тРНК. На одном конце молекулы тРНК всегда находится нуклеотид гуанин (5'-конец), а на другом (3'-конце) всегда три нуклеотида ЦЦА. Именно к этому концу идет присоединение аминокислоты (рис. 21). Каждая аминокислота присоединяется к своей специфической тРНК с соответствующим антикодоном. Механизм этого присоединения связан с работой специфических ферментов — аминоацил-тРНК-синтетазами, которые присоединяют каждую аминокислоту к соответствующей тРНК. Для каждой аминокислоты имеется своя синтетаза. Соединение аминокислоты с тРНК осуществляется за счет энергии АТФ, при этом макроэргическая связь переходит в связь между тРНК и аминокислотой. Так происходит активирование и кодирование аминокислот. Строение молекулы тРНК: 1 — антикодон; 2 — место присоединения аминокислоты  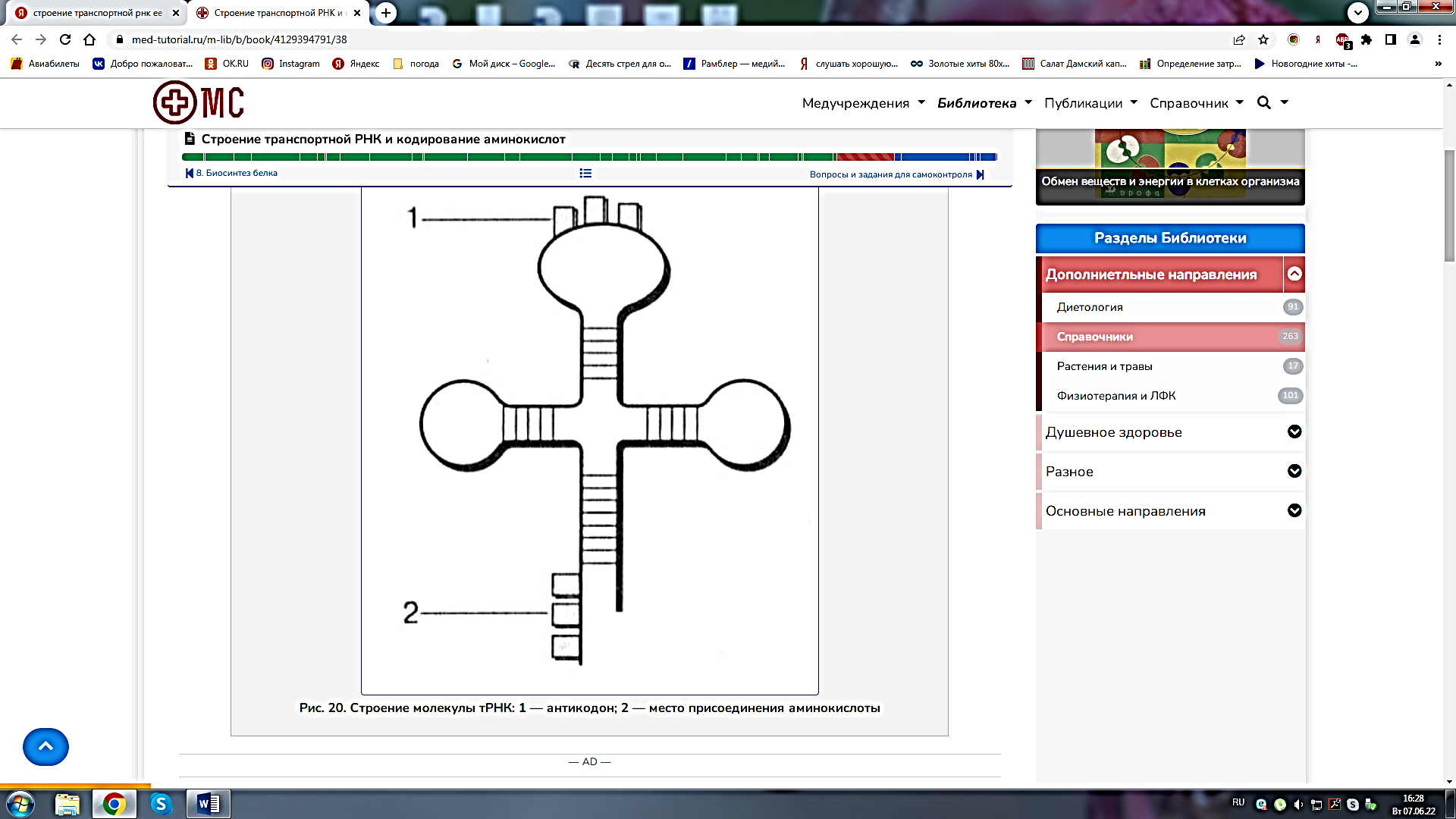 29. Биосинтез белка на рибосоме. Процесс синтеза полипептидной цепи, осуществляемый на рибосоме, называется трансляцией. Информационная РНК (иРНК) является посредником в передаче информации о первичной структуре белка, тРНК переносит закодированные аминокислоты к месту синтеза и обеспечивает последовательность их соединений. В рибосомах осуществляется сборка полипептидной цепи. В рибосоме имеются три центра, с которыми связываются молекулы РНК: один центр для иPHК и два — для тРНК. Одна тРНК с аминокислотой удерживается в аминоацильном центре, а другая — в пептидном центре, где идет рост полипептидной цепи. Первый этап — инициация. Осуществляется в 3 стадии: 1) к малой субъединице присоедин. Инициирующий фактор -3 IF-3, препятствующий объединению малой и большой субъединиц. К малой суб приесоедин м-РНК. Инициирующий кодон м-РНК связ с опред участком малой субъединицы рибосомы. IF-3 освобождается. 2) в цитозоли обр компл сост из м-РНК с формилметионином, иниц.фактора -1 и ГТФ. 3) этот комплекс вз с мал суб так, чтот происх кодон-антикодоновое вз-е между м- и т-РНК. Для этого процесса нужна Е, источ кот служ гидрозил ГТФ. В результате освоб ГДФ, фосф.к и IF-1. К малой субъед.тут же приоед IF-2, способств объед мал и бол субъед рибосомы. Затем этот фактор также уходит. В этот момент н аобразовавшеся целой рибосоме выделяют два участка – пептидильный (П) и аминоацильный (А). П-участок уже занят, тк в нем находятся м-рнк с Формил-метионином. А в А-участке располаг следующий кодон и А-уч готов к присоед след т-РНК. Этот комплекс, обр в 3 этапе назыв инициирующий. Вторая стадия — элонгация. Это стадия роста полипептидной цепи тоже идет в 3 этапа. 1) Связыввание 1ой АК, которая должна прийти в а-участок с фактором элонгации 1 (Э1) и молекулой АТФ. Этот комплекс поступает в а-участок, происх кодон-антикодоновое вз-е между т-рнк и кодоном м-рнк. Источник Е – ГТФ. После присоед ГТФ и Э1 покидают рибосому в присутствии Э2 осущ синтез ГТФ. Таким образом, заняты становятся оба участка – и А, и П. Начинается 2 стадия элонгации. 2) Образуется пепт св между АК из А-участка и П-участка. С т-рнк в А-уч соед дипептид. Работает фермент пептидилтрансфераза. Далее 3 стадия. 3)Происходит перемещение рибосомы на 1 кодон в сторону 3* конца м-рнк. В результате чего т-рнк, принесенная формил-метионином, осовобожд и уходит в цитозоль. В П-участке теперь находится т-рнк с дипептидом, а в А-участке снова может осущ-ся присоединение следующей АК. Транслокация (ф-т транслоказа) осущ в прис Э3, способств гидролизу еще одной молекулы ГТФ для освоб Е. Предполагают, что на этой стадии происх изменение конформации рибосомы что способст ее продвиж по м-рнк. Стадия элонгации осущ столько раз, сколько АК необх присоед для синтеза опред полипептида. После этого нач послед стадия – терминация. Третья стадия – терминация. Завершает синтез полипепт цепи в присутствии специф белковых ф-в. У прокариот таких факторов 3, а у эукариот – 1. Эти факторы обл св-вом распознавания в молекуле м-рнк терминирующих кодонов (УАГ, УАА и УГА), этим кодонам не соотв ни одна АК. Когда такой кодон появл в А-уч рибосомы к нему не присоед т-рнк, что служит сигналом для действия белковых факторов. Они вызывают гидролитическое отщепл полипепт от конечной т-рнк и его осовобождение, они вызывают отделение от П-участка пустой м-рнк, а также вызывают диссоциац рибос на мал и бол суб. Эти субъединицы поступают в свободный пул и мб исп для рессоциации нов рибосом. Схема биосинтеза полипептидной цепи. Стрелкой показано направление движения иPHК. Полисома: 1 — иPHК; 2 — малая субъединица рибосомы; 3 — большая субъединица рибосомы; 4 — синтезируемая полипептидная цепь 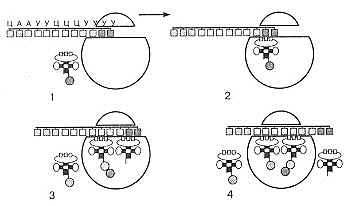  30. Генетический код и его особенности. Генетический код – единая система записи наследственной информации в молекулах нуклеиновых кислот в виде последовательности нуклеотидов. Генетический код основан на использовании алфавита, состоящего всего из четырех букв А, Т, Ц, Г, соответствующих нуклеотидам ДНК. Всего 20 видов аминокислот. Из 64 кодонов три – УАА, УАГ, УГА – не кодируют аминокислот, они были названы нонсенс-кодонами,выполняют функцию знаков- препинания. Кодо?н (кодирующий тринуклеотид) — единица генетического кода, тройка нуклеотидных остатков (триплет) в ДНК или РНК, кодирующих включение одной аминокислоты. Сами гены не принимают участие в синтезе белка. Посредником между геном и белком является иРНК. Структура генетического кода характеризуется тем, что он является триплетным, т. е. состоит из триплетов (троек) азотистых оснований ДНК, получивших название кодонов. Из 64 Свойства ген. Кода 1) Триплетность: одна аминокислота кодируется тремя нуклеотидами. Эти 3 нуклеотида в ДНК называются триплет, в иРНК – кодон, в тРНК – антикодон. 2) Избыточность (вырожденность): аминокислот всего 20, а триплетов, кодирующих аминокислоты 61, поэтому каждая аминокислота кодируется несколькими триплетами. 3) Однозначность: каждый триплет (кодон) кодирует только одну аминокислоту. 4) Универсальность: генетический код одинаков для всех живых организмов на Земле. 5.) непрерывность и непререкаемость кодонов при считывании. Это означает, что последовательность нуклеотидов считывается триплет за триплетом без пропусков, при этом соседние триплеты не перекрывают друг друга. 31. Преобразование вновь синтезированных белков и их перенос через мембрану. Дальнейшая стадия после терминации – это сворачивание и процессинг. Синтезируемый белок не обл активностью до тех пор пока не свернется в необх простр стр-ру, определяемую ак-последовательностью. В какой-то момент синтеза лбо после него, белок самопроизв приним свою нативную конформацию. Однако часто полипепт не м сверн до момента пока он не подвергнется процессингу или ков модификации. |
