микра. микра 5. 1. Конечная цель микробиологического исследования
 Скачать 208.22 Kb. Скачать 208.22 Kb.
|
|
1. Конечная цель микробиологического исследования. Объект изучения медицинских микробиологических лабораторий — патогенные биологические агенты (ПБА) — патогенные для человека микроорганизмы (вирусы, бактерии, грибы, простейшие), генно-инженерно модифицированные микроорганизмы, яды биологического происхождения (токсины), гельминты, а также материал (включая кровь, биологические жидкости и экскременты организма человека), подозрительный на содержание ПБА. В зависимости от выполняемых исследований, микробиологические лаборатории подразделяют на диагностические, производственные и научно-исследовательские. В соответствии с типами микроорганизмов, изучаемых в микробиологических лабораториях, выделяют: бактериологические, вирусологические, микологические и протозоологические лаборатории. С возбудителями инфекционных заболеваний работают только в специализированных микробиологических лабораториях, обеспечивающих безопасность её персонала и невозможность «утечки» патогенных микроорганизмов за пределы лаборатории. Регламентация условий работы с возбудителями инфекционных заболеваний произведена в соответствии со степенью опасности микроорганизмов для человека. По этому признаку выделено четыре группы возбудителей инфекционных заболеваний. Группа I возбудителей инфекционных заболеваний: возбудители особо опасных инфекций: чума, натуральная оспа, лихорадки Ласса, Эбола и др. Группа II возбудителей инфекционных заболеваний: возбудители высококонтагиозных бактериальных грибковых и вирусных инфекций: сибирская язва, холера, лихорадка Скалистых гор, сыпной тиф, бластомикоз, бешенство и др. В эту группу также включён ботулотоксин (но не сам возбудитель ботулизма). Группа III возбудителей инфекционных заболеваний: возбудители бактериальных грибковых, вирусных и протозойных инфекций, выделенных в отдельные нозологические формы (возбудители коклюша, столбняка, ботулизма, туберкулёза, кандидоза, малярии, лейшманиоза, гриппа, полиомиелита и др.). В эту группу также включены аттенуированные штаммы бактерий групп I, II и III. Группа IV возбудителей инфекционных заболеваний: возбудители бактериальных, вирусных, грибковых септицемии, менингитов, пневмоний, энтеритов, токсикоинфекций и острых отравлений (возбудители анаэробных газовых инфекций, синегнойной инфекции, аспергиллеза, амебиаза, аденовирусы, герпесвирусы и др.) В зависимости от уровня безопасности работы с микроорганизмами микробиологические лаборатории подразделяют на четыре группы риска. Первая группа риска микробиологических лабораторий: лаборатории особого режима (максимально изолированные) с высоким индивидуальным и общественным риском. Вторая группа риска микробиологических лабораторий: режимные лаборатории (изолированные) с высоким индивидуальным и низким общественным риском. Третья группа риска микробиологических лабораторий: базовые (основные) лаборатории с умеренным индивидуальным и ограниченным общественным риском. Четвёртая группа риска микробиологических лабораторий: базовые (основные) лаборатории с низким индивидуальным и общественным риском. В системе Министерства здравоохранения и Государственного комитета санитарно-эпидемиологического надзора РФ наиболее разветвлена сеть бактериологических лабораторий. В соответствии с выполняемыми задачами выделяют; • бактериологические лаборатории в составе ЛПУ; • бактериологические лаборатории в составе комитетов Госсанэпиднадзора; • учебные бактериологические лаборатории вузов; • проблемные и отраслевые бактериологические лаборатории научно-исследовательских институтов и предприятий по выпуску бактерийных препаратов; • специализированные бактериологические лаборатории по контролю за особо опасными инфекциями; • специализированные бактериологические лаборатории по контролю за отдельными группами бактерий: микобактериями, риккетсиями, лептоспирами и др. Большая часть микробиологических лабораторий работает с ПБА групп III и IV, а изучением возбудителей особо опасных инфекций (группы I и II) занимаются только специализированные лаборатории. Работу с патогенными биологическими агентами ( ПБА ) групп III и IV выполняют специалисты с высшим и средним специальным образованием. К ней допускают сотрудников, прошедших инструктаж по соблюдению требований безопасности работы с ПБА; последующий инструктаж следует проводить не реже одного раза в год. Все сотрудники, работающие с патогенными биологическими агентами ( ПБА ), должны находиться на диспансерном учёте. Приборы, оборудование и средства измерения должны быть аттестованы, технически исправны и иметь технический паспорт. Их метрологический контроль и техническое освидетельствование следует проводить в установленные сроки. Из правил работы в грязной зоне базовой микробиологической лаборатории: Перед работой в микробиологической лаборатории следует проверить качество посуды, пипеток, шприцев и другого оборудования. При пипетировании необходимо пользоваться только резиновыми грушами или автоматическими устройствами. Строго запрещено пипетировать материал ртом, переливать его через край сосуда (пробирки, колбы), а также оставлять без надзора рабочее место во время выполнения любых работ с патогенными биологическими агентами ( ПБА ). В грязной зоне микробиологической лаборатории запрещается курить, пить воду, хранить верхнюю одежду, головные уборы, обувь, пищевые продукты. В помещения зоны нельзя приводить детей и домашних животных. Окончание работы в микробиологической лаборатории После окончания работы в микробиологической лаборатории все объекты, содержащие ПБА, должны быть убраны в хранилища (холодильники, термостаты, шкафы) с обязательной дезинфекцией столов. Использованные пипетки полностью (вертикально) погружают в дезинфицирующий раствор, избегая образования пузырьков в каналах. Остатки ПБА, использованную посуду и оборудование собирают в закрывающиеся ёмкости и передают в автоклавную. Категорически запрещено сливать отходы с патогенными биологическими агентами ( ПБА ) в канализацию без предварительного обеззараживания. После окончания работы с патогенными биологическими агентами ( ПБА ) и заражёнными животными, а также после ухода из лаборатории следует тщательно вымыть руки. Цель микробиологических исследований — установить факт наличия или отсутствия возбудителя в организме больного и на объектах окружающей среды (индефецировать) Задачи микробиологических исследований — идентифицировать микроорганизмы в исследуемом материале, определить их видовую принадлежность, морфологические, биохимические, токсигенные и антигенные свойства, а также установить чувствительность выделенных микроорганизмов к антимикробным препаратам. Несмотря на то что проведение микробиологических исследований относится к компетенции микробиологов, каждый медицинский работник, имеющий дело с инфекционными заболеваниями, должен знать, как и когда необходимо отбирать материал для исследований, на какие исследования его направлять и как интерпретировать полученные результаты. Первый этап любого микробиологического исследования составляет правильный выбор материала для исследования. Его определяют свойства возбудителя и патогенез вызываемого им заболевания. При поражениях отдельных органов и систем целесообразно отбирать материал соответствующей локализации. При отсутствии поражений исследуют кровь, а затем отбирают образцы с учётом клинической картины заболевания и доступности материала для исследования. Так, при лихорадке неясного генеза первоначально проводят посев крови; затем, при появлении симптомов более конкретных проявлений, например пневмонии, проводят забор мокроты. • Образцы материала для микробиологического исследования следует забирать до назначения антимикробной терапии, с соблюдением правил асептики для предупреждения загрязнения материала. Каждый образец следует рассматривать как потенциально опасный. При заборе, транспортировке, хранении и работе с ним необходимо соблюдать правила биологической безопасности. Материал собирают в объёме, достаточном для всего комплекса исследований. Микробиологические исследования следует начинать немедленно после поступления образца в лабораторию. • Выбор материала для микробиологического исследования должен соответствовать характеру инфекционного процесса. Так, например, при установлении этиологии пневмонии материалом должна быть мокрота, а не слюна, а при раневых инфекциях отделяемое следует забирать из глубины раны, а не с её поверхности. Виды микробиологических исследований. Основу микробиологической диагностики инфекционных заболеваний составляют микроскопические, микробиологические, биологические, серологические и аллергологические методы. Микроскопические методы исследований включают приготовление мазков и препаратов для микроскопирования. В большинстве случаев результаты микроскопических исследований носят ориентировочный характер (например, определяют отношение возбудителей к окраске), так как многие микроорганизмы лишены морфологических и тинкториальных (особенности окрашивания) особенностей. Тем не менее микроскопией материала можно определить некоторые морфологические признаки возбудителей (наличие ядер, жгутиков, внутриклеточных включений и т.д.), а также установить факт наличия или отсутствия микроорганизмов в присланных образцах. Микробиологические методы исследований — «золотой стандарт» микробиологической диагностики, так как результаты микробиологических исследований позволяют точно установить факт наличия возбудителя в исследуемом материале. Идентификацию чистых культур (до вида микроорганизма) проводят с учётом морфологических, тинкториальных, культуральных, биохимических, токситенных и антигенных свойств микроорганизма. Большинство исследований включает определение чувствительности к антимикробным препаратам у выделенного возбудителя. Для эпидемиологической оценки роли микроорганизма проводят внутривидовую идентификацию определением фаговаров, биоваров, резистентваров и т.д. Биологические методы исследований направлены на определение наличия токсинов возбудителя в исследуемом материале и на обнаружение возбудителя (особенно при незначительном исходном содержании в исследуемом образце). Методы включают заражение лабораторных животных исследуемым материалом с последующим выделением чистой культуры патогена либо установлением факта присутствия микробного токсина и его природы. Моделирование экспериментальных инфекций у чувствительных животных — важный инструмент изучения патогенеза заболевания и характера взаимодействий внутри системы микроорганизм-макроорганизм. Для проведения биологических проб используют только здоровых животных определённых массы тела и возраста. Инфекционный материал вводят внутрь, в дыхательные пути, внутрибрюшинно, внутривенно, внутримышечно, внутрикожно и подкожно, в переднюю камеру глаза, через трепанационное отверстие черепа, субокципитально (в большую цистерну головного мозга). У животных прижизненно забирают кровь, экссудат из брюшины, после гибели — кровь, кусочки различных органов, СМЖ, экссудат из различных полостей. Серологические методы исследований выявления специфических AT и Аг возбудителя — важный инструмент в диагностике инфекционных заболеваний. Особую ценность они имеют в тех случаях, когда выделить возбудитель не представляется возможным. При этом необходимо выявить повышение титров AT, в связи с чем исследуют парные образцы сыворотки, взятые в интервале 10-20 сут (иногда этот интервал может быть более длительным). AT обычно появляются в крови на 1-2-ю неделю заболевания и циркулируют в организме относительно долго, что позволяет использовать их выявление для ретроспективных эпидемиологических исследований. Определение классов Ig чётко характеризует этапы инфекционного процесса, а также может служить косвенным прогностическим критерием, Особое значение имеют методы выявления микробных Аг. В значимых количествах они появляются уже на самых ранних сроках, что делает их идентификацию важным инструментом экспресс-диагностики инфекционных заболеваний, а количественное их определение в динамике инфекционного процесса служит критерием эффективности проводимой антимикробной терапии. Аллергологические методы исследования Антигены многих возбудителей обладают сенсибилизирующим действием, что используют для диагностики инфекционных заболеваний, а также при проведении эпидемиологических исследований. Наибольшее распространение нашли кожно-аллергические пробы, включающие внутри-кожное введение Аг (аллергена) с развитием реакции ГЗТ. Кожные пробы нашли применение в диагностике таких заболеваний как сап, мелиоидоз, бруцеллёз. Наиболее известна проба Манту, используемая как для диагностики туберкулёза, так и для оценки невосприимчивости организма к возбудителю. 2. Суть терминов: «культуральные свойства микробов». Культуральные признаки микробов определяются характером роста их на питательных средах. Будучи постоянными, для каждого вида микроба, они являются важным диагностическим признаком. Рост микробов на плотной питательной среде. Для изучения свойств колоний микробы культивируют на плотных питательных средах в чашках Петри. При посеве материала стараются получить изолированный рост колоний. Чашки с посевом просматривают сначала невооруженным глазом или через лупу, затем помещают их на столик микроскопа вверх дном и просматривают колонии в проходящем свете с объективом малого увеличения и с суженной диафрагмой. Колонии характеризуют по величине, форме, контуру края, рельефу, поверхности, цвету, структуре и консистенции. Величина колонии определяется ее диаметром. В зависимости от диаметра различают колонии точечные (диаметр меньше 1 мм), мелкие (диаметр 1—2 мм), средние (диаметр 2—4 мм) и крупные (диаметр 4—6 мм и более). Форма колонии бывает правильная — круглая, неправильная — амебовидная, ризоидная — корневидная, напоминающая переплетающиеся корни деревьев (рис.28). Характер контура края определяют при рассмотрении колонии под лупой или микроскопом с малым увеличением. Различают ровные края в виде четко выраженной линии и неровные (рис.29). Последние делят на: фестончатый край, состоящий из крупных, слегка округлых или уплощенных зубцов правильной формы; волнистый край, который несколько отличается от фестончатого тем, что крупные зубцы его выражены нечетко; эрозированный, или зазубренный, край, состоящий из острых зубцов различной величины и формы; бахромчатый край, имеющий нежные ворсинки. В некоторых случаях четко выраженная линия, отграничивающая колонию от поверхности среды, отсутствует. Такой край колонии называется расплывчатым. Рельеф (профиль) колонии характеризуется приподнятостью ее над поверхностью питательной среды и контуром формы в вертикальном разрезе (рис.30). Определяется рельеф колонии невооруженным глазом или с лупой при рассматривании сверху и сбоку. Различают: 1) каплеобразные и куполообразные колонии правильной круглой формы с различно выраженной степенью выпуклости, которые в вертикальном разрезе представляют собой сегмент шара и отличаются только длиной радиуса. Колонии слабовыпуклые имеют большую длину радиуса; куполообразные — меньшую; 2) колонии плосковыпуклые с плоским верхом, пологими или круто обрывающимися краями; имеют в вертикальном разрезе форму трапеции; 3) колонии конусообразные, имеющие в вертикальном разрезе форму треугольника: 4) колонии с приподнятой в виде соска серединой и валиком по периферии; 5) колонии с вдавленным центром; 6) колонии плоские, стелющиеся по поверхности среды.  Рис. 28. Форма колоний: а – круглая; б – круглая с фестончатым краем; в – круглая с валиком по краю; г; д – ризоидная; е – с ризоидным краем; ж –амебовидная; з – нитевидная; и – складчатая; к – неправильная; л – концентрическая; м – сложная 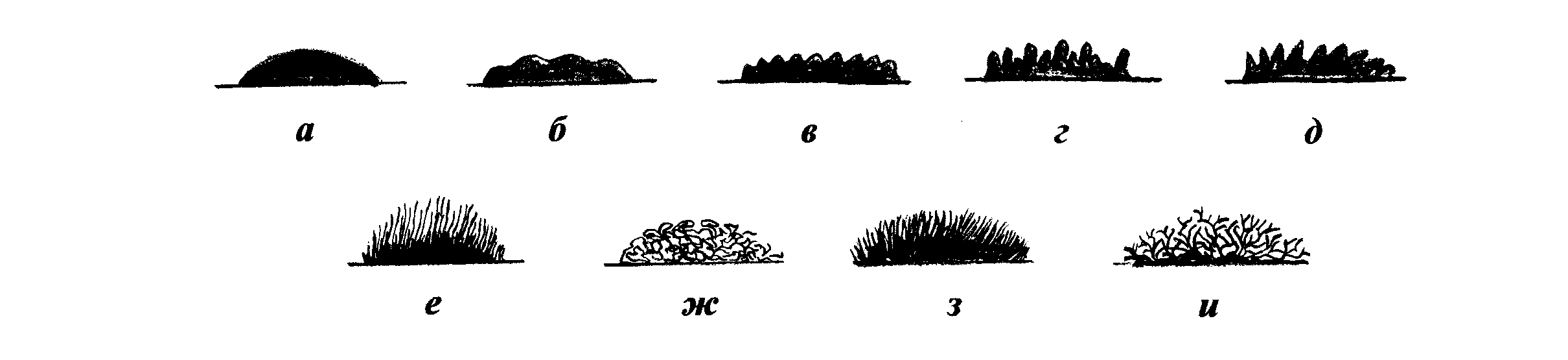 Рис. 29. Край колоний: а - гладкий; б – волнистый; в – зубчатый; г – лопастный; д – неправильный; е – реснитчатый; ж – нитчатый; з – ворсинчатый; и – ветвистый Поверхность колонии изучают с помощью лупы или под микроскопом при малом увеличении. Поверхность колоний бывает матовая или блестящая с глянцем, сухая или влажная, гладкая или шероховатая. Гладкие колонии обозначают буквой S (smooth), шероховатые — буквой R (rough), что означает соответственно “гладкий” и “шероховатый”. Механизм формирования гладких и шероховатых форм колоний обусловлен различием процессов клеточного деления. Микробные клетки в колониях S-форм располагаются, соприкасаясь своими боковыми поверхностями, клетки R-форм, сохраняя при делении цитоплазматические мостики, образуют цепочки, которые, накладываясь, друг на друга, обусловливают шероховатую поверхность и неровный край колонии. 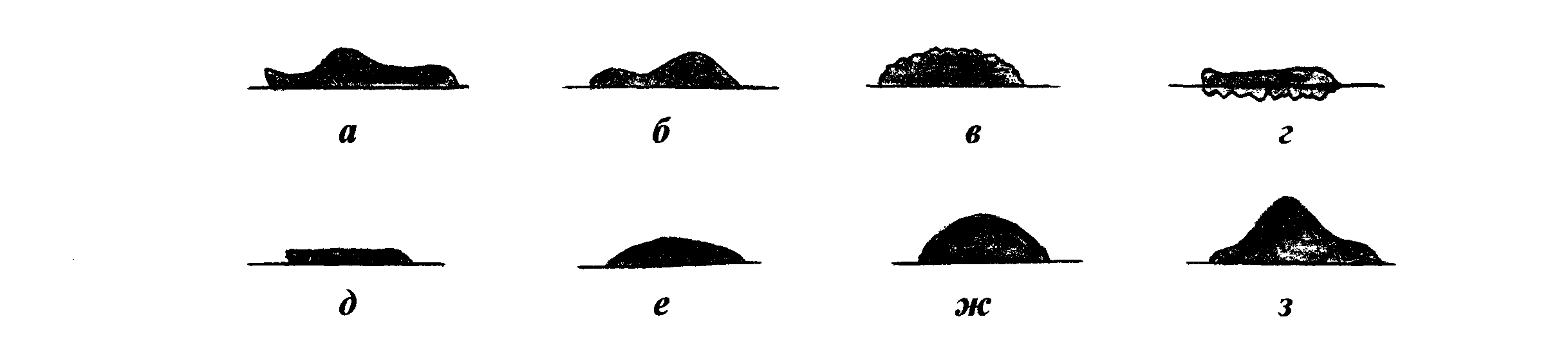 Рис. 30. Профиль колоний: а – изогнутый; б – кратерообразный; в – бугристый; г – врастающий в агар; д – плоский; е –выпуклый; ж – каплевидный; з – конусовидный Цвет колонии определяется пигментом, который продуцирует культура микробов. Преобладающее большинство патогенных бактерий пигмента не образует, вследствие чего колонии их бесцветны или молочно-мутного цвета, похожи на опал. В проходящем свете такие колонии в большей или меньшей степени прозрачны. Пигментообразующие виды микробов дают колонии различных цветов: кремовые, желтые, золотисто-оранжевые, синие, красные, сиреневые, черные и др. Структура колоний определяется в проходящем свете при слабом увеличении микроскопа, суженной диафрагме или при несколько опущенном конденсоре. У пигментированных колоний и колоний, не пропускающих света, она не определяется. По характеру структуры различают следующие виды колоний: 1) гиалиновые — бесцветные, прозрачные, без видимой определенной структуры; 2) зернистые, которые в зависимости от величины зерен разделяются на мелко - и грубозернистые; 3) нитевидные или волокнистые, характеризующиеся наличием длинных, густо переплетающихся нитей в толще колонии. Колонии бывают однородные и неоднородные. Строение первых одинаково во всех частях, у вторых центральная часть отличается от периферической или отдельные сектора имеют строение, неодинаковое с остальной массой. Консистенцию колонии, определяющую ее физическое состояние, исследуют посредством прикосновения или взятия из нее части материала бактериальной петлей. По характеру консистенции колонии бывают: 1) пастообразные, легко снимающиеся и размывающиеся по поверхности питательной среды наподобие сливочного масла; 2) вязкие или слизистые, прилипающие и тянущиеся за петлей; 3) волокнистые или кожистые, плотные, снимающиеся с поверхности питательной среды в виде упругой пленки, соответствующей величине и форме колонии; 4) хрупкие, сухие, рассыпающиеся при прикосновении петли. |
