Биохимия. тема6. 1. Регуляция активности фермента доступностью субстрата, доступностью кофермента, влиянием концентрации продукта и условий среды на скорость протекания ферментативных реакций
 Скачать 136.5 Kb. Скачать 136.5 Kb.
|
|
1. Регуляция активности фермента доступностью субстрата, доступностью кофермента, влиянием концентрации продукта и условий среды на скорость протекания ферментативных реакций. Важный параметр - это наличие первого субстрата. Чем больше концентрация исходного субстрата, тем выше скорость метаболического пути. Другой параметр - наличие регенерированных коферментов. Например, в реакциях дегидрирования коферментом дегидрогеназ служат окисленные формы NAD+, FAD, FMN, которые восстанавливаются в ходе реакции. Чтобы коферменты вновь участвовали в реакции, необходима их регенерация, т.е. превращение в окисленную форму. Регуляция каталитической активности ферментов Важнейшее - регуляция каталитической активности одного или нескольких ключевых ферментов данного метаболического пути. Это высокоэффективный и быстрый способ регуляции метаболизма. Основные способы регуляции активности ферментов: -Аллостерические ферменты: активность регулируется эффекторами (клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют). -регуляция с помощью белк-белковых взаимодействий -регуляция путем фосфорилирования, дефосфорилирования молекулы фермента -регуляция частичным (ограниченным) протеолизом 2. Аллостерическая регуляция активности ферментов. Строение аллостерических ферментов, понятие об аллостерическом центре. Регуляция по принципу обратной связи. Роль аллостерических ферментов в метаболизме клетки - быстро реагируют на малейшие изменения внутреннего состояния клетки: 1.при анаболических процессах: ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений; 2.при катаболических процессах: в случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии; субстраты при этом расходуются на реакции запасания резервных питательных веществ; 3.для координации анаболических и катаболических путей: АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты; 4.для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). Конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути. Аллостерические эффекторы. Эффектор, вызывающий снижение (ингибирование) активности фермента, называют отрицательным эффектором, или ингибитором. Эффектор, вызывающий повышение (активацию) активности ферментов, называют положительным эффектором, или активатором. Аллостерическими эффекторами часто служат различные метаболиты. Конечные продукты - часто ингибиторы, исходные вещества - активаторы. Аллостерические ферменты имеют определенные особенности строения: - обычно являются олигомерными белками,состоящими из нескольких протомеров; - имеют аллостерический центр,пространственно удаленный от каталитического активного центра; - эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах. Аллостерические центры, так же как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие - к ингибиторам. Протомер, на котором находится аллостерический центр, называется регуляторным протомеромв отличие от каталитического протомера,содержащего активный центр, в котором проходит химическая реакция. Аллостерические ферменты обладают свойством кооперативности:взаимодействие аллостерического эффектора с аллостерическим центром вызывает кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или повышает каталитическую активность фермента. Если к аллостерическому центру присоединяется ингибитор, то в результате кооперативных конформационных изменений происходит изменение конформации активного центра, что вызывает снижение сродства фермента к субстрату и, соответственно, снижение скорости ферментативной реакции. И наоборот, если к аллостерическому центру присоединяется активатор, то сродство фермента к субстрату увеличивается, что вызывает повышение скорости реакции. Регуляция аллостерических ферментов обратима:отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента. Аллостерические ферменты катализируют ключевые реакцииданного метаболического пути. Аллостерические ферменты играют важную роль в различных метаболических путях, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состава клетки. Скорость метаболических процессов зависит от концентрации веществ, как использующихся, так и образующихся в данной цепи реакций. Исходные вещества могут быть активаторами аллостерических ферментов метаболического пути. В то же время при накапливании конечного продукта какого-либо метаболического пути он может действовать как аллостерический ингибитор фермента. Такой способ регуляции распространен в организме и носит название «отрицательная обратная связь»:   Рис. 2.26. Схема строения и функционирования аллостерического фермента: Рис. 2.26. Схема строения и функционирования аллостерического фермента: 
 · Фермент, катализирующий превращение субстрата А в продукт В, имеет аллостерический центр для отрицательного эффектора, которым служит конечный продукт метаболического пути F. Если концентрация F увеличивается (т.е. вещество F синтезируется быстрее, чем расходуется), ингибируется активность одного из начальных ферментов. Такую регуляцию называют отрицательной обратной связью, или ретроингибировани-ем. Отрицательная обратная связь - часто встречающийся механизм регуляции метаболизма в клетке. · В центральных метаболических путях исходные вещества могут быть активаторами ключевых ферментов метаболического пути. Как правило, при этом аллостерической активации подвергаются ферменты, катализирующие ключевые реакции заключительных этапов метаболического пути:  · В качестве примера можно рассмотреть принципы регуляции гликолиза - специфического (начального) пути распада глюкозы (рис. 2-31). Один из конечных продуктов распада глюкозы - молекула АТФ. При избытке в клетке АТФ происходит ретро-ингибирование аллостерических ферментов фосфофруктокиназы и пируваткиназы. При образовании большого количества фруктозо-1,6-бисфосфата наблюдают аллостерическую активацию фермента пируваткиназы. Регуляция каталитической активности ферментов белок-белковыми взаимодействиями.Некоторые ферменты изменяют свою каталитическую активность в результате белок-белковых взаимодействий. Рассмотрим 2 механизма активации ферментов с помощью белок-белковых взаимодействий: · активация ферментов в результате присоединения регуляторных белков; · изменение каталитической активности ферментов вследствие ассоциации или диссоциации протомеров фермента. Активация ферментов в результате присоединения регуляторных белков. Этот тип регуляции можно рассмотреть на примере активации фермента аденилатциклазы, локализованной в плазматической мембране клетки. · Активный центр аденилатциклазы локализован на цитоплазматической стороне плазматической мембраны. Активированная аденилатциклаза катализирует реакцию образования из АТФ циклического 3',5'-АМФ (цАМФ) - вторичного, внутриклеточного посредника действия гормонов (см. схему ниже). · В мембране аденилатциклаза функционирует в комплексе с другими белками: · рецептором гормона, выступающего во внеклеточную среду и взаимодействующего с гормонами; · с G-белком, занимающим промежуточное положение между рецептором и ферментом аденилатциклазой. G-белок - олиго-мерный белок, состоящий из 3 субъединиц - α, β, γ. α-Субъединица имеет центр связывания и расщепления ГТФ. Поэтому этот белок называется ГТФ-связывающим белком, или G-белком; · в результате связывания гормона с рецептором происходит изменение конформа-ции G-белка, уменьшение его сродства к молекуле ГДФ, с которой он связан в отсутствие гормонального сигнала, и увеличение сродства к ГТФ. Присоединение ГТФ вызывает конформационные изменения в G-белке и диссоциацию его на субъединицы: субъединицу α, связанную с ГТФ (α-ГТФ), димер βγ; · α-ГТФ имеет высокое сродство к аденилатциклазе, его присоединение приводит к активации последней, поэтому α-ГТФ - регуляторный белок, а данный механизм активации аденилатциклазы называют активацией ферментов в результате присоединения регуляторных белков (рис. 2-32). 3. Ассоциация и диссоциация регуляторных белков как способ регуляции ферментативной активности на примере протеинкиназы А, ацетил-КоА карбоксилазы. Протеинкиназы - группа ферментов, катализирующих перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (вызывают фосфорилирование белков). Механизмы активации различных протеинкиназ неодинаковы. В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно привести регуляцию активности фермента Протеинкиназы А. Протеинкиназа А (цАМФ-зависимая) состоит из 4 субъединиц 2 типов: 2 регуляторных (R) и 2 каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3',5'-АМФ (цАМФ), по 2 на каждую субъединицу. Присоединение 4 молекул цАМФ к 2 регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса, при этом высвобождаются 2 активные каталитические субъединицы.Такой механизм регуляции обратим. Отщепление молекул цАМФ от регуляторных субъединиц приведёт к ассоциации регуляторных и каталитических субъединиц протеинкиназы А с образованием неактивного комплекса. Инсулин активирует протеинфосфатазуи способствует дефосфорилированию и активации ацетил-SКоА-карбоксилазы. Одновременно в клетке дефосфорилируется и инактивируется ТАГ-липаза. Глюкагон, адреналинили другие гормоны, действуя по аденилатциклазному механизму с участием цАМФ-зависимой протеинкиназы, вызывают фосфорилирование и ингибирование ацетил-SКоА-карбоксилазы и, следовательно, останавливают липогенез. Одновременно они активируют ТАГ-липазу (механизм). При уменьшении количества инсулинаи возрастании глюкагонаусиливаются липолиз в жировой ткани, поступление жирных кислот в печень и другие ткани и реакции их β-окисления. Такое состояние наблюдается при гипогликемии любого происхождения. При обратном соотношении гормонов начинаются реакции синтеза жиров. 1. Активность ацетил-SКоА-карбоксилазы регулируется: · цитратом– аллостерический активатор фермента, накапливается в цитозоле при избыточном количестве энергии, · ацил-SКоА по принципу обратной отрицательной связи ингибирует фермент, препятствуя синтезу малонил-SКоА. Т.е. если ацил-SКоА не успевает вступить в этерификацию или усиливается липолиз в клетке или увеличивается поступление жирных кислот извне, то автоматически блокируется синтез новых жирных кислот. 2. Транспорт цитрата из митохондрии в цитозоль подавляется избытком ацил-SКоА, это снижает синтез жирных кислот. 3. Карнитин-ацилтрансфераза ингибируется при образовании малонил-SКоА, что останавливает поступление ацил-SКоА внутрь митохондрий и снижает β-окисление. Таким образом, когда имеется избыток энергии, то усиление синтеза жирных кислот достигается при поступлении цитрата и при наличии малонил-S-КоА. После синтеза молекулы ацил-SКоА быстро поступают на этерификацию глицерола до ТАГ и не накапливаются в цитозоле. Если в клетке недостаточно энергии, то необходимо активировать β-окисление жирных кислот для ее получения. В этом случае гормональные влияния вызывают липолиз (или поступление жирных кислот извне) и накопление ацил-SКоА в цитозоле, что автоматически (см пункт 2) через уменьшение количества цитрата и малонил-SКоА препятствует синтезу новых жирных кислот. Параллельно (см пункт 3) убыль малонил-SКоА и активация карнитин-ацил-трансферазы запускает β-окисление. 4. Ковалентная модификация путем фосфорилирования и дефосфорилирования, значение для регуляции активности ферментов. Субстраты фосфорилирования (серин, треонин, тирозин). Протеинкиназы. Фосфопротеинфосфатазы. Значение протеинкиназ. Активаторы протеинкиназ (циклические нуклеотиды (цАМФ, цГМФ), кальций, инозитфосфатиды) и их участие во внутриклеточной передаче внешнего сигнала. В биологических системах часто встречается механизм регуляции активности ферментов с помощью ковалентной модификации аминокислотных остатков. Быстрый и широко распространённый способ химической модификации ферментов - фосфорилирование/дефосфорилирование. Модификации подвергаются ОН-группы фермента. Фос-форилирование осуществляется ферментами протеинкиназами, а дефосфорилирование - фосфопротеинфосфатазами. Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными. Изменение активности фермента, вызванное фосфорилированием, обратимо. Отщепление остатка фосфорной кислоты осуществляется ферментами фосфопротеинфосфатазами. Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро изменять активность ключевых ферментов метаболических путей в зависимости от условий внешней среды. Антагонистичные по функции гормоны противоположным образом влияют на фосфо-рилирование/дефосфорилирование ферментов, вызывая противоположные эффекты изменения метаболизма клетки. Например, под действием глюкагона (в период между приёмами пищи) в клетках происходит уменьшение синтеза энергетического материала - жира, гликогена и усиление его распада (мобилизация), вызванного фосфо-рилированием ключевых ферментов этих процессов. А под действием инсулина (во время пищеварения), наоборот, активируется синтез гликогена и ингибируется его распад, так как взаимодействие инсулина с рецептором активирует сигнальный путь, приводящий к дефосфорилированию тех же ключевых ферментов. 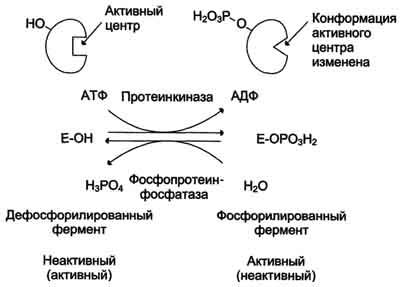
Вслед за открытием цАМФ и анализом его роли в опосредовании эффектов глюкагона и адреналина на гликолиз было выяснено, что циклический нуклеотид принимает участие в регуляции разнообразных метаболических функций. Свидетельством тому служит глобальное присутствие цАМФ у прокариот и эукариот и его участие в реакциях, связанных не только с действием гормонов [4]. Было установлено, что способность цАМФ активировать фосфорилазкиназу в печеночных клетках является общим свойством эукариотических клеток, в которых все эффекты цАМФ реализуются через фосфорилирование белковых субстратов. Подобно цАМФ в эукариотических клетках присутствует фермент, называемый цАМФ-зависимой протеинкиназой, который опосредует эффекты цАМФ на клеточный метаболизм [37]. У прокариот эффекты цАМФ реализуются через другой механизм — взаимодействие цАМФ-связывающих белков с регуляторными участками генома. В животных тканях цАМФ-зависимая протеинкиназа катализирует фосфорилирование многих белковых субстратов, перенося фосфат с АТФ на специфические сериновые (и иногда треониновые) остатки. По данному месту фосфорилируется ряд известных белковых субстратов, в том числе ферменты, такие, как фосфорилазкиназа, гликогенсинтетаза и гормончувствительная липаза, и неферментные клеточные белки, такие, как гистоны, ядерные негистоновые, рибосомные белки, белки микротрубочек и мембран [38]. Большинство субстратов, обладающих ферментативной активностью, существует либо в фосфо-, либо в дефосфоформах, взаимопревращение которых из активного в неактивное состояние происходит в результате согласованного действия протеинфосфокиназы и фосфопротеинфосфатазы. Протеинфосфокиназы, в том числе цАМФ-зависимая протеинкиназа, переносят g-фосфатную группу с АТФ на белковые субстраты, тогда как фосфопротеинфосфатазы катализируют гидролиз фосфопротеинов, отщепляя от них фосфатные группы. Этот цикл фосфорилирование—дефосфорилирование считается в настоящее время повсеместно распространенным механизмом регуляции метаболизма, причем применительно не только к ферментам, но и к сократительным реакциям, мембранным активностям и ядерным процессам. На функциональном уровне такие эффекты проявляются физиологическими процессами мышечного сокращения, секреции и деятельности нейронов. 1. Ферменты, зависимые и не зависимые от циклических нуклеотидов 2. цАМФ- и цГМФ-зависимые ферменты 3. цАМФ-зависимые ферменты I и II типов Протеинкиназами называют ферменты, катализирующие перенос фосфата от АТФ к специфическому аминокислотному остатку (серину, треонину, тирозину и т.д.). Протеинкиназы эукариот представляют собой суперсемейство гомологичных белков. Важнейшими представителями этого семейства являются серин-треониновые протеинкиназы и тирозиновые протеинкиназы. Протеинкиназы, не зависимые от циклических нуклеотидов, присутствуют во всех областях клетки и регулируются, по-видимому, другими внутриклеточными сигналами. Недавно обнаруженный класс протеинкиназ для своей активности требует присутствия липидных компонентов мембраны и кальция; ферменты этого класса могут быть частью трансмембранных контролирующих систем, регулируемых кальцием. Большинство контролируемых гормонами протеинкиназ клеток-мишеней зависит от цАМФ или (реже) от цГМФ. Такие зависимые от циклических нуклеотидов протеинкиназы сосредоточены в цитозоле, по встречаются также в плазматических мембранах и в других клеточных органеллах. Они активируются микромолярными концентрациями циклических пуриновых нуклеотидов (цАМФ и цГМФ) и быстро стимулируются при повышении продукции циклических нуклеотидов в результате действия гормона на клеточную мембрану. Оба типа зависимых от циклических нуклеотидов протеинкиназ активируются при связывании нуклеотида специальным участком фермента. цАМФ-зависимая протеинкиназа в неактивной форме представляет собой тетрамер, состоящий из субъединиц двух типов: для связывания цАМФ и для катализа переноса фосфата. Неактивный тетрамер состоит из двух связывающих, или регуляторных (Р), субъединиц и двух ферментных, или каталитических (К), субъединиц. При связывании цАМФ с Р2-субъединицами тетрамер Р2К2 диссоциирует, высвобождая активные каталитические субъединицы, обладающие фосфотрансферазной активностью [38]. Эту реакцию можно представить следующим образом: Р2К2 (неактивная) + 4цАМФ « Р2•цАМФ4 + 2К (активная). После своего образования свободная К-субъединица обнаруживает функциональное сходство с цАМФ-независимыми протеинкиназами, но ее можно отличить по характерному размеру (молекулярная масса 38000) и реакции на термостабильный ингибиторный белок, который блокирует ее каталитическую активность и предотвращает рекомбинацию с регуляторной субъединицей. Каталитические субъединицы, по всей вероятности, едины во всех формах цАМФ-зависимых протеинкиназ, тогда как регуляторные субъединицы обнаруживают индивидуальные особенности. Считается, что регуляторные субъединицы, высвобождающиеся при диссоциации протеинкиназы, остаются в виде Р2-димера и позднее подвергаются повторной ассоциации со свободными каталитическими субъединицами, в результате чего восстанавливается неактивный голофермент. В отсутствии цАМФ регуляторные и каталитические субъединицы связаны друг с другом с высоким сродством и в физиологических условиях присутствуют преимущественно в виде неактивного голофермента [40]. цГМФ-зависимые протеинкиназы вначале были обнаружены у беспозвоночных, но позднее их нашли и в тканях млекопитающих, где они функционируют иным образом, чем цАМФ-зависимый фермент. Их сродство к цАМФ гораздо ниже, чем к цГМФ, а ферментативная активность обычно также уступает таковой цАМФ-зависимого фермента. Активация осуществляется путем связывания цГМФ регуляторным участком фермента, причем считают, что подобно цАМФ-зависимой протеинкиназе этот фермент также диссоциирует с высвобождением активной каталитической единицы. Недавно была установлена гомология между двумя формами зависимых от циклических нуклеотидов ферментов, что привело к мысли об их общем эволюционном происхождении из примитивной фосфотрансферазы [41]. 5. Протеолитическая модификация активности ферментов. Ограниченный протеолиз как способ регуляции активности протеолитических ферментов и его значение для организма. Некоторые ферменты, функционирующие вне клеток (в ЖКТ или в плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определённых пептидных связей, что приводит к отщеплению части белковой молекулы предшественника. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента. Рассмотрим механизм частичного протеолиза на примере активации протеолитического фермента трипсина. Трипсиноген, синтезируемый в поджелудочной железе, при пищеварении по протокам поджелудочной железы поступает в двенадцатиперстную кишку, где и активируется путём частичного протеолиза под действием фермента кишечника энтеропептидазы. В результате отщепления гексапептида с N-конца формируется активный центр в оставшейся части молекулы. Следует напомнить, что трипсин относят к семейству "сериновых" протеаз - активный центр фермента содержит функционально важный остаток Сер. Частичный протеолиз - пример регуляции, когда активность фермента изменяется необратимо. Такие ферменты функционируют, как правило, в течение короткого времени, определяемого временем жизни белковой молекулы.Частичный протеолиз лежит в основе активации протеолитических ферментов, белков свёртывающей системы крови и фибринолиза, белков системы комплемента, а также пептидных гормонов. 6. Ингибирование активности ферментов. Виды ингибирования: обратимое и необратимое, конкурентное, неконкурентное и бесконкурентное. Константа ингибирования. СХЕМЫ!!!! Под термином "ингибирование ферментативной активности" понимают снижение каталитической активности в присутствии определённых веществ - ингибиторов. К ингибиторам следует относить вещества, вызывающие снижение активности фермента. А. Обратимое ингибирование Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными. 1. Конкурентное ингибирование К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется. Кинетические зависимости Конкурентные ингибиторы уменьшают скорость химической реакции. Конкурентный ингибитор повышает Кm для данного субстрата (уменьшает сродство субстрата к ферменту). Это означает, что в присутствии конкурентного ингибитора необходима большая концентрация субстрата для достижения 1/2 Vmax. Увеличение соотношения концентрации субстрата и ингибитора снижает степень ингибирования. При значительно более высоких концентрациях субстрата ингибирование полностью исчезает, потому что активные центры всех молекул фермента будут находиться преимущественно в комплексе с субстратом. Лекарственные препараты как конкурентные ингибиторы Многие лекарственные препараты оказывают своё терапевтическое действие по механизму конкурентного ингибирования. Антиметаболиты как лекарственные препараты В качестве ингибиторов ферментов по конкурентному механизму в медицинской практике используют вещества, называемые антиметаболитами. Эти соединения, будучи структурными аналогами природных субстратов, вызывают конкурентное ингибирование ферментов, с одной стороны, и, с другой - могут использоваться этими же ферментами в качестве псевдосубстратов, что приводит к синтезу аномальных продуктов. Аномальные продукты не обладают функциональной активностью; в результате наблюдают снижение скорости определённых метаболических путей. В качестве лекарственных препаратов используют следующие антиметаболиты: сульфаниламидные препараты (аналоги парааминобензойной кислоты), применяемые для лечения инфекционных заболеваний, аналоги нуклеотидов для лечения онкологических заболеваний. 2. Неконкурентное ингибирование Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата. Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции. Кинетические зависимости Этот тип ингибирования характеризуется снижением Vmax ферментативной реакции и уменьшением сродства субстрата к ферменту, т.е. увеличением Кm. Б. Необратимое ингибирование Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию. К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению . При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжёлых металлов вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента. 1. Специфические и неспецифические ингибиторы Использование необратимых ингибиторов представляет большой интерес для выяснения механизма действия ферментов. С этой целью применяют вещества, блокирующие определённые группы активного центра ферментов. Такие ингибиторы называют специфическими. Ряд соединений легко вступает в реакции с определенными химическими группами. Если эти группы участвуют в катализе, то происходит полная инактивация фермента. Роль гидроксильных групп серина в механизме катализа исследуют с помощью фторфосфатов, например диизопропилфторфосфата. Дии-зопропилфторфосфат (ДФФ) специфически реагирует лишь с одним из многих остатков серина в активном центре фермента. Остаток Сер, способный реагировать с ДФФ, имеет идентичное или очень сходное аминокислотное окружение. 2. Необратимые ингибиторы ферментов как лекарственные препараты Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов, - широко используемый препарат аспирин. Противовоспалительный нестероидный препарат аспирин обеспечивает фармакологическое действие за счёт ингибирования фермента циклооксигеназы, катализирующего реакцию образования простагландинов из арахидоновой кислоты. Это вызывает снижение образования продуктов реакции простагландинов, которые обладают широким спектром биологических функций, в том числе являются медиаторами воспаления. 7. Лекарственные препараты как ингибиторы ферментов Все ингибиторы ферментов делят на 2 группы: ингибиторы активности ферментов патогенных бактерий и ингибиторы активности ферментов макроорганизма. К первой группе относятся, например, антибактериальные антибиотики (пенициллины, цефалоспорины и др.), сульфаниламидные препараты, блокирующие ферменты синтеза фолиевой кислоты у бактерий (сульфадимезин, сульфадиметоксин, стрептоцид и др.), ингибиторы -лактамаз бактерий, которые гидролизуют -лактамные антибиотики (сальбактам, клавулановая кислота и др.). Вторая группа включает большое количество препаратов, оказывающих специфическое действие и обладающих высокой активностью и большой избирательностью (табл. 5.3.1).
Так, салициловая кислота и ее производные применялись как противовоспалительные средства задолго до открытия простагландинов и ферментов, регулирующих их синтез. Определены показания к клиническому применению регуляторов активности ферментов: 1) дефицит естественных ингибиторов, которые ограничивают влияние эндогенных ферментов или защищают их от повреждающего действия чужеродных ферментов (бактериальных). Например, недостаток α1– антитрипсина (антипротеазный ингибитор) – одного из более 10 ингибиторов белковой природы, находящихся в плазме крови, приводит к эмфиземе легких, так как при этом значительно возрастает протеолитическое действие эластазы на ткань легкого; 2) заболевания, связанные с гиперфункцией ферментов (преждевременная их активация, аномальный выброс в кровь и ткани); например, острый панкреатит, в патогенезе которого большую роль играют многочисленные гидролазы, образующиеся в ткани поджелудочной железы. Основная роль на ранней стадии заболевания принадлежит трипсину и химотрипсину, поэтому в качестве лекарственного средства используют ингибиторы этих ферментов трасилол, контрикал и др.; 3) проникновение в организм чужеродных ферментов (бактериальных) или введение их больному в качестве лекарственного препарата в неадекватной дозе: например, антибактериальных антибиотиков и сульфаниламидных препаратов. Среди соединений, являющихся лекарственными препаратами, представлены ингибиторы всех классов ферментов. Особенно много ингибиторов оксидоредуктаз и гидролаз. Таким образом, области применения ферментов в медицине чрезвычайно широки. |
