эксперим. химия. 1. Введение в теорию планирования эксперимента
 Скачать 199.25 Kb. Скачать 199.25 Kb.
|
|
1. Введение в теорию планирования эксперимента. Эксперимент занимает главное место среди способов получения информации об исследуемом объекте в естественно-научной области знания, является критерием применимости большинства наших представлений об окружающем мире. Статистически достоверную информацию можно получить только из грамотно спланированного эксперимента. Методы планирования эксперимента могут решать принципиально две различные по типу задачи: 1) получить наиболее точную модель, описывающую экспериментальные данные; 2) минимизировать количество экспериментов, дающих возможность описать экспериментальные данные с приемлемой статистической значимостью. Основными понятиями теории планирования эксперимента являются эксперимент как система операций, воздействий и (или) наблюдений, направленных на получение информации об объекте исследования; план эксперимента как совокупность данных, определяющих число, условия и порядок реализации опытов; отклик как случайная переменная, наблюдаемая в ходе эксперимента; фактор как переменная величина, по предположению влияющая на результаты эксперимента; уровень как фиксированное(ые) значение(я) переменной величины относительно начала отсчета. Совокупность всех точек плана, отличающихся уровнями хотя бы для одного из факторов, образует спектр плана, возможный для экспериментального воплощения. План, содержащий все возможные комбинации всех факторов на определенном числе уровней равное число раз, называется полнофакторным. 2. Термический анализ. Термический анализ включает в себя группу методов, изучающих изменение свойств материалов под воздействием температуры в различных газовых средах. Обычно выделяют несколько методов, отличающихся тем, какое свойство материала измеряется. 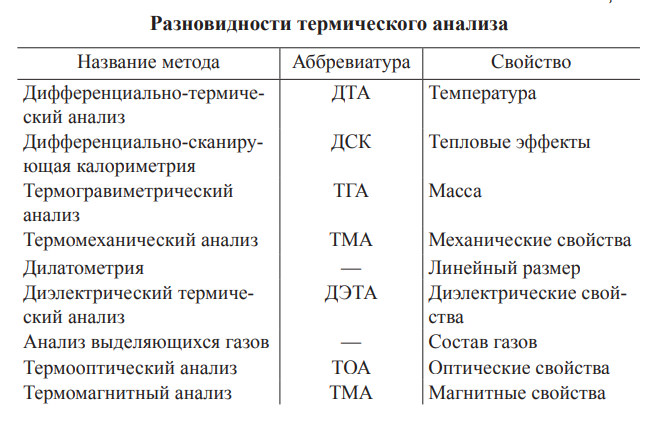 Обычно изменение температуры осуществляется по заранее заданной программе: либо это непрерывное увеличение или уменьшение температуры с постоянной скоростью; либо серия измерений при различной температуре. Методика эксперимента, как правило, состоит из двух последовательных этапов: съемка базовой линии (холостой опыт без образца) и съемка отклика системы с образцом. 3. Использование излучения в аналитической химии. Значительная часть физических методов основана на взаимодействии какого-либо излучения с веществом. Это взаимодействие приводит к различным энергетическим переходам, которые регистрируются экспериментально в виде поглощения, отражения и рассеяния электромагнитного излучения. Спектроскопические методы основаны на взаимодействии электромагнитного излучения с веществом, т.е. на определении характеристик поглощаемого, отражаемого или рассеянного излучения. В СМА в качестве аналитических сигналов используются оптическая плотность, светопропускание, атомное поглощение, интенсивность спектральной линии излучения, длина волны (частота) испускаемого или абсорбируемого излучения. Спектральные методы анализа обладают высокой чувствительностью, точностью и селективностью (избирательностью). Они просты, универсальны, легко автоматизируются. СМА не требуют высоких расходов анализируемого вещества. 4. Общие сведения планирования эксперимента. Выбор плана определяется постановкой задачи исследования и особенностями объекта. Процесс исследования обычно разбивается на отдельные этапы. Информация, полученная после каждого этапа, определяет дальнейшую стратегию эксперимента – таким образом, возникает возможность оптимального управления экспериментом. Планирование эксперимента позволяет одновременно варьировать все факторы и получать количественные оценки основных эффектов и эффектов взаимодействию. Интересующие исследователя эффекты определяются со значительно меньшей ошибкой, чем та, которая характерна для традиционных методов исследования. В конечном счете, применение методов планирования эксперимента значительно повышает эффективность эксперимента. 5. Понятие химического эксперимента. Планирование эксперимента — это специальный подход к эксперименту, где математическим методам отводится ведущая роль, когда экспериментатор, основываясь на априорных данных, выбирает оптимальную модель, а на апостериорных — ее корректирует. Задачей любого планирования эксперимента является подбор коэффициентов некоторой регрессионной модели, описывающей экспериментальные данные. 6. Методы планирования химического эксперимента. В зависимости от типа решаемой задачи с помощью методов планирования эксперимента планы могут отличаться насыщенностью, связанной с разностью между числом точек спектра плана и числом оцениваемых параметров модели. Возможность выполнять эксперимент последовательно, переходя от более простых моделей, как правило, первого порядка, к более сложным (второго и более порядков), определяется свойством плана, называемым его композиционностью. 7. Критерий оптимальности химического эксперимента. Критерии D-, A- и E-оптимальности образуют так называемую первую группу критериев, связанных с ошибками определения коэффициентов регрессионной модели. Выбор критерия зависит от задачи. Так, для изучения влияния отдельных факторов используют критерий E-оптимальности. При поиске оптимума функции отклика — D-оптимальности. Если построение плана с использованием критерия D-оптимальности вызывает затруднения, переходят к более простому критерию A-оптимальности. Вторую группу критериев образуют критерии для задач описания поверхности отклика, определения ограничений для значений параметров функции отклика. Основным критерием здесь является критерий G-оптимальности, который требует такого построения точек экспериментального плана, когда достигается минимальное значение максимальной дисперсии оценки функции отклика. 8. Основные термины и понятия рефрактометрии. Рефрактометрия – метод, основанный на явлении преломления света при переходе из одной среды в другую, называемого рефракцией. При переходе луча света из одной оптически прозрачной среды в другую он изменяет свое первоначальное направление, то есть преломляется.  Рефрактометрический метод анализа (рефрактометрия) основан на зависимости показателя преломления света от состава системы. Такую зависимость устанавливают путём определения показателя преломления для стандартной серии растворов. По экспериментальным данным строят градуировочный график зависимости «показатель преломления – состав смеси», а затем, по графику и измеренному показателю преломления анализируемого раствора, определяют содержание вещества в нем. Достоинствами рефрактометрического анализа являются простота и быстрота определений, высока точность анализа (до сотых долей процента). Метод применяют для анализа разнообразных сложных систем: горючих и смазочных материалов, биологических и пищевых продуктов, лекарственных препаратов и др. 9. Применение рефрактометрии в качественном анализе; 10. Применение рефрактометрии в количественном анализе. Рефрактометрия в основном используется для количественного анализа, но применяется и для качественного анализа, поскольку показатель преломления является индивидуальной характеристикой вещества. Присутствие в исследуемой системе примесей влияет на его значение, поэтому определение коэффициента преломления используют для установления степени чистоты вещества. Рефрактометрическую идентификацию веществ проводят путём определения величин преломления и их физических характеристик (плотности, температуры кипения и т.д.). Полученные экспериментальные величины сравнивают с табличными и, таким образом, устанавливают природу веществ. Величину показателя преломления используют в качественном анализе для: • идентификации веществ; • определения чистоты и подлинности веществ. Метод рефрактометрии применяют для количественного анализа бинарных, тройных и разнообразных сложных систем растворов. Примером бинарных систем являются водные растворы спиртов, сахаров, глицерина, кислот, оснований, солей и др. 11. Устройство и работа рефрактометров. 12. Принцип работы рефрактометра. Рефрактометр состоит из двух призм: вспомогательной откидной призмы (1) с матовой гранью (2) и измерительной призмы (3). Между ними имеется тонкий зазор толщиной 0,1 мм, в который помещается несколько капель исследуемой жидкости (4). Измеряется предельный угол преломления на границе жидкость — измерительная призма. Встроенный в прибор компенсатор (6) позволяет сделать границу свет — тень черно-белой при освещении белым светом. Отсчеты производятся глазом (7). Луч света проходит через вспомогательную откидную призму (1) и рассеивается на нижней грани (2). При этом рассеянные лучи распространяются во всех направлениях, в том числе и параллельно поверхности с измерительной призмы (3). Далее эти лучи преломляются на границе жидкость (4) — измерительная призма (3), и, пройдя сквозь эту призму (3), попадают в устройство (5). Если граница свет — тень оказалась окрашенной и размытой, надо с помощью компенсатора (6) добиться резкой черно-белой границы.  13. Методика измерения показателя преломления. Для определения показателя преломления раскрывают призменный блок рефрактометра, разделяя призмы. Протирают верхнюю и нижнюю призмы ватным тампоном. На нижнюю призму наносят несколько капель жидкости, призмы закрывают, включают осветитель. Вращением окуляра получают чёткое изображение шкал рефрактометра. Перемещением рукоятки находят границу светотени. Поворотом рычага осветителя и вращением осветителя на оси добиваются максимальной контрастности границы светотени. Вращением ручки дисперсионного компенсатора устраняют окрашенность границы раздела светотени. По границе светотени по левой шкале производят отсчёт показателя преломления исследуемого раствора. Измерения производят 3 раза. 14. Определение концентрации вещества в растворе. Строят градуировочный график зависимости средних значений показателя преломления от известных концентраций растворов. Или можно методом стандартов. 15. Показатель преломления. Чем обусловлено изменение скорости распространения светового луча при переходе из одной среды в другую? 16. Как зависит показатель преломления вещества от температуры и давления, при которых проводятся его измерения? 17. Зависит ли показатель преломления вещества от длины волны преломляемого луча? Явление преломления (отклонения) световых лучей от первоначального направления на границе раздела двух сред связано с различием в скорости распространения света в различных средах. Преломление света оценивается абсолютным и относительным показателями преломления света. Отношение скорости распространения света в вакууме к скорости распространения света в среде или отношение синуса угла падения к синусу угла преломления называется абсолютным показателем преломления; при переходе луча света из воздуха в вещество – относительным показателем преломления среды 2 по отношению к среде 1. Практически n определяют по отношению к воздуху, т.е. измеряют относительный показатель преломления. Его величина зависит от агрегатного состояния вещества, поляризуемости, длины волны проходящего света, температуры. Как правило, рефрактометрические измерения выполняют при температуре 20°C и длине волны D линии спектра атома натрия (λ = 589,3 нм). 18. Что такое дисперсия рефракции, средняя дисперсия, относительная дисперсия? 19. Что такое мольная рефракция? Зависит ли мольная рефракция от условий измерения показателя преломления? Как можно рассчитать мольную рефракцию и для каких целей можно использовать эту характеристику? 20. В чем суть правила аддитивности мольной рефракции, для какой цели его может использовать на практике? Дисперсией называется зависимость рефракции или показателя преломления от длины волны. Зависимость эту лучше всего охарактеризовать величиной разности показателей преломления для двух длин волн. Разность соответствующих показателей преломления nF и nc называется средней дисперсией FС. Показатель RМ, называемый молярной рефракцией, имеет размерность объёма молекул, содержащихся в 1 моль вещества. 21. Какие лабораторные приборы наиболее часто используют для измерения показателя преломления вещества? 22. Какой принцип положен в основу конструкций рефрактометра Аббе и рефрактометра Пульфриха? В чем отличие рефрактометра Аббе от рефрактометра Пульфриха? Для измерения показателя преломления жидкостей используют оптические приборы – рефрактометры типа Пульфриха, действие которых основано на измерении угла преломления монохроматического света, что обеспечивает высокую точность определения показателя преломления – 2•10-5. Рефрактометр типа Пульфриха: отличительной особенностью этих приборов является использование источников света с линейчатым спектром и измерительных призм с преломляющим углом 90°. Шкала в этих приборах градуирована в угловых единицах и нужно проводить пересчет на показатель преломления с помощью специальных таблиц. Однако с помощью рефрактометров Пульфриха можно определять показатель преломления для разных длин волн и измерять дисперсию с точностью до 10-5. Главной частью этих приборов является прямоугольная призма, одна из граней которой расположена горизонтально, а вторая – вертикально. К горизонтальной грани приклеен цилиндрический сосуд, заполняемый испытуемой жидкостью Рефрактометры типа Аббе, действие которых основано на определении угла полного внутреннего отражения. Показатель преломления при этом измеряют в сложном белом свете, точность определения: 2•10-3 – 2•10-4. Рефрактометры типа Аббе: важнейшая особенность состоит в использовании «белого» света, дневного или электрического. На приборах типа Аббе можно изменять показатель преломления в интервале 1,2 -2,0. Действие рефрактометра основано на явлении полного внутреннего отражения, состоящем в том, что, если луч света идет из среды 1 в среду 2, то при некотором значении утла падения =0 угол преломления х примет максимальное значение х0 = 90. При этом луч, дойдя до поверхности раздела, далее пойдет вдоль этойповерхности. 23. Какое значение показателя преломления измеряется на рефрактометре Аббе? Какой конструктивный узел этого прибора обеспечивает измерение данной характеристики? 24. Опишите устройство рефрактометрических приборов, используемых в системах управления технологическими процессами. 25. Какие рефрактометрические характеристики вещества следует использовать для его точной идентификации? 26. В каких случаях для количественного определения концентрации раствора может быть использовано экспериментально измеренное значение показателя преломления? Поскольку показатель преломления раствора зависит не только от природы растворенного вещества и растворителя, но и от концентрации раствора. Рефрактометрическим методом можно определять количественный состав растворов, содержащих 1или 2 растворенное вещество. Однако чаще всего количественно определяют содержание в растворе одного компонента. Если в растворе содержится два растворенных вещества, количественное содержание каждого из них может быть определено, только если для таких растворов известны не только показатели преломления при разных сочетаниях концентрации каждого из компонентов в растворе, но и какая-то другая характеристика таких растворов (например, плотность, оптическая плотность, вязкость). При этом нужно помнить, что такие аналитические характеристики количественного анализа как чувствительность и точность очень сильно зависят от того, насколько сильно изменяется показатель преломления анализируемого раствора от его концентрации. 27. Приведите примеры практического применения рефрактометрии при контроле качества пищевой и промышленной продукции. 28. Какие приемы пробоподготовки применяются при проведении рефрактометрического анализа? Процесс рефрактометрического анализа сравнительно прост. Как правило, специальной подготовки вещества не требуется. Иногда растворы необходимо предварительно осветлить, при анализе некоторых растворов требуется удаление тех или иных компонентов, мешающих рефрактометрическому определению. Для рефрактометрических определений используют прозрачные растворы. При анализе молока для получения прозрачного раствора предварительно осаждают белки раствором хлорида кальция. 29. Перечислите достоинства и недостатки рефрактометрического анализа. Недостатки метода: Невысокая чувствительность, его можно использовать для целей количественного анализа, если концентрация определяемого компонента в растворе не ниже 1%. Сравнительно низкая точность количественного рефрактометрического анализа, но она существенно возрастает, если, например, подбором соответствующего растворителя добиться максимальной разницы между показателем преломления компонентов раствора (растворителя и растворенного в нем определяемого вещества). Низкая селективность, обусловленная тем, что показатели преломления для разных веществ могут иметь очень близкие и даже совпадающие значения. Поэтому метод можно надежно использовать только при анализе индивидуальных веществ или растворов, содержащих максимум 2 растворенных вещества. Достоинства метода: − простота и доступность используемого оборудования, простота выполнения измерений, и, как следствие, отсутствие необходимости в высококвалифицированном персонале; − минимальное количество пробы, используемой при измерениях; − экспрессность; − экономичность. 30. Общие понятия инструментального анализа. Инструментальные метода анализа, обладающие многими достоинствами: быстротой анализа, высокой чувствительностью, возможностью одновременного определения нескольких компонентов, сочетания нескольких методов, автоматизации и использования компьютеров для обработки результатов анализа. Общее число физико-химических методов анализа велико – оно составляет несколько десятков, но наибольшее практическое применение находят три группы. Самые распространенные методы анализа: 1) оптические (методы, основанные на взаимодействии вещества с электромагнитным излучением и корпускулярными потоками); 2) электрохимические; 3) хроматографические. 31. Методы обработки результатов инструментального анализа. Различают прямые и косвенные методы анализа. В прямых методах анализа интенсивность проявления физического свойства (величина аналитического сигнала) пропорциональна содержанию определяемого вещества в пробе. Эти методы основаны на изучении диаграмм «состав-свойство». В прямых методах анализа концентрацию (содержание) веществ определяют, используя известную функциональную зависимость между величиной аналитического сигнала и концентрацией (содержанием) определяемого компонента. В косвенных методах анализа то или иное свойство системы используется для фиксирования окончания процесса взаимодействия определяемого вещества с реагентом точно известной концентрации. В косвенных методах (методах титрования) в ходе титрования измеряется интенсивность аналитического сигнала и строится кривая титрования в координатах: интенсивность сигнала – объем добавленного титранта (мл). Способ градуировочного графика. По результатам измерения значений аналитического сигнала пяти-шести стандартных образцов (растворов с различной, но точно известной концентрацией определяемого компонента) строится градуировочная зависимость в координатах «величина аналитического сигнала – концентрация (содержание) определяемого компонента». Для построения градуировочного графика или расчета уравнения градуировочной функции используется метод наименьших квадратов. Способ стандартов. Сущность данного способа состоит в сравнении величины аналитического сигнала стандартного (эталонного) раствора (Yст.) с точно известной концентрацией определяемого компонента (сст.), с величиной аналитического сигнала анализируемого раствора (Yх) с неизвестной концентрацией определяемого компонента (сх). Величины аналитических сигналов должны быть измерены при одинаковых условиях. Способ ограничивающих растворов. Представляет собой вариант способа стандартов, с той лишь разницей, что при его использовании готовят два стандартных раствора. Первый стандартный раствор должен иметь меньшую, а второй - большую концентрацию, чем предполагаемая концентрация определяемого компонента в анализируемой пробе (сэт.,1<сх<сэт.,2). 32. Введение в оптические методы анализа. Классификация. К оптическим методам анализа относят физико-химические методы, основанные на взаимодействии электромагнитного излучения с веществом. Это взаимодействие приводит к различным энергетическим переходам, которые регистрируются экспериментально в виде поглощения излучения, отражения и рассеяния электромагнитного излучения. Оптические методы включают в себя большую группу спектральных методов анализа. Сюда относятся соответственно: 1. Колориметрический анализ; 2. Нефелометрический и турбидиметрический анализ; 3. Рефрактометрический анализ; 4. Поляриметрический анализ; 5. Люминесцентный анализ. 33. Фотометрический метод анализа. Метод количественного анализа. Метод дает возможность определить концентрацию вещества в растворе в тех случаях, когда вещество имеет собственную окраску либо приобретает окраску путем воздействия на него соответствующего химического реагента. Сущность фотометрического анализа заключается в следующем: определяют уменьшение интенсивности потока монохроматического света (т.е. света с определенной, возможно узкой областью спектра) после прохождения его через определенной толщины слой окрашенного раствора и, учтя законы светопоглощения, делают вывод о концентрации растворенного вещества. Величину обозначают символом D и называют оптической плотностью. Основными фотометрическими методами являются колориметрия, фотоэлектроколориметрия и спектрофотометрия. 1) колориметрия – основана на визуальном сравнении интенсивности окраски анализируемого раствора с интенсивностью окраски раствора того же вещества известной концентрации (стандартный раствор). 2) фотоэлектроколориметрия – основана на измерении интенсивности света в видимой части спектра; для монохроматизации света применяются светофильтры; 3) спектрофотометрия – основана на применении монохроматического света как в видимой, так и ультрафиолетовой и инфракрасной областях спектра; для монохроматизации света применяются дифракционные решётки и призмы. 34. Эмиссионный спектральный анализ и пламенная эмиссионная спектроскопия. 35. Применение экстракционно-фотометрических методов в аналитической химии. 36. Атомно-абсорбционный анализ. Способ количественного определения содержания элементов в растворах, распыляемых в пламя ацетилен-воздух, по поглощению излучения атомных линий от специальных селективных ламп. Атомно-абсорбционный анализ – метод аналитической химии, основанный на селективном поглощении (абсорбции) электромагнитного излучения определенной длины волны свободными от всех молекулярных связей нейтральными атомами определяемого элемента. В процессе абсорбции электрон переходит с основного энергетического уровня на более высокий в результате фотонного возбуждения, т.е. облучения светом с определенной частотой. При этом интенсивность возбуждающего света данной частоты уменьшается. Для получения спектра необходимо произвести атомизацию вещества пробы, т.е. превращение ее в атомные пары, для чего его раствор распыляют в пламени или испаряют сухой остаток раствора в электрической печи в интервале температур 2000-3000 oC. В этом температурном интервале более 90% атомов находятся в невозбужденном состоянии и окружающие атомы и молекулы не могут его изменить и, следовательно, не могут повлиять на величину атомного поглощения. Этот факт, наряду с малым количеством линий поглощения, обуславливает высокую избирательность атомно-абсорбционного метода. 37. Нефелометрический и турбидиметрический анализ. Используется явление рассеяния света твердыми частицами, находящимися в растворе во взвешенном состоянии. Нефелометрический метод анализа основан на измерении интенсивности светового потока, рассеянного твердыми частицами, находящихся в растворе во взвешенном состоянии. Турбидиметрический метод анализа основывается на измерении интенсивности потока, прошедшего через раствор, содержащий взвешенные частицы. При турбидиметрических измерениях величина, называемая мутностью, соответствует оптической плотности. Для турбидиметрических измерений можно использовать любой фотометр или спектрофотометр. 38. Люминесцентный анализ. 39. Основные положения хроматографии. Качественный и количественный хроматографический анализ. Классификация методов хроматографии по агрегатному состоянию фаз. Хроматография – это метод разделения и определения веществ, основанный на распределении компонентов между двумя фазами – подвижной и неподвижной. Неподвижной (стационарной) фазой служит твердое пористое вещество (часто его называют сорбентом) или пленка жидкости, нанесенная на твердое вещество. Подвижная фаза представляет собой жидкость или газ, протекающий через неподвижную фазу, иногда под давлением. Компоненты анализируемой смеси (сорбаты) вместе с подвижной фазой передвигаются вдоль стационарной фазы. Разделение сложных смесей хроматографическим способом основано на различной сорбируемости компонентов смеси. В процессе хроматографирования так называемая подвижная фаза (элюент), содержащая анализируемую пробу, перемещается через неподвижную фазу. Обычно неподвижная фаза представляет собой вещество с развитой поверхностью, а подвижная – поток газа или жидкости, фильтрующийся через слой сорбента. При этом происходит многократное повторение актов сорбции – десорбции, что является характерной особенностью хроматографического процесса и обуславливает эффективность хроматографического разделения. Качественный хроматографический анализ, т. е. идентификация вещества по его хроматограмме, может быть выполнен сравнением хроматографических характеристик, чаще всего удерживаемого объема (т. е. объема подвижной фазы, пропущенной через колонку от начала ввода смеси до появления данного компонента на выходе из колонки), найденных при определенных условиях для компонентов анализируемой смеси и для эталона. Количественный хроматографический анализ проводят обычно на хроматографе. Метод основан на измерении различных параметров хроматографического пика, зависящих от концентрации хроматографируемых веществ: высоты, ширины, площади и удерживаемого объема или произведения удерживаемого объема на высоту пика. В аналитической практике используют различные варианты хроматографического разделения: жидкостную – подвижная фаза-жидкость или газовую – подвижная фаза-газ (аргон, азот, водород, гелий, воздух).; колоночную или плоскостную; адсорбционную, распределительную или ионообменную хроматографию. 40. Выбор параметров хроматографических определений. 41. Идентификация веществ, количественный анализ, методы количественного хроматографического анализа. 42. Ионообменная хроматография. Ионная хроматография – это высокоэффективная жидкостная хроматография для разделения катионов и анионов на ионообменниках низкой емкости. Метод основан на эквивалентном обмене ионов раствора на ионы неподвижной твердой фазы. Свойствами ионообменников обладает довольно большое число различных природных и синтетических соединений. В качестве элюентов в ионной хроматографии используют растворы сильных электролитов. 43. Планарная (тонкослойная) хроматография. Тонкослойная хроматография (ТСХ) – это вид планарной хроматографии, в котором неподвижная фаза нанесена тонким слоем на инертную подложку (стеклянную, металлическую или пластиковую), перемещение элюента происходит под действием капиллярных сил в порах между гранулами сорбента. Элюент движется вдоль сорбента и с разной скоростью переносит компоненты смеси, что приводит к их разделению. Для проведения анализа каплю раствора анализируемой смеси наносят на слой сорбента недалеко от конца пластинки. Затем этот конец стеклянной пластинки опускают в хроматографическую камеру с растворителем. Под влиянием капиллярных сил растворитель движется вдоль пластинки, а компоненты анализируемой смеси движутся вместе с растворителем, но с различной скоростью, разделяясь на отдельные зоны. В качестве сорбента используют силикагель, А12O3, СаСO3. При работе с закрепленным слоем его фиксируют на пластинке с помощью гипса или крахмала. Растворители, применяемые в тонкослойной хроматографии, должны быть чистыми и осушенными. Смеси веществ могут разделяться с помощью одного растворителя, однако обычно применяют системы, состоящие из двух, трех. В нашей лабе была смесь этанола с соляной кислотой. Могут быть: вода, гексан, диэтиловый эфир, этанол, бутанол, бензол, кислоты. 44. Практическое применение метода планарной хроматографии. 45. Теоретические основы современных элетрохимических методов анализа. Электрохимическими называют методы анализа, основанные на использовании процессов, происходящих в электрохимической ячейке. Электрохимической ячейкой называется система, состоящая из пары электродов и электролита, контактирующих между собой. Электроды, входящие в состав электрохимической ячейки, могут находиться в одном растворе либо в разных растворах, контактирующих друг с другом с помощью солевого мостика или через пористую перегородку. Ячейки первого типа называются ячейками без жидкостного соединения, второго типа - ячейками с жидкостным соединением.  В некоторых случаях в состав электрохимической ячейки может входить ещё и третий электрод, называемый вспомогательным. Этот электрод служит источником электронов либо, наоборот, играет роль стока электронов и тем самым обеспечивает возможность протекания электрического тока через ячейку. 46. Нефарадеевские методы электрохимического анализа. Прямая потенциометрия и ионометрия. Электрохимические сенсоры в химическом анализе. Потенциометрическими называют методы анализа, основанные на измерении зависимости равновесного электродного потенциала от активности определяемого иона. При потенциометрических измерениях электрохимическая система находится в состоянии равновесия, так как суммарный ток, протекающий между электрохимической системой и внешней измерительной цепью, равен нулю или близок к нему. Проведение измерений ЭДС электрохимических цепей не оказывает влияния на равновесия. . В случае прямой потенциометрии («ионометрии») измеряют величину ЭДС и по ней находят активность (концентрацию) определяемого иона. Электродная реакция, используемая в прямой потенциометрии, обязательно должна быть обратимой. В случае косвенной потенциометрии («потенциометрического титрования») измеряют величину ЭДС, которая изменяется в ходе химической реакции между определяемым веществом и титрантом. В данном методе желательно, чтобы хотя бы одна из полуреакций была обратимой. 47. Фарадеевские методы электрохимического анализа. В основе кулонометрических измерений лежат процессы электролиза, т.е. окислительно-восстановительные реакции, протекающие на электродах при прохождении через анализируемый раствор электрического тока. Кулонометрия – это безэталонный метод анализа. Массу определяемого вещества при кулонометрических определениях рассчитывают непосредственно из величины аналитического сигнала. 48. Амперометрическое титрование. Амперометрическим титрованием называется титриметрический метод анализа, в котором обнаружение конечной точки проводится вольтамперометрически. В качестве индикаторных электродов применяют стационарный и вращающийся платиновый либо графитовый электроды. При проведении амперометрического титрования регистрируют изменение силы тока при добавлении к раствору очередной порции титранта. Титрование проводят при потенциале, соответствующем величине предельного тока. Строят кривую амперометрического титрования в координатах сила тока – объем титранта или степень оттитрованности. Конечную точку титрования находят графически. 49. Кулонометрические методы анализа. Кулонометрическими называют электрохимические методы анализа, основанные на измерении количества электричества, прошедшего через электролитическую ячейку при электрохимическом окислении или восстановлении вещества на рабочем электроде. В основе кулонометрических измерений лежат процессы электролиза, т.е. окислительно-восстановительные реакции, протекающие на электродах при прохождении через анализируемый раствор электрического тока. Кулонометрия – это безэталонный метод анализа. Массу определяемого вещества при кулонометрических определениях рассчитывают непосредственно из величины аналитического сигнала. 50. Неравновесные электрохимические методы. Кондуктометрические методы анализа. Кондуктометрия – это совокупность электрохимических методов анализа, основанных на измерении удельной электропроводности (или сопротивления) растворов электролитов. Контактные кондуктометрические измерения проводят в ячейке для измерения электропроводности. |
