|
1)Эквивалент это реальная или условная частица, которая в кислотноосновных реакциях присоединяет (или отдает) один ион Н или он, в окислительновосстановительных реакциях принимает (или отдает) один электрон,
1)Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Эквивалентная масса элемента – это масса 1 эквивалента элемента. Эh =1г/моль,О = 8, Сl = 35,5 Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента (или Vэ) – объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента. Размерность «л/моль». Закон эквивалентов - вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам. Массы (объемы) реагирующих друг с другом веществ пропорциональны их эквивалентным массам (объемам).
|
2)примеры рассчета эквивалента элемента.Эквивалент Э(элемента) = М(элемента)/валентность элемента; Э(оксида) = Э(элемента) + Э(О) = Э(элемента) + 8; Э(основания) = М(основания)/число замещенных ОН; Э(кислоты) = М(кислоты)/число замещенных Н; Э(соли) = М(соли)/валентность(Ме) *число атомов n(Ме);Э(окислителя или восстановителя) = М(окислителя или восстановителя)/n(число электронов, полученных или отданных атомами или ионами каждой молекулы окислителя или восстановителя).
|
3)основные термодинамические характеристики. Термодинамические параметры - температура, плотность, давление, объем, удельное электрическое сопротивление . Первый закон (первое начало) термодинамики - это, фактически, закон сохранения энергии. Он утверждает, что энергия изолированной системы постоянна. В неизолированной системе энергия может изменяться за счет: а) совершения работы над окружающей средой; б) теплообмена с окружающей средой. Для описания этих изменений вводят функцию состояния - внутреннюю энергию U и две функции перехода - теплоту Q и работу A. Второй закон: S т.е. энтропия(ведет процесс в сторону большего беспорядка) изолированных систем в необратимых процессах может только возрастать, а в состоянии термодинамического равновесия она достигает максимума . 3 закон: Энтальпия (внутренняя энергия Н) - это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
|
4)Энергия Гиббса: ΔG = ΔH – TΔS. Направленность протекания самопроизвольных химических процессов: На равновесную систему действует 2 фактора: энтальпийный (внутренняя энергия Н) и энтропийный ( беспорядок S). Энтальпийный фактор толкает процесс в сторону прямой реакции,т к самопроизвольно идет стремление к минимальной энергии Н. Энтропийный фактор ведет процесс в сторону большего беспорядка, т е в сторону большего числа молекул газообразных веществ. Когда энтальпийный и энтропийный фактор уравниваются, то ΔG = 0, условие химического равновесия.
|
5)термохимический закон гесса. Закон Гесса - количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращениев одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением: ΔH1 = ΔH2 + ΔH3 = ΔH4 + ΔH5 + ΔH6 Тепловой эффект реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов. ΔH.
|
6)Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1. Например для реакции: 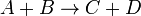 выражение для скорости будет выглядеть так: выражение для скорости будет выглядеть так:
![v = \frac{d[ c ]}{dt} = - \frac{d[ a ]}{dt}](80996_html_e87e32b.png) . Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Для элементарной химической реакции: . Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Для элементарной химической реакции: 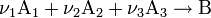 закон действующих масс может быть записан в виде кинетического уравнения вида: закон действующих масс может быть записан в виде кинетического уравнения вида: 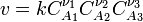 где где 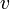 — скорость химической реакции, — скорость химической реакции, 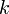 — константа скорости реакции. — константа скорости реакции.
|
7)зависимость скорости химической реакции от температуры. Скорость реакции - это величина, показывающая как изменяется концентрация одного из веществ в единицу времени. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно, химические реакции при высоких температурах протекают быстрее, чем при низких температурах. Возрастание химические реакции при высоких температурах протекают быстрее, чем при низких температурах скорости реакции при нагревании в первом приближении подчиняется следующему правилу: при повышении температуры на 10 0С скорость химической реакции возрастает в два - четыре раза. Температурный коэффициент определяют в соответствии с так называемым «правилом Вант-Гоффа», которое математически выражается уравнением v2/v1 = g (T2 – T1)/10, Зависимость скорости реакции от температуры определяется правилом Вант - Гоффа :

Теория активации: в хим. взаимодействие вступают только активные молекулы(частицы),обладающие энергией, достаточной для осуществления данной реакции. Один из способов активации – увеличение температуры: число активных частиц сильно возрастает, резко увеличивается скорости реакции.
|
8)явление катализа. Ката́лиз — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий. Катализатор изменяет механизм реакции на энергетически более выгодный, то есть снижает энергию активации. Катализатор образует с молекулой одного из реагентов промежуточное соединение, в котором ослаблены химические связи. Это облегчает его реакцию со вторым реагентом. Важно отметить, что катализаторы ускоряют обратимые реакции, как в прямом, так и в обратном направлениях. Катализа́тор — химическое вещество, ускоряющее или замедляющая реакцию, но не входящее в состав продуктов реакции. Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества . Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды. В биохимических реакциях роль катализаторов играют ферменты. Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Химическая реакция между началом и завершением претерпевает некое «переходное состояние», при котором образуется неустойчивый «активированный комплекс». Суть теории переходного состояния (активированного комплекса): 1)частицы реагентов при взаимодействии теряют свою кинетическую энергию, которая превращается в потенциальную, и для того чтобы реакция свершилась, необходимо преодолеть некий барьер потенциальной энергии;
2) разница между потенциальной энергией частиц и упомянутым энергетическим барьером и есть энергия активации;
3) переходное состояние находится в равновесии с реагентами;
4) в тех реакциях, где энергия активации существенно ниже энергии разрыва химических связей, процессы образования новых связей и разрушения старых связей могут полностью или частично совпадать по времени.
|
9)химическое равновесие с точки зрения термодинамики. Хим. равновесие устанавливается в обратимых реакциях, когда скорость прямой реакции выравнивается со скоростью обратной. 2 фактора: энтальпийный (внутренняя энергия Н) и энтропийный (беспорядок S). А2 + В2 ⇄ 2AB Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Kp зависит от температуры и природы реагирующих веществ. Для mA + nB = pC + qD K = [C]^p[D]^q/[A]^m[B]^n
10) Смещение химического равновесия, Принцип Ле Шателье: Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрацииФакторы влияющие на химическое равновесие: 1) температура При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции. CaCO3=CaO+CO2 -Q t↑ →, t↓ ← ;N2+3H2↔2NH3 +Q t↑ ←, t↓ →; 2) давление При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся. CaCO3=CaO+CO2 P↑ ←, P↓ →; 1моль=1моль+1моль. 3) концентрация исходных веществ и продуктов реакции При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции-в сторону исходных веществ. S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ←; Катализаторы не влияют на смещение химического равновесия!
12) Способы выражения концентрации растворов: наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию. Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m : w(B)= m(B) / m. w(B) обычно выражают в долях единицы или в процентах. Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора. C(B) = n(B) / V = m(B) / (M(B) · V), где М(B) - молярная масса растворенного вещества г/моль. Молярная концентрация измеряется в моль/л и обозначается "M". Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
|
11)агрегатные состояния. Агрега́тное состоя́ние — состояние вещества, характеризующееся определёнными качественными свойствами: способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. Раствор — однофазная система переменного состава, состоящая из двух или более компонентов. Растворы — гомогенные (однородные) системы, то есть каждый из компонентов распределён в массе другого в виде молекул, атомов или ионов. Твёрдые, жидкие, газообразные растворы. Чаще под раствором подразумевается жидкое вещество, например раствор соли или спирта в воде (или даже раствор золота в ртути — амальгама). Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше. В химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким, твёрдым (твёрдый раствор), газообразным. Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе. Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое его количество. Пересыщенный раствор — раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе, избыток вещества легко выпадает в осадок. Обычно пересыщенный раствор получают охлаждением раствора, насыщенного при более высокой температуре (пересыщение).
|
13)осмос. закон вант-гоффа. О́смос — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя). Закон Вант – Гоффа: Росм = С(м)RT, где С(м) – молярная концентрация раствора; R – универсальная газовая постоянная; Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, некоторых из растворенных в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворенном состоянии внутри клетки, она непроницаема. Поэтому белки, столь важные для биологических процессов, остаются внутри клетки. Осмос участвует в переносе питательных веществ в стволах высоких деревьев, где капиллярный перенос не способен выполнить эту функцию.
18)зависимость степени диссоциации слабого электролита от концентрации. Зависимость степени диссоциации (α) от концентрации (с): с – сα = с( 1 – α ) Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора: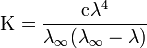 Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства 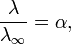 где α — степень диссоциации. где α — степень диссоциации.
|
14) давление пара растворителя над расствором .1 закон Рауля: Δtкип = ЕС(м) 2 закон Рауля: Δtзам = КС(м) Где: Е(воды) – эбуллиосокпическая константа, зависящая от природы растворителя; К – криоскопическая константа, зависящая только от природы растворителя; С(м) – моляльная концентрация(число моль вещества в 1 кг растворителя). Для растворов электролитов с учетом изотонического коэффициента «i». Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом. Относительное понижение парциального давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества.
15) Кипение и замерзание растворов: t(кипения растворов) = t(кипения воды) + Δt(кипения); t(замерзания раствора) = t(замерзания воды) – Δt(замерзания). Δt(кипения) = ЕС(м) – 1 закон Рауля; Δt(замерзания) = KC(м) – 2 закон Рауля. Е – эбуллиоскопическая константа, зависящая от природы растворителя; К – криоскопическая константа, зависящая только от природы растворителя; С(м) – моляльная концентрация(число моль вещества в 1 кг растворителя). Для растворов электролитов только с изотоническим коэффициентом i, который связан со степенью диссоциации электролита.
16) отклонение поведения растворов электролитов от неэлектролитов.Для растворов электролитов только законы Ван-Гофа и Рауля применяются только с изотоническим коэффициентом i, который связан со степенью диссоциации электролита. i = 1 + α(n-1). Он показывает, во сколько раз все величины (Росм, Δt(кипения), Δt(замерзания)) для растворов электролитов больше чем для растворов неэлектролитов при всех одинаковых условиях. Диссоциация электролита ведет к увеличению числа частиц в растворе, как бы увеличивает концентрацию раствора.
19) равновесие в растворах слабых электролитов. Сильные электролиты существуют в растворах только в виде ионов: гидроксид аммония NH4OH = NH4+ + OH-; в растворах слабых электролитов устанавливается равновесие между непродиссоциировавшими молекулами (их много) и ионами (мало). Установившееся равновесие может смещаться при введении одноименных или связывающих ионов. Одноименные – одинаковые ионы, ослабляют (замедляют) диссоциацию слабого электролита. Связывающие – такие ионы, которые с другими образуют молекулы газа, осадка или слабого электролита, усиливают диссоциацию слабого электролита.
| |
|
|
 Скачать 181.94 Kb.
Скачать 181.94 Kb.