задачи термодинамика. 250. Вычислите стандартную энтальпию реакции, протекающей в газовой фазе
 Скачать 38.38 Kb. Скачать 38.38 Kb.
|
|
2-50. Вычислите стандартную энтальпию реакции, протекающей в газовой фазе: 3СО + О3 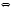 3СО2 3СО2 2-51. Вычислите стандартную энтальпию реакции 2СН3С1(г) + 3O2(г) 2СO2(г) + 2Н2О(ж) + 2НС1(г), используя табличные значения стандартных энтальпий образования веществ. 2-52. Вычислите стандартную энтальпию сгорания ацетона, воспользовав шись необходимыми для этого стандартными энтальпиями образования. 2-53. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания 2С2Н5OН(ж) 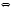 C2H5OC2H5(ж) + Н2O(ж) C2H5OC2H5(ж) + Н2O(ж) 2-54. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания C2H6(г) + Н2(г) 2СН4 (г), 2-55. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания C2H2(г) + 2H2(г) 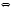 C2H6(г) C2H6(г)2-56. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания C6H5NO2(ж) + 3H2(г) 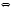 C6H5NH2(ж) +2Н2O(ж) C6H5NH2(ж) +2Н2O(ж) 2-57. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания CO + 3H2 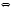 CH4 + H2O (все газы) CH4 + H2O (все газы) 2-58. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания C6H6(ж) + 3H2(г) 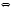 C6H12(ж) C6H12(ж)2-59. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания 6СН4 + 4O2 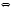 С2Н2 +8H2 + ЗСО + СО2 + ЗН2O (все газы) С2Н2 +8H2 + ЗСО + СО2 + ЗН2O (все газы) 2-60. Вычислите стандартную энтальпию образования этанола, воспользо вавшись необходимыми для этого стандартными энтальпиями сгорания. 2-61. Вычислите двумя способами (с использованием стандартных энтальпий образования и стандартных энтальпий сгорания) стандартную энтальпию гидрирования бензола (ж) до циклогексана(ж). 2-62. Вычислите двумя способами (с использованием стандартных энтальпий образования и стандартных энтальпий сгорания) стандартную энтальпию реакции каталитического окисления метана (г) до метанола (ж). 2-63. Вычислите количество теплоты, которое выделится при взрыве смеси, содержащей 5,6 л водорода и 22,4 л кислорода (объемы измерены при нормальных условиях). 2-64. Вычислите количество теплоты, которое выделится при полном оки слении в организме 90 г глюкозы. 2-65. Вычислите количество теплоты, выделяющееся в реакции а) взаимодействия калия массой 3,9 г с водой; б) при окислении 1,12 л (н.у.)оксида углерода (II). 2-66. Какое количество теплоты потребуется для разложения карбоната кальция массой 2 кг? 2-67. Один сорт сметаны содержит в 100 г 15,0 г жиров, 2,9 г белка, 3,0 г углеводов; другой сорт – 25,0 г, 2,6 г и 2,7 г соответственно. Вычислите для каждого сорта сметаны массы, эквивалентные энергетической ценности 200 ккал (1 кал = 4,18 Дж). 2-68. Стандартная теплота образования CO(г) равна - 111 кДж/моль. При сгорании 1 моль СО выделяется 283 кДж теплоты. Не прибегая к другим справочным данным, вычис лите стандартную энтальпию образования углекислого газа. 2-69. Вычислите стандартную энтальпию реакции : S(тв) + O2(г) 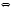 SO2(г), используя данные: SO2(г), используя данные: 2S(тв) + 3O2(г) 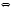 2SO3(г), H = -790 кДж/моль 2SO3(г), H = -790 кДж/моль 2SO2(г) + O2(г) 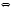 2SO3(г), H = -196 кДж/моль 2SO3(г), H = -196 кДж/моль 2-70. Вычислите стандартную энтальпию реакции 4KClO3 (т) 3KClO4 (т) + KCl (т), используя значения Ho следующих реакций: 2KClO3 (т) 2KCl (т) + 3O2 (г); Ho = - 99 кДж/моль KClO4 (т) KCl (т) + 2O2 (г); Ho = 33 кДж/моль 2-71. Стандартная энтальпия растворения сульфата меди равна -66,5 кДж/моль, стандартная энтальпия гидратации сульфата меди(П) до пентагидрата равна -78,22 кДж/моль. Вычислите стандартную теплоту растворения CuSO4∙5H2O. 2-72. Вычислите стандартную энтропию реакции С2Н4(г) + Н2O(ж) 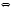 С2Н5ОН(ж) С2Н5ОН(ж) 2-73. Вычислите стандартную энтропию реакции 2NH2CH2СООН(тв) NH2CH2СОNHCH2СООН(тв) + Н2O(ж) 2-74. Вычислите стандартные энтропии реакций хлорирования метана с образованием следующих продуктов: а) хлорметана; б) дихлорметана; в) трихлорметана; г) тетрахлорметана; (все - в газообразном состоянии). 2-75. Вычислите, какая из четырех стадий хлорирования метана до тетрахлорметана характеризуется максимальным значением (по абсолютной величине ) а) стандартной энтальпии; б) стандартной энтропии. 2-76. Вычислите стандартную энтропию оксида бария, пользуясь только нижеприведенными значениями изменения энтропии: BaO (т) + H2O (ж) Ba(OH)2 (т); So = - 79 Дж/(мольК) 2H2 (г) + O2 (г) 2H2O (ж); So = - 245 Дж/(мольК) Ba (т) + H2 (г) + O2 (г) Ba(OH)2 (т); So = - 295 Дж/(мольК) 2-77. Вычислите стандартное изменение энергии Гиббса гликолиза: C6H12O6(aq) 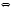 2C3H6O3(aq) 2C3H6O3(aq) 2-78. Вычислите стандартное изменение энергии Гиббса каталитического окисления этанола в присутствии каталазы: Н2O2(ж) + С2Н5OН(ж) 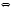 СН3СОН(г) + 2Н2O(ж) СН3СОН(г) + 2Н2O(ж) 2-79. Вычислите стандартное изменение энергии Гиббса реакции СН3С(О)СОО-(пируват-ион) (ж) + Н+ 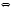 СН3С(О)Н(г) + CO2(г) СН3С(О)Н(г) + CO2(г)2-80. Вычислите стандартное значение энергии Гиббса образования сероуглерода CS2 (ж), используя справочные данные и значение Go реакции CS2 (ж) + 3O2 (г) CO2 (г) + 2SO2 (г); Go = - 930 кДж/моль. 2-81. Вычислите стандартное значение энергии Гиббса гидратации -лактоглобулина при 25 С, для которого Н = -6,75 кДж/моль и S = -9,74 Дж/(мольК). Оцените вклад энтальпийного и энтропийного факторов. 2-82. Вычислите стандартное значение энергии Гиббса тепловой денатурации химотрипсиногена при pH 2 и 50 С, для которого Н = +417 кДж/моль и S = + 1,32 кДж/(мольК). Оцените вклад энтальпийного и энтропийного факторов. 2-83. Вычислите стандартное значение энергии Гиббса гидратации сывороточного альбумина при 25 С, для которого Н = -6,08 кДж/моль и S = -5,85 кДж/(мольК). Оцените вклад энтальпийного и энтропийного факторов. 2-84.Оцените роль энтропийного и энтальпийного факторов для реакции: 4НС1(г) + О2(г) 2С12(г) + 2Н2O (ж). Возможно ли самопроизвольное протекание этой реакции? Если да, то при каких (низких, высоких, любых) температурах? 2-85. Оцените роль энтропийного и энтальпийного факторов для реакции: Н2O2(ж) + О3(г) 2O2(г) + Н2O(ж). Возможно ли самоп роизвольное протекание этой реакции? Если да, то при каких (низ ких, высоких, любых) температурах? 2-86. Константа равновесия реакции тепловой денатурации химотрипсиногена при pH 2 и 50 С равна 32,7. Вычислите значение стандартной энтальпии процесса, если известно, что S = +1,32 кДж/(мольК). 2-87. Константа равновесия реакции гидратации сывороточного альбумина при 25 С равна 1,19. Вычислите значение стандартной энтропии процесса, если известно, что Н = -6,08 кДж/моль. 2-88. Вычислите G° реакции гидратации яичного альбумина при 25 C, если для этого процесса H = -6,58 кДж/моль; S° = -9,5 Дж/(мольК). Оцените роль энтальпийного и энтропийного факторов. 2-89. Для некоторой реакции при 227 °С H = - 50 кДж/моль, а S = - 100 Дж/(мольК). Вычислите константу равновесия реакции при указанной температуре. 2-90. Для нижеприведенной реакции рассчитайте G при 298 К; вычислите температуру, при которой оба направления процесса равноверо ятны. 2NO2(г) 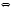 N2O4(г), Н = -57 кДж/моль; S = -176 кДж/(мольК). N2O4(г), Н = -57 кДж/моль; S = -176 кДж/(мольК). 2-91. Рассчитайте температуру, при которой равновероятны оба направления реакции синтеза аммиака из азота и водорода. 2-92. Рассчитайте температуру, при которой равновероятны оба направления реакции каталитического окисления оксида серы(IV) кислородом до оксида серы(VI). 2-93. Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для гидролиза сложноэфирной связи; G = -10,48 кДж/моль. 2-94. Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для переноса ацетильной группы при гидролизе ацетилкофермента А, G = -34,36 кДж/моль. 2-95. Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для реакции АТФ + АМФ 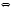 2АДФ, G = -2,10 кДж/моль. 2АДФ, G = -2,10 кДж/моль. 2-96. Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для реакции креатин + фосфат  креатинфосфат + H2O ; G = +29,33 кДж/моль. креатинфосфат + H2O ; G = +29,33 кДж/моль. 2-97. Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для дегидратации лимонной кислоты с образованием цис-аконитовой кислоты , G = +8,36 кДж/моль. 2-98. Сделайте заключение о практической обратимости реакции в стандартном состоянии, рассчитав константу равновесия при 310 К для гидратации цис-аконитовой кислоты с образованием изолимонной кислоты , G = -1,68 кДж/моль. 2-99. Константа равновесия реакции N2O4 (г)  2NO2 при 25 С равна 4,64·10-3. В каком направлении будет идти реакция при следующих концентрациях веществ: 2NO2 при 25 С равна 4,64·10-3. В каком направлении будет идти реакция при следующих концентрациях веществ: а) с(NO2) = 0,05 моль/л; с(N2O4) = 0,2 моль/л б) с(NO2) = 0,1 моль/л; с(N2O4) = 0,05 моль/л 2-100. Константа равновесия реакции PCl5(г)  PCl3(г) + Cl2(г) при 250 С равна 2. В каком направлении идет реакция при следующих концентрациях: с(PCl3) = c(PCl5) = 1 моль/л; с(Cl2) = 2 моль/л? PCl3(г) + Cl2(г) при 250 С равна 2. В каком направлении идет реакция при следующих концентрациях: с(PCl3) = c(PCl5) = 1 моль/л; с(Cl2) = 2 моль/л? 2-101. Определите направление реакции Н2 + I2 = 2НI ( все газы) при 298 К при следующих концентрациях: а) с(Н2) = с(I2) = 0,01 моль/л; c(НI) = 1,0 моль/л б) с(Н2) = с(I2) = 0,1 моль/л; c(НI) = 0,01 моль/л 2-102. При 300 К константа равновесия реакции трансаминирования: L-глутаминовая кислота + пировиноградная кислота  2-оксоглутаровая кислота + L-аланин равна 1. В каком направлении будет идти реакция при следующих концентрациях; L-глутаминовая кислота и пируват по 0,00003 моль/л, 2-оксоглутаровая кислота и L-аланин по 0,005 моль/л ? 2-103. Константа равновесия реакции этерификации, протекающей между этанолом и уксусной кислотой, при 25 С равна 4. В каком направлении будет идти реакция при следующих концентрациях веществ: а) с(вода) = с(эфир) = 2 моль/л; с (кислота) = 1 моль/л; с(спирт) = 0,05 моль/л; б) с(вода) = с(эфир) = с(кислота) = 2 моль/л; с(спирт) = 4 моль/л; 2-104. Для реакции синтеза аммиака из простых веществ равновесные концентрации при некоторой температуре равны: аммиака 4 моль/л, азота 3 моль/л, водорода 9 моль/л. Каким будет направление процесса при концентрациях всех реагентов, равных 5 моль/л. 2-105. При температуре 800 °C равновесные концентрации оксида серы(IV), кислорода и оксида серы(VI) составили 3 ммоль/л, 3,5 ммоль/л и 50 ммоль/л соответственно. При этой же температуре смешали в объеме 2 л по 0,05 моль каждого вещества. Увеличится или уменьшится концентрация оксида серы(VI) в системе по достижении состояния равновесия? |
